[2024 – 2025] Thi học kỳ 1 Hóa 10 sở GDĐT Bắc Ninh
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 001-HK1B
⇒ Thời gian làm bài: 45 phút
⇒ Đề thi, đáp án và giải chi tiết:
| 1D | 2B | 3C | 4B | 5B | 6C | 7D | 8C | 9D | 10C |
| 11A | 12A | 13: (a)-Đ (b)-S (c)-Đ (d)-Đ | 14: (a)-Đ (b)-Đ (c)-S (d)-S | ||||||
PHẦN I. CÂU TRẮC NGHIỆM NHIỀU PHƯƠNG ÁN LỰA CHỌN (3,0 điểm) Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1: Nguyên tử của nguyên tố aluminium (Z = 13) có cấu hình electron là
A. 1s2 2s2 2p6 3s2 3p2. B. 1s2 2s2 2p6 3s2 3p3.
C. 1s2 2s2 2p6 3s2. D. 1s2 2s2 2p6 3s2 3p1.
(Xem giải) Câu 2: Độ âm điện là đại lượng đặc trưng cho khả năng hút electron liên kết của một nguyên tử trong phân tử. Nguyên tử có độ âm điện lớn nhất là
A. Chlorine (Cl). B. Fluorine (F). C. Nitrogen (N). D. Sodium (Na).
(Xem giải) Câu 3: Liên kết hóa học trong phân tử nào dưới đây là liên kết ion?
A. CH4. B. Cl2. C. KCl. D. HCl.
(Xem giải) Câu 4: Liên kết hóa học trong phân tử nào dưới đây là liên kết cộng hóa trị không phân cực?
A. H2O. B. O2. C. NaF. D. HI.
(Xem giải) Câu 5: Năng lượng liên kết (kJ/mol) của các chất có giá trị tương ứng như sau: HF = 565, HCl = 427, HBr = 363, HI = 295. Liên kết trong phân tử nào sau đây bền nhất?
A. HCl. B. HF. C. HI. D. HBr.
(Xem giải) Câu 6: Kí hiệu phân lớp electron nào sau đây sai?
A. 1s. B. 2p. C. 2d. D. 3p.
(Xem giải) Câu 7: Nguyên tử của nguyên tố chlorine (Cl) có cấu hình electron [Ne] 3s2 3p5. Trong bảng tuần hoàn, nguyên tố chlorine thuộc nhóm
A. VA. B. IIIA. C. IA. D. VIIA.
(Xem giải) Câu 8: Trong chu kì 3, theo chiều tăng dần của điện tích hạt nhân nguyên tử
A. bán kính nguyên tử và độ âm điện đều giảm. B. bán kính nguyên tử và độ âm điện đều tăng.
C. bán kính nguyên tử giảm và độ âm điện tăng. D. bán kính nguyên tử tăng và độ âm điện giảm.
(Xem giải) Câu 9: Cho cấu tạo mạng tinh thể NaCl như hình bên:
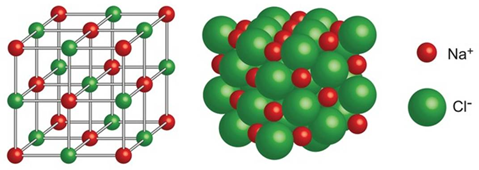
Trong tinh thể NaCl, mỗi ion Na+ được bao quanh bởi bao nhiêu ion Cl- gần nhất?
A. 3. B. 4. C. 5. D. 6.
(Xem giải) Câu 10: Ở trạng thái cơ bản, số electron đã ghép đôi và số electron độc thân trong nguyên tử oxygen lần lượt là
A. 4 và 4. B. 5 và 3. C. 6 và 2. D. 8 và 0.
(Xem giải) Câu 11: Phân tử nitrogen (N2) có công thức Lewis như sau: :N≡N:
Trong phân tử N2, giữa hai nguyên tử N có bao nhiêu cặp electron chung?
A. 3. B. 2. C. 1. D. 4.
(Xem giải) Câu 12: Cho bảng số liệu sau:
| Chất | Nước (H2O) | Hydrogen sulfide (H2S) | Ammonia (NH3) | Oxygen (O2) | Ethanol (C2H5OH) |
| Nhiệt độ sôi (°C) ở 1 bar | 100,0 | -60,7 | -33,0 | -183,0 | 78,3 |
Trong số các chất trên, có bao nhiêu chất là chất khí ở điều kiện thường?
A. 3 . B. 4. C. 2. D. 1.
PHẦN II. CÂU TRẮC NGHIỆM ĐÚNG SAI (2,0 điểm). Thí sinh trả lời từ câu 13 đến câu 14. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng (Đ) hoặc sai (S)
(Xem giải) Câu 13: Ammonia là một hợp chất quan trọng trong công nghiệp. Mỗi năm có hàng trăm triệu tấn ammonia được sản xuất trên toàn cầu, trong đó có khoảng 80% được sử dụng cho sản xuất phân đạm ammonium, urea, … để cung cấp nguyên tố nitrogen cho đất và cây trồng. Ammonia có công thức phân tử là NH3. Cho biết số hiệu nguyên tử của: H (Z = 1), N (Z = 7).
a) Trong bảng tuần hoàn, nguyên tố nitrogen thuộc ô số 7.
b) Tổng số hạt mang điện trong một phân tử NH3 là 10.
c) Liên kết hóa học trong phân tử NH3 là liên kết cộng hóa trị phân cực.
d) Trong phân tử NH3 có 3 liên kết sigma (σ).
(Xem giải) Câu 14: Nguyên tử của nguyên tố potassium (K) có cấu hình electron là [Ar]4s1
a) Nguyên tử potassium có 19 electron.
b) Hydroxide của nguyên tố potassium là KOH; KOH thể hiện tính base mạnh.
c) Khi tham gia liên kết hóa học, nguyên tử potassium có xu hướng nhận 1 electron tạo ion K+.
d) So với các nguyên tố trong cùng chu kì, potassium có bán kính nguyên tử nhỏ nhất.
PHẦN III. TỰ LUẬN (5,0 điểm)
(Xem giải) Câu 15: (2,5 điểm)
a) Hoàn thành các quá trình sau:
(1) Mg → Mg2+ + ….?…. e
(2) Cl + …..?… e → Cl-
(3) O + ……?.. e → O2-
b) Viết công thức phân tử của hợp chất ion tạo bởi các cặp ion sau:
(1) Cation Mg2+ với anion Cl-
(2) Cation Mg2+ với anion O2-.
(Xem giải) Câu 16: (2,5 điểm) Nguyên tử của nguyên tố X có tổng số hạt cơ bản (proton, electron, neutron) là 24, trong đó tổng số hạt mang điện gấp hai lần tổng số hạt không mang điện.
a) Xác định nguyên tố X. (Cho biết số hiệu nguyên tử của một số nguyên tố: C = 6, N = 7, O = 8, F = 9, Na = 11, Mg = 12)
b) Viết công thức electron, công thức Lewis, công thức cấu tạo của các phân tử: H2X, CX2 (H là nguyên tố hydrogen, C là nguyên tố carbon).
c) Dựa vào cấu trúc phân tử, giải thích tại sao phân tử H2X phân cực, phân tử CX2 không phân cực?

Bình luận