[2024 – 2025] Thi chọn HSG trường Chu Văn An – Hà Nội (Lần 2)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 043-H12C năm 2024-2025
⇒ Thời gian làm bài: 180 phút
Câu 1. (3,5 điểm):
(Xem giải) 1.1. (1 điểm) Cho sơ đồ chuyển hóa của phân tử glucose từ dạng mạch hở thành dạng vòng 6 cạnh:
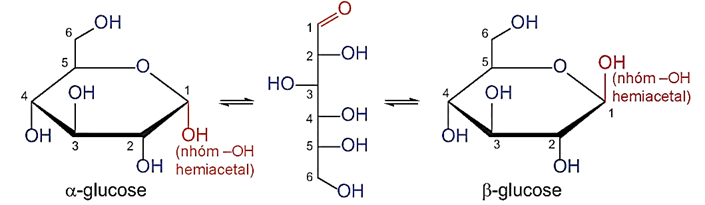
a) Viết phương trình hóa học thể hiện tính chất riêng của nhóm -OH hemiacetal (kèm theo điều kiện phản ứng)
b) Trong điều kiện phản ứng trên chỉ có -OH hemiacetal trong phân tử glucose phản ứng còn các nhóm -OH khác thì không phản ứng? Giải thích?
(Xem giải) 1.2. (1 điểm) Rutin là hợp chất hữu cơ có trong nụ hoa hòe, có tác dụng làm giảm các chứng suy giảm tĩnh mạch, giảm cholesterol trong máu. Ngoài ra rutin còn được dùng để điều chế thuốc quercetin có tác dụng chống oxy hóa mạnh, kháng viêm, chống dị ứng, ngăn ngừa tế bào ung thư. Công thức cấu tạo của rutin và quercetin cho ở hình dưới đây:
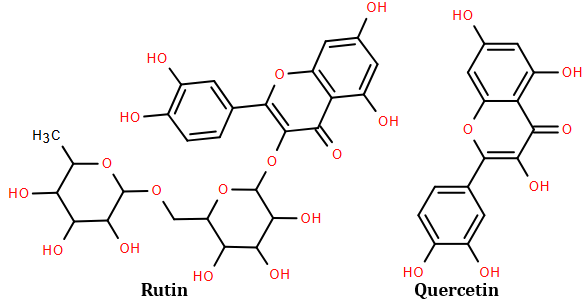
Trong môi trường acid, một phân tử rutin phản ứng với hai phân tử nước thu được sản phẩm gồm quercetin, glucose và rhamnose.
a) Xác định công thức phân tử của rhamnose.
b) Biết hàm lượng quercetin trong một viên thuốc có khối lượng 500 mg là 96,64% về khối lượng, phần còn lại là tá dược khác. Để sản xuất 1 triệu viên thuốc trên, cần bao nhiêu kg bột hoa hòe? (Biết hàm lượng rutin trong bột hoa hòe là 30,20%, phần còn lại không tạo ra quercetin; hiệu suất toàn bộ quá trình sản xuất đạt 80%).
(Xem giải) 1.3. (1,5 điểm) Đồ thị hình bên biểu diễn nồng độ theo thời gian phân huỷ dinitrogen tetraoxide ở 100°C, trong bình kín dung tích 1,0 L theo phản ứng: N2O4 (g, không màu) ⇌ NO2 (g, nâu đỏ)
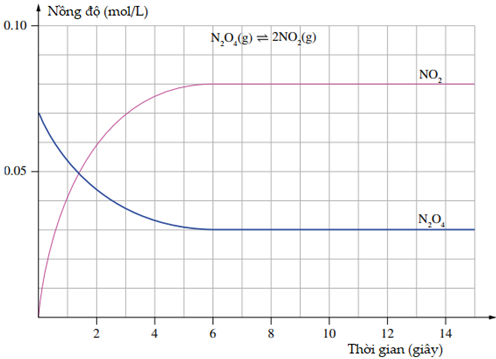
Sử dụng đồ thị để trả lời các câu hỏi sau:
a) Nồng độ N2O4 và NO2 ban đầu trong bình là bao nhiêu?
b) Nồng độ của N2O4, NO2 lúc cân bằng là bao nhiêu?
c) Khi phản ứng đạt trạng thái cân bằng, có bao nhiêu mol N2O4 bị phân hủy?
d) Các vùng nằm ngang của đồ thị biểu thị điều gì?
e) Thời gian (theo giây) để hệ đạt được trạng thái cân bằng là bao nhiêu?
f) Một học sinh nghiên cứu phản ứng này ghi lại những quan sát của cô ấy theo thời gian. Hiện tượng bạn học sinh sẽ quan sát được khi phản ứng diễn ra là gì?
(Xem giải) Câu 2. (3,0 điểm) Hợp chất đơn giản của nguyên tố X thu được vào ngày 26 tháng 6 năm 1886 ở Paris. Người khám phá ra hợp chất này sau đó đã được trao tặng giải Nobel Hóa học vào năm 1906. Tên của hợp chất trong tiếng Latin có nghĩa là “dòng chảy”. Trong tự nhiên, X được tìm thấy phổ biến ở 3 loại khoáng vật, trong đó được biết đến rộng rãi nhất là khoáng vật A, có thành phần là hợp chất lưỡng nguyên tố của X, 2 khoáng chất còn lại là topaz và sellite. Một mẫu chất A nặng 0,5733 gam được xử lý với lượng dư sulfuric acid đặc nóng, toàn bộ khí B thoát ra được hấp thụ vào trong 1 lít nước, pha loãng tiếp 10 lần thì dung dịch thu được có pH = 3,145. Hằng số phân ly của B trong dung dịch là 6,8.10^-4.
a) Xác định nguyên tố X.
b) Viết công thức hợp chất đơn giản nhất của nguyên tố X.
c) Xác định cấu tạo của khoáng vật A. Giải thích và viết phương trình phản ứng.
Câu 3. (4,5 điểm):
(Xem giải) 3.1. (1,5 điểm). Tiến hành pha dung dịch borax có nồng độ C₀ = 0,050M từ chất rắn Na2B4O7.10H2O trong bình định mức 100 mL. Dùng pipette lấy chính xác 10 mL dung dịch borax cho vào bình tam giác, thêm 2 giọt chỉ thị methyl red rồi chuẩn độ bằng dung dịch HCl Cx M đến khi dung dịch chuyển sang màu đỏ thì dừng. Đọc và ghi lại thể tích trên burette. Phản ứng chuẩn độ xảy ra như sau:
B4O72- + 2H+ + 5H2O → 4H3BO3
a) Tính khối lượng borax cần dùng và trình bày ngắn gọn cách pha dung dịch borax từ chất rắn.
b) Hình bên mô tả cách đọc thể tích dung dịch trong pipette khi lấy borax vào bình tam giác (để dễ quan sát chất lỏng được mô tả có màu). Hãy chọn cách quan sát đúng trong hình bên (chọn cách I hoặc cách II).
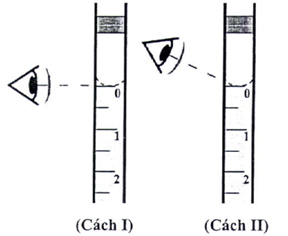
c) Nếu bình định mức pha dung dịch borax có thể tích nhỏ hơn 100 mL (lỗi do quá trình sản xuất) thì dẫn đến sai số trong phép xác định nồng độ HCl. Giả sử chỉ xem xét đến sự sai lệch thể tích của bình định mức, hãy cho biết nồng độ HCl xác định được từ kết quả chuẩn độ cao hơn hay thấp hơn so với giá trị thực? Giải thích.
(Xem giải) 3.2. (1,5 điểm) Pin nhiên liệu cung cấp năng lượng điện và nhiệt giải phóng khi pin hoạt động. Cấu tạo pin nhiên liệu được mô tả bằng hình vẽ sau:
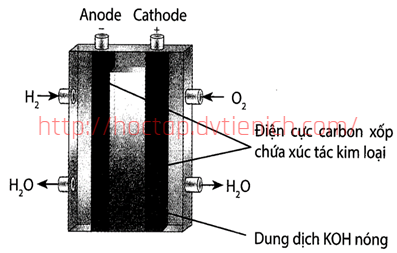
Nhiều hãng sản xuất xe đã nghiên cứu xe sử dụng năng lượng tái tạo là hydrogen, sử dụng tế bào nhiên liệu để chuyển hóa năng lượng và dùng động cơ điện để vận hành. Dựa trên mô tả về cấu tạo của pin hãy:
a) Viết các bán phản ứng xảy ra ở mỗi điện cực và phương trình xảy ra trong pin nhiêu liệu trên.
b) Nêu một ưu điểm nổi bật và một hạn chế của pin nhiêu liệu.
c) Tính sức điện động của pin biết E°anode = -0,40V và E°cathode = 0,83V.
(Xem giải) 3.3. (1,5 điểm) Năm 1965, trong quá trình tổng hợp thuốc chống loét dạ dày, nhà hóa học James M. Schlatter (Mỹ) đã vô tình phát hiện hợp chất X (một chất ngọt nhân tạo với tên thường gọi là “Aspartame”) có cấu tạo như hình dưới:
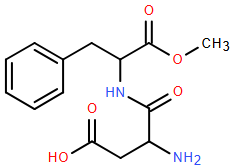
Aspartame ngọt hơn khoảng 200 lần so với đường ăn thông thường. Aspartame thường được sử dụng trong đồ uống và thực phẩm dành cho người ăn kiêng vì có ít calo hơn đường thông thường. Tổ chức Y tế thế giới (WHO) thông báo xếp chất làm ngọt nhân tạo aspartame vào danh sách các chất “có thể gây ung thư cho con người” nhưng lưu ý chất này vẫn an toàn nếu được tiêu thụ trong giới hạn khuyến nghị hằng ngày. Hướng dẫn của WHO đã không thay đổi kể từ năm 1981: tối đa 40 miligam aspartame/mỗi kg trọng lượng cơ thể/ngày. Các khuyến nghị của Mỹ “hào phóng” hơn một chút: Vào năm 1983, FDA (Cục quản lý Thực phẩm và Dược phẩm Hoa Kỳ) đưa ra mức 50 miligam/mỗi kg trọng lượng cơ thể/ngày. Hiệp hội Đồ uống Mỹ cho biết soda dành cho người ăn kiêng thường chứa trung bình 100 miligam aspartame mỗi lon.
a) Tính phần trăm khối lượng của oxygen trong chất X.
b) Số lon soda mà một người nặng trung bình ở Mỹ là 83kg nên uống theo khuyến nghị về lượng aspartame giới hạn hằng ngày của WHO và FDA hơn kém nhau khoảng bao nhiêu lon?
c) Viết phương trình hóa học của X với dung dịch NaOH dư.
Câu 4. ( 3,5 điểm):
(Xem giải) 4.1. (1,5 điểm) Cho sơ đồ chuyển hóa sau:
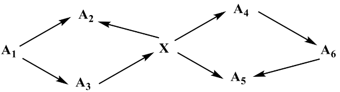
Biết: X là nguyên tố kim loại tham gia vào quá trình tổng hợp hemoglobin trong máu, giúp vận chuyển oxygen từ phổi đến các tế bào, đơn chất tạo bởi nguyên tố X có từ tính; A1, A2, A3, A4, A5, A6 là hợp chất chứa X; A3 là oxide chứa 30% oxygen. Đốt cháy A1 thu được A3 và khí có mùi hắc.
Và: MA3 + MA5 = 340; MA2 – MA1 = 280; MA4 > MA3 > MA6 > MA1
Xác định các chất A1, A2, A3, A4, A5, A6 và viết các phương trình hóa học thực hiện dãy chuyển hóa.
(Xem giải) 4.2. (2,0 điểm) Hiện nay người ta sản xuất ammonia bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí methane (thành phần chính của khí thiên nhiên).
Phản ứng điều chế H2: CH4 + 2H2O → CO2 + 4H2 (1)
Phản ứng loại O2 để thu N2: CH4 + 2O2 → CO2 + 2H2O (2)
Phản ứng tổng hợp NH3: N2 + 3H2 ⇋ 2NH3 (3)
a) Để sản xuất khí ammonia, nếu lấy 841,4 m³ không khí (chứa 21,03% O2; 78,02% N2, còn lại là khí hiếm theo thể tích), thì cần phải lấy bao nhiêu m³ khí methane và bao nhiêu m³ hơi nước để có đủ lượng N2 và H2 theo tỉ lệ 1 : 3 về thể tích dùng cho phản ứng tổng hợp ammonia. Giả thiết các phản ứng (1), (2) đều xảy ra hoàn toàn và các thể tích khí đo ở cùng điều kiện.
b) Trong công nghiệp, người ta điều chế phân đạm urea bằng cách cho khí ammonia (NH3) tác dụng với khí carbon dioxide (CO2) ở nhiệt độ 180-200°C, khoảng 200 atm.
Biết hiệu suất phản ứng là 70%, vậy để sản xuất được 6 tấn urea cần phải sử dụng bao nhiêu m³ khí NH3 và bao nhiêu m³ khí CO2 (đkc)?
Câu 5. (2,5 điểm):
(Xem giải) 5.1. Một thí nghiệm được mô tả như hình bên dưới.
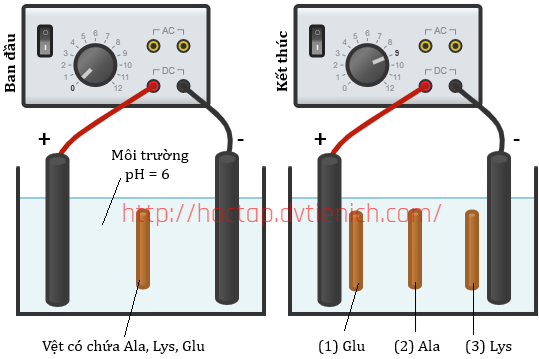
Hãy cho biết các vệt được đánh dấu (1), (2), (3) tồn tại chủ yếu ở dạng cation, anion hay ion lưỡng cực? Vì sao?
(Xem giải) 5.2. Phản ứng của BrCH2CH2CH2CH2NH2 với NaH sinh ra chất W, có phổ IR và khối phổ như hình bên dưới. Lập luận đề xuất công thức cấu tạo của W.
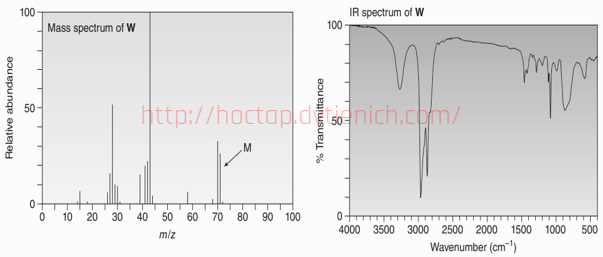
Bảng tín hiệu phổ hồng ngoại một số liên kết cơ bản:
| Liên kết | O-H | C-H | C=O | C=C | N-H |
| Số sóng (cm-1) | 3600 – 3300 | 3000 – 2700 | 1700 – 1750 | 1600 – 1680 | 3500 – 3300 |
Câu 6. (3,0 điểm):
(Xem giải) 6.1. (1,5 điểm): Cho hai amine: CH3CH2CH2NH2 và (CH3)3N với các số liệu nhiệt độ nóng chảy là -83°C; -117°C và nhiệt độ sôi là 48°C và 3°C.
a) Hãy gán ghép số liệu nhiệt độ sôi và nhiệt độ nóng chảy tương ứng với mỗi chất. Giải thích sự sắp xếp đó.
b) Từ NH3 viết phương trình hóa học điều chế (CH3)3N bằng phương pháp alkyl hóa.
c) Khi tiến hành alkyl hóa người ta thường sử dụng dẫn xuất dạng RI mà không nên sử dụng dẫn xuất RCl hoặc RF (R- gốc alkyl). Giải thích?
(Xem giải) 6.2. (1,5 điểm): Mẫu hóa chất A là hỗn hợp benzoic acid và phenol. Để xác định hàm lượng benzoic acid trong mẫu trên người ta cân chính xác 10,00 gam A cho vào dung dịch NaHCO3 dư, lắc kỹ một thời gian, sau đó để yên rồi tách riêng phần dung dịch và phần hữu cơ không tan. Cho phần dung dịch vào phễu chiết, thêm dung dịch HCl dư, làm lạnh hỗn hợp và thêm tiếp 10 mL hexane (D = 0,66 g/mL) vào và lắc đều. Để yên phễu chiết để hỗn hợp phân thành 2 lớp, loại bỏ lớp dung dịch phía dưới chỉ chứa các chất vô cơ, lớp chất hữu cơ phía trên đem cân lại nặng 9,18 gam.
a) Viết các phương trình hóa học xảy ra.
b) Trong phép phân tích trên, có thể thay NaHCO3 bằng Na2CO3 được không? Vì sao?
c) Tính thành phần % theo khối lượng của benzoic acid trong hỗn hợp A.


Bình luận