[2024 – 2025] Thi học sinh giỏi Chuyên Phan Bội Châu – Nghệ An
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Thời gian làm bài: 150 phút
⇒ Bảng đáp án phần trắc nghiệm:
| Phần 1 | Phần 2 | 13 | 14 | 15 | 16 | ||
| 1A | 2D | 3C | (a) | S | S | S | Đ |
| 4B | 5C | 6C | (b) | S | Đ | Đ | Đ |
| 7C | 8B | 9A | (c) | S | S | S | S |
| 10C | 11C | 12A | (d) | Đ | Đ | S | S |
| Phần 3 | Câu 17 | 4,93 | Câu 18 | 1,4 |
A. PHẦN TRẮC NGHIỆM (8,0 điểm)
PHẦN I (3,0 điểm): Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Trong một phân tử HNO3 có bao nhiêu liên kết π?
A. 1. B. 3. C. 4. D. 2.
(Xem giải) Câu 2. Cho phương trình nhiệt hóa học: 4Al(s) + 3O2(g) → 2Al2O3(s). ![]() = -33514 kJ.
= -33514 kJ.
Nhiệt tạo thành chuẩn của Al2O3 bằng bao nhiêu?
A. 33514 kJ/mol. B. -33514 kJ/mol. C. 16757 kJ/mol. D. -16757 kJ/mol.
(Xem giải) Câu 3. Cho ứng: 2ClO2 + 2NaOH → NaClO3 + NaClO2 + H2O. Kết quả nghiên cứu tốc độ phản ứng phụ thuộc vào nồng độ của các chất tham gia phản ứng ở nhiệt độ T cho ở bảng sau:
| Thí nghiệm | Nồng độ ClO2 (mol/L) | Nồng độ NaOH (mol/L) | Tốc độ phản ứng |
| 1 | 0,01 | 0,01 | 2.10^-4 |
| 2 | 0,02 | 0,01 | 8.10^-4 |
| 3 | 0,01 | 0,02 | 4.10^-4 |
Biểu thức nào sau đây là biểu diễn tốc độ phản ứng trên ở nhiệt độ T?
A. v = 200.[ClO2]².[NaOH]². B. v = 200.[ClO2].[NaOH]².
C. v = 200.[ClO2]².[NaOH]. D. v = 100.[ClO2]².[NaOH]²
(Xem giải) Câu 4. Trong bình kín, có cân bằng hóa học: CH4(g) + H2O (g) ⇋ CO(g) + 3H2(g). Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí trong bình so với H2 giảm. Hãy cho biết phát biểu nào sau đây đúng?
A. Phản ứng trên, theo chiều thuận là phản ứng tỏa nhiệt (![]() < 0).
< 0).
B. Khi cân bằng, nếu giảm thể tích bình chứa khí thì cân bằng sẽ chuyển dịch theo chiều nghịch.
C. Nếu cho thêm chất xúc tác vào thì cân bằng trên sẽ chuyển dịch theo chiều thuận.
D. Biểu thức hằng số cân bằng nồng độ của phản ứng trên là Kc = [CO].[H2]³/[CH4]
(Xem giải) Câu 5. Trong phòng thí nghiệm, khi điều chế người ta thu khí X bằng phương pháp dời nước như hình vẽ bên.
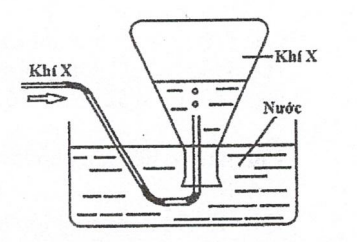
Trong các khí: O2, Cl2, N2, HCl, NH3, SO2 có bao nhiêu khí thỏa mãn X?
A. 4. B. 3. C. 2. D. 5.
(Xem giải) Câu 6. Phương trình điện li nào sau đây viết sai?
A. HNO3 → H + NO3-. B. HF ⇋ H+ + F-.
C. Mg(OH)2 → Mg2+ + 2OH-. D. NaHCO3 → Na+ + HCO3-.
(Xem giải) Câu 7. Khí chlorine khô không có tính tẩy màu, còn nước chlorine có tính tẩy màu. Khả năng tẩy màu của nước chlorine là do chất nào sau đây?
A. Cl2. B. HCl. C. HClO. D. Cl2O.
(Xem giải) Câu 8. Gas R32 (còn được gọi là HFC32) là chất được sử dụng trong các thiết bị điện lạnh dân dụng và công nghiệp. Công thức của hợp chất R32 là CH2F2. Tên gọi của hợp chất R32 là
A. fluorine methane. B. difluoromethane.
C. fluoromethane. D. difluorine methane.
(Xem giải) Câu 9. Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: CH3COOH, CH3OH, CH3CHO, HCOOH và các tính chất được ghi trong bảng sau:
| Chất | X | Y | Z | T |
| Nhiệt độ sôi | 64,7 | 100,8 | 21,0 | 118,0 |
| pH (dd 0,001M) | 7,00 | 3,47 | 7,00 | 3,88 |
Phát biểu nào sau đây sai?
A. Trong dung dịch nước, chất Z không tạo được liên kết hydrogen.
B. Trong công nghiệp, chất T điều chế được trực tiếp từ chất X.
C. Chỉ dùng quỳ tím và thuốc thử Tollens phân biệt được 4 dung dịch của 4 chất trên.
D. Lực acid của Y lớn hơn lực acid của T hay Ka (của Y) > Ka (của T).
(Xem giải) Câu 10. Licopene có công thức phân tử C40H56 (chất tạo màu đỏ trong quả cà chua chín) là chất có cấu tạo mạch hở. Số liên kết π (pi) và liên kết σ (xích ma) trong phân tử licopene lần lượt là
A. 13 và 96. B. 14 và 95. C. 13 và 95. D. 14 và 96.
(Xem giải) Câu 11. Hexylresorcinol được biết đến nhiều nhất với công dụng làm mờ thâm nám và làm đều màu da, ngoài ra còn đóng vai trò như một chất chống oxy hóa và một thành phần ổn định công thức mỹ phẩm. Khi phân tích thành phần nguyên tố trong hexylresorcinol cho kết quả phần trăm về khối lượng các nguyên tố C, H, O lần lượt là 74,227%; 9,278%; 16,495%. Bằng phương pháp phổ khối lượng (phổ MS) cho kết quả phân tử khối của hexylresorcinol là 194. Kết quả nghiên cứu cho biết 1 mol hexylresorcinol phản ứng được tối đa với 2 mol NaOH. Hãy cho biết hexylresorcinol là hợp chất hữu cơ thuộc loại nào sau đây?
A. Ester. B. Carboxylic acid. C. Phenol. D. Tạp chức.
(Xem giải) Câu 12. Khi điện phân dung dịch NaCl với điện cực trơ không có màng ngăn thu được dung dịch gọi là nước Javel. Một loại nước Javel (khối lượng riêng 1,15 g/mL) được bán trên thị trường thường được đóng vào chai dung tích 1,0 L có nồng độ NaClO và NaCl lần lượt là 14,9% và 11,7%. Để sản xuất trực tiếp ra nước Javel trên người ta điện phân dung dịch NaCl nồng độ a %. Giá trị của a bằng bao nhiêu (làm tròn số đến phần mười)?
A. 23,3. B. 35.3. C. 23,4. D. 23,5.
Phần II. Câu trắc nghiệm đúng, sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 13. Ammonia được tổng hợp theo phản ứng: N2(g) + 3H2(g) ⇋ 2NH3(g). Kết quả nghiên cứu sự phụ thuộc của hiệu suất phản ứng tổng hợp ammonia (N2 và H2 được lấy theo tỉ lệ mol tương ứng là 1 : 3) vào áp suất và nhiệt độ được thể hiện ở giản đồ bên.
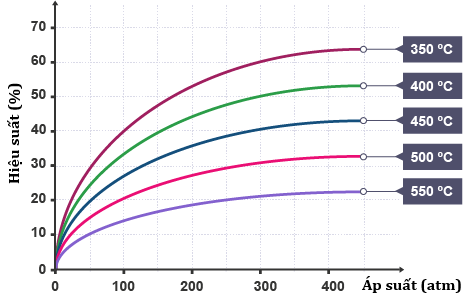
Dựa vào giản đó bên ta có:
a) Phản ứng trên theo chiều thuận là phản ứng thu nhiệt (![]() > 0).
> 0).
b) Hiệu suất phản ứng tỉ lệ thuận với nhiệt độ và áp suất.
c) Nếu thêm chất xúc tác thì hiệu suất phản ứng tổng hợp NH3 sẽ cao hơn so với khi không có chất xúc tác.
d) Nếu thực hiện phản ứng ở áp suất là 300 atm và nhiệt độ 400°C thì hỗn hợp khí khi cân bằng có %VNH3 > 25%.
(Xem giải) Câu 14. Isoamyl acetate không độc, có mùi chuối chín nên được dùng làm hương liệu thực phẩm. Trong phòng thí nghiệm, isomayl acetate được điều chế và tách lấy theo các bước sau:
Bước 1: Lấy 20 mL acetic acid với 30 mL isoamyl alcohol cho vào bình cầu, thêm tiếp 5 mL H2SO4 đặc và lắc đều.
Bước 2. Đun nóng hỗn hợp ở nhiệt độ khoảng 80 – 90°C trong thời gian 5 – 6 phút. Sau đó để nguội.
Bước 3. Thêm dung dịch NaHCO3 vào hỗn hợp sau phản ứng đến khi không còn khí thoát ra rồi thêm tiếp 10mL dung dịch NaCl bão hòa vào hỗn hợp.
Bước 4. Cho toàn bộ hỗn hợp vào phểu chiết, lắc đều rồi để yên khoảng 5 phút sau đó chiết thu lấy ester.
a) Ở bước 2, xảy ra phản ứng ester hóa và phân tử nước được tạo thành từ OH của isoamyl alcohol và H của acetic acid.
b) Vai trò của dung dịch NaHCO3 là để trung hòa acid, vai trò của dung dịch NaCl bão hòa là làm tăng khả năng phân tách chất lỏng không tan trong dung dịch.
c) Ở bước 4, chiết loại bỏ chất lỏng phía trên và lấy phần chất lỏng phía dưới là ester.
d) Để hạn chế sự thất thoát chất lỏng, ở bước 1 người ta thường lắp thêm ống sinh hàn thắng đứng vào miệng bình cầu.
(Xem giải) Câu 15. Trong nước mưa acid thường có pH = 4 đến 5. pH thấp trong nước mưa acid chủ yếu là do có chứa các acid như HNO3, H2SO4. Trong tự nhiên, HNO3 còn được tạo ra từ N2 theo sơ đồ chuyển hóa:
N2 → NO → NO2 → HNO3
a) Các phản trong sơ đồ trên đều xảy ra ở điều kiện thường.
b) HNO3 sinh ra từ quá trình trên sẽ cung cấp một lượng phân đạm cho cây trồng ở dạng NO3-.
c) Một cơn mưa acid, nước mưa có pH = 4 thì nồng độ HNO3 có trong nước mưa đó là 10^-4M.
d) Mưa acid là một trong những nguyên nhân gây nên hiện tượng phú dưỡng.
(Xem giải) Câu 16: Chất béo (hay triglyceride) là thành phần đóng một vai trò là nguồn cung cấp năng lượng và chuyên chở các chất tan trong chất béo của quá trình trao đổi chất. Một triglyceride X là thành phần chính của một loại dầu thực vật và có công thức cấu tạo như hình sau:
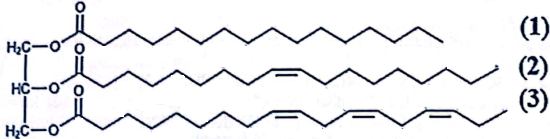
a) Công thức phân tử của X là C55H98O6 và ở điều kiện thường X là chất lỏng.
b) Khi sử dụng làm thực phẩm thì X sẽ cung cấp acid béo omega-3 cho cơ thể.
e) Trong X, các gốc acid béo đều có số nguyên tử carbon là số lẻ và gốc không no đều có cấu hình cis-
d) Hydrogen hóa hoàn toàn 427 kg X bằng hydrogen (dư) ở nhiệt độ cao, có Ni xúc tác thu được tối đa 434 kg chất béo no.
Phần III. Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 2.
(Xem giải) Câu 17. Nhà máy của công ty cổ phần Supephotphat và hóa chất Lâm Thao sản xuất 100 tấn phân NPK (15 – 15 – 15) bằng cách phối trộn 98 tấn hỗn hợp các loại gồm Amophos (16 – 48 – 0), SA (chứa (NH4)2SO4, có độ dinh dưỡng 21%), Ure (có độ dinh dưỡng 46%), Kali (chứa KCl, có độ dinh dưỡng 60%) với 2 tấn là hỗn hợp các chất chống kết dính, chất chống vón cục và các phụ gia. Khối lượng phân bón Ure mà nhà máy đã sử dụng trong quá trình trên là bao nhiêu tấn?
(Xem giải) Câu 18. Thuốc chữa ghẻ DEP (diethyl phtalate) được sản xuất từ nguồn nguyên liệu đầu là naphatalen và ethyl acohol theo sơ đồ các quá trình chuyển hoá sau:
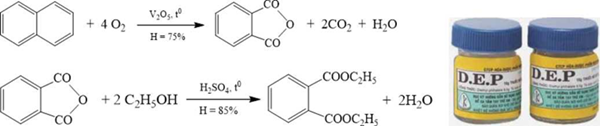
Để sản xuất được 1 tấn DEP cần lượng tối thiểu các chất là x tấn naphtalene với y tấn ethyl alcohol. Tổng giá trị x + y bằng bao nhiêu? (Làm tròn đến hàng phần mười).
PHẦN TỰ LUẬN (12 ĐIỂM)
Câu 1 (3 điểm).
(Xem giải) 1. Viết công thức lewis của các chất NO2, AlCl3. Giải thích tại sao NO2 và AlCl3 có khả năng dimer hóa thành N2O4 và Al2Cl6? Viết công thức lewis của N2O4 và Al2Cl6.
(Xem giải) 2. Một loại khí hóa lỏng (LPG) có thành phần chủ yếu là propane và butane được đóng trong các bình “Gas” để sử dụng làm nhiên liệu.
+ Giải thích tại sao butane và propane đều không mùi nhưng khí trong bình “Gas” lại có mùi?
+ Khi phát hiện khí “Gas” bị rò rỉ em phải làm gì để không xảy ra cháy nổ?
+ Một loại khí hóa lỏng có thành phần là 40% propane (C3H8) và 60% butane (C4H10) về số mol. Khi sử dụng làm nhiên liệu thì toàn bộ khí hóa lỏng sẽ cháy hoàn toàn theo phản ứng:
C3H8 (g) + 5O2 (g) → 3CO2(g) + 4H2O (g) ![]() = -2216 kJ
= -2216 kJ
C4H10 (g) + 6,5O2 (g) → 4CO2(g) + 5H2O (g) ![]() = -2850 kJ
= -2850 kJ
Để đun sôi 1 lít nước từ 25°C lên 100°C thì cần bao nhiêu gam khí hóa lỏng trên? Biết rằng để 1 mL nước tăng 1°C thì cần cung cấp 4,2J và chỉ có 60% lượng nhiệt tỏa ra từ đốt khí hóa lỏng trên được nước hấp thụ.
(Xem giải) 3. Trong dung dịch NH3 0,1M có cân bằng: NH3(aq) + H2O(l) ⇋ NH4+ (aq) + OH-(aq). Khi ta tác động một trong các yếu tố sau thì pH của dung dịch thay đổi như thế nào? Giải thích
+ Thêm NH4Cl rắn vào dung dịch.
+ Thêm NaOH rắn vào dung dịch.
+ Pha loãng dung dịch bằng nước cất.
+ Sục khí HCl vào dung dịch.
Câu 2 (3 điểm).
1. Hãy giải thích:
(Xem giải) + Vì sao năng lượng liên kết của các halogen (X2) tăng dần từ F2 đến Cl2 nhưng lại giảm dần từ Cl2 đến I2 (Eb (F2) = 159 kJ/mol; Eb(Cl2) = 243 kJ/mol; (Eb(Br2) = 193 kJ/mol; Eb(12) = 151 kJ/mol).
(Xem giải) + Vì sao lực acid của các hydrogenhalic acid tăng dần từ HF đến HI?
(Xem giải) + Vì sao nhiệt độ sôi của các hydrogen halide giảm dần từ HF đến HCl nhưng lại tăng dần từ HCl đến HI?
(Xem giải) 2. Trong một bình kín có thể tích 1 lít chứa 0,5 mol H2 và 0,3 mol I2. Nung nóng bình đến nhiệt độ 430°C khi đó xảy ra phản ứng: H2(g) + I2(g) ⇋ 2HI(g) Kc = 54.
Giữ nguyên nhiệt độ đó đến khi phản ứng đạt đến trạng thái cân bằng một thời gian. Hãy
+ Tính nồng độ mol/L của các chất khi đạt đến trạng thái cân bằng và vẽ dạng đồ thị biểu diễn sự biến đổi nồng độ mol/L của các chất trong bình theo thời gian phản ứng trong quá trình trên.
+ Sau khi phản ứng đạt đến trạng thái cân bằng ở nhiệt độ 430°C, nếu giảm thể tích bình thì nồng độ mol/L của các chất trong bình có thay đổi không? Giải thích.
(Xem giải) 3. Để xác định hàm lượng iodine (trong KIO3) của một mẫu “muối i-ốt”. Một sinh viên tiến hành như sau: Cân 30 gam “muối i-ốt” rồi hòa tan trong nước cất thu được 100 mL dung dịch X đựng trong bình nón 250 mL (có nút nhám) thêm 1ml dung dịch KI 1M (dư), 1ml dung dịch H2SO4 1M. Đậy nắp và lắc nhanh mẫu, để mẫu yên tĩnh nơi tối 5 phút. Sau 5 phút, thêm 1ml dung dịch hồ tinh bột 1%, rồi đem chuẩn độ chậm (4 giây một giọt) bằng dung dịch Na2S2O3 0,005 mol/L tới khi mất màu thì thể tích dung dịch Na2S2O3 đã dùng là 9,0 ml. Biết trong phép chuẩn độ trên Na2S2O3 bị oxi hóa thành Na2S4O6. Viết phương trình hóa học của các phản ứng xảy ra và tính hàm lượng iodine (mg/kg muối) trong KIO3 của mẫu muối i-ốt trên.
Câu 3 (3,5 điểm).
(Xem giải) 1. Thủy phân hoàn toàn một triglyceride X trong dung dịch NaOH dư thu được glycerol và hai muối sodium stearate và sodium oleate.
+ Viết các công thức cấu tạo thỏa mãn X.
+ Giải thích tại sao khi để dầu, mỡ chứa chất X trong không khí một thời gian sẽ bị ôi thiu? Em hãy đề xuất vài cách bảo quản (không dùng hóa chất) để làm chậm quá trình ôi thiu của loại dầu, mỡ trên và cho biết mỗi cách đó dựa trên nguyên tắc nào?
(Xem giải) 2. Một mẫu hoa hòe được xác định có hàm lượng rutin là 26%. Để thu lấy rutin từ hoa hòe, người ta đun sôi hoa hòe với nước thu được dung dịch chứa rutin. Làm lạnh dung dịch chứa rutin xuống 25°C thì thấy có chất rắn tách ra là rutin. Biết độ tan của rutin là 5,2 gam trong 1 lít nước ở 100°C và 0,125 gam trong 1 lít nước ở 25°C.
a) Hãy cho biết phương pháp nào đã được sử dụng trong quá trình tách lấy rutin từ hoa hòe ở trên?
b) Thể tích nước tối thiểu để hòa tan hết rutin có trong 100 gam hoa hòe khi chiết ở 100°C là bao nhiêu mL?
c) Làm nguội dung dịch chiết 100 gam hoa hòe ở câu (b) từ 100°C xuống 25°C thì thu được bao nhiêu gam rutin kết tinh?
d) Nếu sử dụng lượng nước lớn hơn lượng nước tính được ở câu (b) để chiết 100 gam hoa hòe thì khối lượng rutin thu được khi kết tinh tăng hay giảm? Giải thích.
(Xem giải) 3. Carbohydrate là nững hợp chất hữu cơ thiên nhiên và có nhiều ứng dụng trong đời sống và sản xuất.
a) Vẽ các dạng công thức cấu tạo của glucose và cho biết dạng nào phản ứng được với thuốc thử Tollens, dạng nào phản ứng được với CH3OH/khí HCl? Viết phương trình phản ứng minh họa.
b) Ethanol dùng để sản xuất xăng E5 (xăng chứa 5% ethanol về thể tích) được tạo ra từ cellulozơ theo sơ đồ: Cellulose (H = 81%) → Glucose (H = 80%) → Ethanol
Để tạo ra lượng ethanol đủ sản xuất được 2300 lít xăng E5 thì cần x kg mùn cưa (chứa 50% cellulose, còn lại là các chất không tạo ra được ethanol). Biết khối lượng riêng của ethanol là 0,8 g/mL. Viết phương trình hóa học của phản ứng theo sơ đồ trên và tính giá trị x.
(Xem giải) Câu 4 (1 điểm). Hiện nay người ta sản xuất ammonia theo chu trình Haber – Bosch bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí methane (trong các tháp phản ứng) qua các giai đoạn theo sơ đồ sau:
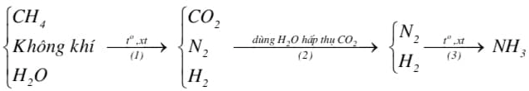
+ Viết các phương trình hóa học xảy ra trong các quá trình trên.
+ Nếu lấy 1000 m³ không khí (chứa 21% O2 và 78% N2, còn lại là CO2) thì cần phải lấy V m³ khí methane để thu được lượng N2 và H2 theo tỉ lệ 1 : 3 về thể tích dùng cho phản ứng tổng hợp ammonia. Biết các phản ứng ở giai đoạn (1) đều xảy ra hoàn toàn, các thể tích khí và hơi được đo ở cùng điều kiện.
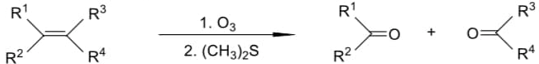
(Xem giải) Câu 5 (1,5 điểm). Liên kết đôi C=C bị oxi hóa bằng phản ứng ozone phân khử hoặc ozone phân oxi hóa tạo ra các sản phẩm hữu cơ chứa oxygen. Nếu thực hiện ozone phân rồi và khử ngay bằng chất khử êm dịu như dimethyl sulfide (CH3)2S thì thu được sản phẩm là aldehyde và ketone theo sơ đồ sau:
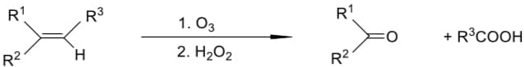
Còn nếu thực hiện ozon phân và oxi hóa ngay bằng chất oxi hóa như H2O2 thì khi đó nhóm chức aldehyde sinh ra sẽ bị oxi hóa thành nhóm caborxylic acid còn nhóm chức ketone không bị oxi hóa vì vậy sản phẩm thu được cuối cùng là carboxylic acid và ketone theo sơ đồ sau:
Thực hiện phản ứng ozone phân chất X có công thức cấu tạo CH3–CH=C(CH3)2 thu được các sản phẩm hữu cơ theo sơ đồ:
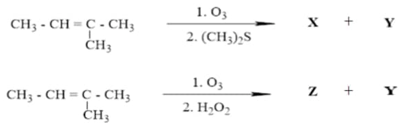
1. Viết công thức cấu tạo và gọi tên các chất hữu cơ X, Y, Z.
2. Từ tinh dầu chanh người ta phân lập được chất A và tiến hành phân tích nguyên tố chất A thu được kết quả trong A chứa 88,2353% carbon còn lại là hydrogen. Dựa vào phổ khối lượng (MS) xác định được phân tử khối của A bằng 136. Khi tiến hành ozone phân khử A thu được sản phẩm theo sơ đồ sau:
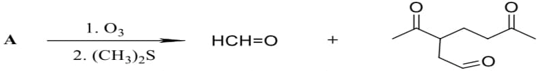
Xác định công thức phân tử và vết công thức cấu tạo có thể có của A?


Bình luận