[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Thái Nguyên
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 047-H12C năm 2024-2025
⇒ Thời gian làm bài: 180 phút
(Xem giải) Câu 1. (2,0 điểm). Trong phòng thí nghiệm, khí X được điều chế bằng cách cho dung dịch HCl đặc tác dụng với MnO2. Một học sinh tiến hành thí nghiệm để thử tính chất của khí X như sau:
– Thí nghiệm 1: Sục khí X đến dư vào dung dịch chứa SO2, thu được dung dịch Y, thêm dung dịch BaCl2 vào Y.
– Thí nghiệm 2: Cho khí X vào dung dịch NaOH ở nhiệt độ thường, thu được dung dịch Z, thêm tiếp dung dịch H2SO4 loãng vào Z.
– Thí nghiệm 3: Cho khí X và khí NH3 tiếp xúc nhau.
– Thí nghiệm 4: Nung nóng đỏ bột Fe rồi đưa nhanh vào bình đựng khí X. Cho nước vào bình thu được dung dịch T chứa 2 chất tan. Thêm dung dịch KMnO4 trong H2SO4 loãng vào T.
Nêu hiện tượng và viết phương trình hóa học xảy ra trong mỗi thí nghiệm trên.
(Xem giải) Câu 2. (2,0 điểm). Hydrogen (H2) là một loại khí có nhiệt cháy cao nhất trong tất cả các loại nhiên liệu trong thiên nhiên. So với các nguồn nhiên liệu khác như xăng, dầu và khí đốt thì sản phẩm cháy của phân tử hydrogen chỉ có H2O nên được gọi là nhiên liệu sạch lý tưởng. Do đó việc giảm giá thành và các tác động đến môi trường trong quá trình sản xuất H2 là một thách thức to lớn. Cho phản ứng phân hủy H2O ở hai trạng thái như sau:
2H2O(l) → 2H2(g) + O2(g) (1)
2H2O(g) → 2H2(g) + O2(g) (2)
Cho bảng số liệu sau:
| Hợp chất | H2(g) | H2O(l) | H2O(g) | O2(g) |
| -285,8 | -241,8 | |||
| 130,6 | 69,9 | 188,7 | 205,2 |
a. Tính ![]() của hai phản ứng trên.
của hai phản ứng trên.
b. Hai phản ứng trên là phản ứng tỏa nhiệt hay thu nhiệt?
c. Tính ![]() của hai phản ứng trên. Nhận xét về kết quả tính toán được.
của hai phản ứng trên. Nhận xét về kết quả tính toán được.
Câu 3. (2,0 điểm).
(Xem giải) 1. Cho sơ đồ chuyển hoá sau:
![]()
Biết X, Y, Z, T, M là các hợp chất chứa nitrogen. Xác định các chất X, Y, Z, T, M, viết PTHH của các phản ứng xảy ra và cho biết phản ứng nào là phản ứng oxi hoá – khử.
(Xem giải) 2. Hoa đậu biếc là một loại hoa được trồng phổ biến tại các quốc gia Nam Á và Đông Nam Á như Ấn Độ, Thái Lan, Singapore, Việt Nam,… Khi sử dụng đậu biếc làm chất tạo màu tự nhiên, người ta thường đun sôi hoa đậu biếc với nước, hoặc ngâm cánh hoa trong nước sôi từ 10 đến 15 phút, màu hoa sẽ được trích ly tạo thành màu xanh biếc. Sắc tố tạo màu đặc trưng cho đậu biếc là các hợp chất thuộc nhóm anthocyanin, một trong những chất chống oxi hoá tự nhiên. Điểm đặc biệt của nhóm anthocyanin là màu của chúng thay đổi dưới tác dụng pH của môi trường. Ở môi trường pH < 7 (môi trường acid), anthocyanin chuyển sang đỏ tím, ngược lại chúng chuyển sang màu xanh thẫm khi môi trường pH ≥ 7.
Cho các phát biểu sau:
a. Vắt nước cốt chanh vào cốc nước hoa đậu biếc, thấy màu của cốc nước chuyển từ màu xanh biếc sang màu đỏ tím.
b. Cho nước vôi trong vào cốc nước hoa đậu biếc, thấy màu của cốc nước chuyển từ màu xanh biếc sang màu xanh thẫm.
c. Cho nước muối K2CO3 vào cốc nước hoa đậu biếc, thấy màu của cốc nước không thay đổi.
Hãy cho biết, phát biểu nào đúng, phát biểu nào sai và giải thích.
(Xem giải) Câu 4. (2,0 điểm). Từ vỏ cây Salix (cây liễu), người ta phân lập được chất X có công thức phân tử C7H6O3. X là hợp chất hữu cơ tạp chức (những nhóm chức khác nhau nằm ở các nguyên tử Carbon liên tiếp). X có khả năng tác dụng với dung dịch NaHCO3 tạo ra chất Y có công thức C7H5O3Na. Khi cho X tác dụng với (CH3CO)2O tạo ra chất Z (C9H8O4). Z cũng tác dụng với NaHCO3. Ngoài ra, khi X tác dụng với methanol (có H2SO4 đặc xúc tác) thì tạo ra chất T (C8H8O3). T không tác dụng với NaHCO3 mà chỉ tác dụng được với Na2CO3. Hãy xác định công thức cấu tạo của các X, Y, Z, T và viết PTHH của các phản ứng chính xảy ra.
Câu 5. (2,0 điểm).
(Xem giải) a. Xà phòng là hỗn hợp muối sodium hoặc potassium của các acid béo và một số chất phụ gia. Tại sao xà phòng lại có tính chất giặt rửa?
(Xem giải) b. Một loại chất béo có chứa tristearin, tripalmitin, stearic acid, palmitic acid. Thành phần phần trăm về khối lượng và hiệu suất phản ứng của các chất khi xà phòng hóa chất béo này bằng dung dịch NaOH như sau:
| Thành phần | Tristearin | Tripalmitin | Stearic acid | Palmitic acid | Tạp chất |
| % khối lượng | 53,4% | 32,24% | 1,136% | 1,536% | 11,688% |
| Hiệu suất phản ứng với NaOH | 90% | 88% | 100% | 100% |
(Tạp chất không tạo ra muối của acid béo)
Một nhà máy cần sản xuất 15000 bánh xà phòng loại 100 gam (chứa 72% khối lượng muối sodium của các acid béo) bằng cách xà phòng hóa x kg chất béo nói trên với dung dịch NaOH. Biết trong quá trình đóng gói, lượng xà phòng bị hao hụt 4%. Tính giá trị của x.
Câu 6. (2,0 điểm).
(Xem giải) 1. Một gương soi hình tròn có đường kính 40 cm. Để tráng bạc cho 200 tấm gương soi có diện tích bề mặt như trên với độ dày 0,2 μm, người ta đun nóng dung dịch chứa m gam glucose 40% với một lượng dung dịch silver nitrate trong ammonia. Biết khối lượng riêng của silver là 10,49 g/cm³, hiệu suất phản ứng tráng gương là 80% (tính theo glucose). Tính giá trị của m.
(Xem giải) 2. Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho khoảng 5 mL dung dịch hồ tinh bột 1% vào ống nghiệm. Sau đó thêm khoảng 1 mL dung dịch HCl 1 M vào, lắc đều.
Bước 2: Đặt ống nghiệm trong một cốc thuỷ tinh chứa nước nóng, đun cách thuỷ trong 10 phút. Sau đó để nguội.
Bước 3: Thêm từ từ NaHCO3 vào đến khi ngừng sủi bọt khí.
Bước 4: Cho khoảng 2 mL dung dịch thu được vào ống nghiệm chứa Cu(OH)2 (được điều chế bằng cách cho 0,5 mL dung dịch CuSO4 5% vào 2 mL dung dịch NaOH 10%, lắc nhẹ). Sau đó đặt ống nghiệm trong cốc thuỷ tinh chứa nước nóng khoảng 5 phút.
Nêu hiện tượng xảy ra trong mỗi bước thí nghiệm và giải thích bằng PTHH. Cho biết vai trò của NaHCO3 trong thí nghiệm trên.
(Xem giải) Câu 7. (2,0 điểm). Hỗn hợp E gồm hai chất hữu cơ đều no, mạch hở có công thức phân tử là X (C2H8O3N2) và Y (C3H10O4N2). Cho E tác dụng với dung dịch NaOH (vừa đủ), thu được dung dịch Z chứa ba muối và hỗn hợp T gồm hai chất khí đều làm xanh giấy quỳ tím ẩm. Biết rằng trong T không có hợp chất đa chức. Cho các phát biểu sau:
a. E tác dụng với dung dịch HCl, không thấy giải phóng khí.
b. T gồm C2H5NH2 và CH3NH2.
c. Trong Z có chứa muối sodium của glycine.
d. X có công thức cấu tạo là CH2(NH3)2CO3.
e. Y tác dụng với NaOH trong dung dịch theo tỉ lệ mol 1 : 2.
Hãy cho biết, phát biểu nào đúng, phát biểu nào sai và giải thích.
(Xem giải) Câu 8. (2,0 điểm). Glutamic acid là một trong những amino acid thiết yếu, công thức cấu tạo ở dạng phân tử như sau
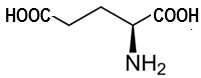
a. Với mỗi môi trường pH, hãy biểu diễn các dạng tồn tại của glutamic acid.
b. Bột ngọt (muối monosodium của glutamic acid) là một loại gia vị, được sản xuất từ dung dịch NaOH 40% và tinh thể glutamic acid (chứa 80% khối lượng glutamic acid) bằng cách dùng dung dịch NaOH trung hòa dung dịch glutamic acid đến pH = 6,8. Sau đó đem lọc, cô đặc và kết tinh dung dịch sản phẩm bằng phương pháp sấy chân không ở nhiệt độ thấp. Bột ngọt thu được có độ tinh khiết 99%. Giả thiết hiệu suất của cả quá trình tính theo glutamic acid là 90%. Để sản xuất được 1500 gói bột ngọt, mỗi gói có trọng lượng 1 kg cần m tấn tinh thể glutamic acid. Tính giá trị của m?
(Xem giải) Câu 9. (2,0 điểm). Cho propylbenzene tác dụng với chlorine (chiếu sáng), người ta thu được hỗn hợp ba dẫn xuất monochloro A1, A2, A3 với tỉ lệ % lần lượt là 68%, 22%, 10%.
a. Hãy trình bày cơ chế phản ứng theo hướng tạo thành sản phẩm A1.
b. Hãy tính khả năng phản ứng tương đối của các nguyên tử H ở gốc propyl trong propylbenzene.
Câu 10. (2,0 điểm).
(Xem giải) 1. Chloramine B (C6H5ClNNaO2S) là chất thường được sử dụng để sát khuẩn trên các bề mặt, vật dụng hoặc dùng để khử trùng, sát khuẩn, xử lí nước sinh hoạt. Ở nồng độ cao, chloramine B có tác dụng diệt nấm mốc, vi khuẩn, virus gây bệnh cho người. Chloramine B có dạng viên nén (mỗi viên có khối lượng 0,3 – 2,0 gam) và dạng bột. Chloramine B 25% (250 mg chlorine hoạt tính trong một viên nén) được dùng phổ biến, vì tiện dụng khi pha chế và bảo quản.
Chloramine B nồng độ 2% được dùng để xịt trên các bề mặt vật dụng nhằm sát khuẩn. Để pha chế dung dịch này, người ta sử dụng chloramine B 25% dạng bột. Vậy cần bao nhiêu gam bột chloramine B 25% để đủ phun cho khu vực có diện tích 50 m² với liều lượng trung bình 0,4 L/m²? (Coi thể tích dung dịch thay đổi không đáng kể sau khi pha; khối lượng riêng của H2O là 1g/mL).
(Xem giải) 2. Tiến hành thí nghiệm chuẩn độ dung dịch FeSO4 nồng độ a M theo các bước sau:
Bước 1: Dùng pipette hút chính xác 5,00 mL dung dịch FeSO4 nồng độ a M cho vào bình định mức loại 50 mL. Thêm tiếp nước cất vào bình định mức đến vạch, lắc đều, thu được 50 mL dung dịch Y.
Bước 2: Lấy 10,00 mL dung dịch Y cho vào bình tam giác, thêm H2SO4 loãng. Tiến hành chuẩn độ và ghi kết quả thể tích dung dịch KMnO4 0,02M ở bảng sau
| Lần chuẩn độ | Thể tích dung dịch KMnO4 0,02M đã dùng (mL) |
| 1 | 6,50 |
| 2 | 6,60 |
| 3 | 6,50 |
a. Nêu dấu hiệu nhận biết thời điểm kết thúc chuẩn độ và viết phương trình phản ứng.
b. Tính giá trị của a.


Bình luận