[2025 – 2026] Thi học sinh giỏi lớp 12 trường Gia Bình 1 – Bắc Ninh (Lần 1)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề 006-H12A năm 2025-2026
⇒ Thời gian làm bài: 90 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1D | 2A | 3A | 4A | 5B | 6A | 7B | 8A | 9C | 10A |
| 11C | 12B | 13C | 14D | 15A | 16B | 17A | 18D | 19B | 20C |
| 21B | 22C | 23D | 24A | 25A | 26D | 27C | 28D | 29C | 30C |
| 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | |
| (a) | S | S | Đ | Đ | S | S | S | S |
| (b) | S | S | Đ | Đ | Đ | Đ | Đ | Đ |
| (c) | Đ | Đ | S | Đ | S | S | Đ | Đ |
| (d) | Đ | Đ | Đ | S | Đ | Đ | S | S |
| 39 | 40 | 41 | 42 | 43 | 44 |
| 399 | 5832 | 0,62 | 1 | 877 | 348 |
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 30. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Trong quá trình hoạt động của pin điện hoá Cu – Ag, nồng độ của các ion trong dung dịch biến đổi như thế nào?
A. Nồng độ của ion Ag+ tăng dần và nồng độ của ion Cu2+ giảm dần.
B. Nồng độ của ion Ag+ giảm dần và nồng độ của ion Cu2+ giảm dần.
C. Nồng độ của ion Ag+ tăng dần và nồng độ của ion Cu2+ tăng dần.
D. Nồng độ của ion Ag+ giảm dần và nồng độ của ion Cu2+ tăng dần.
(Xem giải) Câu 2. Cho hỗn hợp E gồm hai chất hữu cơ X (C3H11N3O5) và Y (C4H9NO4), tạo bởi carboxylic acid đa chức) đều mạch hở. Lấy 22,63 gam E tác dụng vừa đủ với dung dịch NaOH, cô cạn dung dịch thu được 23,46 gam hỗn hợp muối Z; một alcohol T và một amine G đều đơn chức. Biết các phản ứng xảy ra hoàn toàn. (Kết quả cuối cùng làm tròn đến hàng phần trăm)
Cho các phát biểu sau đây:
(a) Dung dịch G làm quỳ tím chuyển sang màu xanh.
(b) T được dùng để sản xuất nước rửa tay khô.
(c) 0,6 mol E tác dụng với dung dịch KOH (dùng dư 15% so với lượng phản ứng), cô cạn dung dịch thu được 123,12 gam chất rắn khan.
(d) Phần trăm về số mol của X trong E là 53,33%.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 1.
(Xem giải) Câu 3. Điện phân dung dịch muối MSO4 (M là kim loại) với điện cực trơ, cường độ dòng điện không đổi. Sau thời gian t giây, thu được a mol khí ở anode. Nếu thời gian điện phân là 2t giây thì tổng số mol khí thu được ở cả hai điện cực là 2,5a mol. Giả sử hiệu suất điện phân là 100%, khí sinh ra không tan trong nước. Phát biểu nào sau đây sai?
A. Khi thu được 1,8a mol khí ở anode thì vẫn chưa xuất hiện bọt khí ở cathode.
B. Tại thời điểm 2t giây, có bọt khí ở cathode.
C. Dung dịch sau điện phân có pH < 7.
D. Tại thời điểm t giây, ion M2+ chưa bị điện phân hết.
(Xem giải) Câu 4. Cho các phát biểu sau:
(1) Liên kết giữa một kim loại và một phi kim luôn là liên kết ion.
(2) Dung dịch KOH làm cho dung dịch phenolphtalein hóa hồng.
(3) Tất cả các nguyên tố nhóm IA đều là các nguyên tố kim loại.
(4) Liên kết cộng hóa trị được hình thành do sự góp chung electron giữa 2 nguyên tử.
(5) Phân tử N2 có liên kết ba bền vững.
(6) Hydroxide cao nhất của S là H2S.
Số phát biểu đúng là
A. 1. B. 4. C. 2. D. 3.
(Xem giải) Câu 5. Từ khí thiên nhiên người ta tổng hợp polybuta-1,3-diene là thành phần chính của cao su buna theo sơ đồ: CH4 → C2H2 → C4H4 → C4H6 → Polybuta-1,3-diene. Để tổng hợp 1 tấn polybuta-1,3-diene cần bao nhiêu m³ (ở 25°C, 1 bar) khí thiên nhiên chứa 95% khí methane, biết hiệu suất của cả quá trình sản xuất là 55%?
A. 960,624 m³. B. 3514,44 m³. C. 793,904 m³. D. 3338,9 m³.
(Xem giải) Câu 6. Cho các phát biểu sau:
(1) Các kim loại đều có tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim.
(2) Nhúng thanh Cu trong dung dịch Fe2(SO4)3 có nhỏ vài giọt dung dịch H2SO4 có xuất hiện ăn mòn điện hóa.
(3) Các kim loại nhóm IIA có nhiệt độ sôi, nhiệt độ nóng chảy biến đổi không theo qui luật nhất định.
(4) Các kim loại đều có bán kính nhỏ hơn các phi kim thuộc cùng một chu kì.
(5) Khử zinc oxide ở nhiệt độ cao bằng than cốc thu được zinc ở trạng thái khí.
(6) Dùng dung dịch Fe2(SO4)3 dư có thể tách Ag ra khỏi hỗn hợp Ag và Cu.
Có bao nhiêu phát biểu đúng?
A. 3. B. 6. C. 4. D. 5.
(Xem giải) Câu 7. Bột sắn dây là tinh bột thu được từ củ sắn dây, bột sắn dây là đồ uống giải khát có nhiều tác dụng đối với sức khỏe. Ngoài ra bột sắn dây còn là các vị thuốc, bài thuốc chữa được nhiều bệnh. Để thu được bột sắn dây, đầu tiên củ sắn dây được rửa sạch, cạo hết lớp vỏ bên ngoài rồi xay nhuyễn với nước, thu được hỗn hợp màu nâu.
Hỗn hợp này được thêm nước, khuấy kĩ rồi lọc nhiều lần qua các lớp vải để loại hết bã xơ và thu được phần nước lọc thô chứa tinh bột. Từ nước lọc thô, tiến hành đánh bột với bước cho tan và đợi lắng, sau đó chắt bỏ nước và thay nước. Quá trình này được lặp lại nhiều lần (khoảng 6 – 20 lần tùy nhu cầu sử dụng) với số lớp vải lọc tăng dần để tách bỏ hoàn toàn tạp chất và cho ra được lớp bột trắng tinh khiết. Tinh bột thu được sẽ được giàn mỏng ra lớp vải đặt trên dàn phơi bằng tre, để ráo nước. Sau đó, tinh bột sắn được đưa vào các tủ sấy chuyên dụng hoặc đem phơi nắng cho đến khi bột khô.
Cho biết phương pháp chủ yếu dùng làm bột sắn dây?
A. Chưng cất. B. Chiết. C. Kết tinh. D. Sắc kí.
(Xem giải) Câu 8. Linamarin là một glucoside có mặt trong lá và rễ của cây sắn, là nguyên nhân gây ra say sắn hay ngộ độc sắn. Linamarin có cấu tạo phân tử như sau:
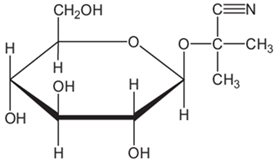
Số nhóm chức alcohol trong phân tử linamarin là
A. 4. B. 6. C. 3. D. 5.
(Xem giải) Câu 9. Histidine là một trong những amino acid thiết yếu đối với cơ thể con người. Với mỗi môi trường có giá trị pH bằng 4,0; 7,6; 12,0, coi histidine chỉ tồn tại ở dạng cho dưới đây:
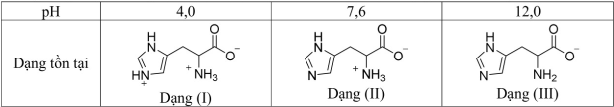
Trong quá trình điện di, ion sẽ di chuyển về phía điện cực trái dấu với ion. Cho các nhận định sau về quá trình điện di của histidine:
(a) Với môi trường pH = 7,6 thì dạng (II) hầu như không dịch chuyển về các điện cực.
(b) Với môi trường pH = 4,0 thì dạng (I) di chuyển về phía cực âm.
(c) Với môi trường pH = 12,0 thì dạng (III) di chuyển về phía cực dương.
(d) Với môi trường pH = 7,6 thì dạng (II) di chuyển về phía cực âm.
Các nhận định đúng là
A. (b), (c), (d). B. (a), (c), (d). C. (a), (b), (c). D. (a), (b), (d).
(Xem giải) Câu 10. Cho cân bằng hóa học: PCl5(k) ⇋ PCl3(k) + Cl2(k); ∆H > 0.
(a) Phản ứng trên là phản ứng thu nhiệt.
(b) Nếu tăng áp suất của hệ, cân bằng chuyển dịch theo chiều thuận.
(c) Nếu thêm Cl2 vào hệ phản ứng thì cân bằng chuyển dịch theo chiều nghịch.
(d) Khi hệ đạt tới trạng thái cân bằng, các chất trong hệ không còn phản ứng với nhau.
(e) Khi hệ đạt đến trạng thái cân bằng ở các nhiệt độ T1 và T2, tỉ khối hơi của hỗn hợp so với H2 tương ứng có giá trị là x và y. Nếu T1 < T2 và giữ nguyên các yếu tố khác thì x < y.
Số phát biểu không đúng là
A. 5. B. 3. C. 2. D. 4.
(Xem giải) Câu 11. Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện..) và giúp ngăn cản sự phát triển của một số vi khuẩn và nấm gây hại cho thực phẩm. Ở áp suất 1 bar và nhiệt độ 25°C, phản ứng giữa mol sulfur với oxygen xảy ra theo phương trình:
“ S (s) + O2(g) → SO2(g)” và tỏa ra một lượng nhiệt là 296,9 kJ.
Cho các phát biểu sau:
(a) Biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ/mol.
(b) Enthalpy tạo thành chuẩn của sulfur dioxide bằng -296,9 kJ/mol.
(c) Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia.
(d) 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45kJ năng lượng dưới dạng nhiệt.
(e) 32 gam sulfur cháy hoàn toàn tỏa ra một lượng nhiệt là 2,969.10^5J.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 5.
(Xem giải) Câu 12. Trong số các chất sau đây: glucose; fructose; formaldehyde; formic acid; saccharose; oxalic acid. Số chất có phản ứng tráng bạc là:
A. 3. B. 4. C. 2. D. 5.
(Xem giải) Câu 13. Tiến hành thí nghiệm theo các bước sau:
• Bước 1: Cho 2 – 3 giọt dung dịch CuSO4 5% vào ống nghiệm (1) chứa 1 ml dung dịch NaOH 10%. Gạn bỏ bớt dung dịch phía trên, giữ lại kết tủa. Cho từ từ dung dịch NH3 tới dư vào ống nghiệm (2) chứa dung dịch AgNO3 đến khi kết tủa tan hết.
• Bước 2: Thêm 0,5 ml dung dịch H2SO4 loãng vào ống nghiệm (3) chứa 2 ml dung dịch saccarozơ 15%. Đun nóng dung dịch trong 3 – 5 phút.
• Bước 3: Thêm từ từ dung dịch NaHCO3 vào ống nghiệm (3) khuấy đều đến khi không còn sủi bọt khí CO2. Chia dung dịch thành hai phần vào trong các ống nghiệm (4) và (5).
• Bước 4: Rót dung dịch trong ống nghiệm (4) vào ống nghiệm (1), lắc đều. Rót từ từ dung dịch trong ống nghiệm (5) vào ống nghiệm (2), đun nhẹ.
Cho các phát biểu dưới đây:
(1) Sau bước 4, dung dịch trong ống nghiệm (1) có màu xanh lam.
(2) Sau bước 2, dung dịch trong ống nghiệm (3) có hiện tượng phân lớp.
(3) Dung dịch NaHCO3 trong bước 3 với mục đích loại bỏ H2SO4.
(4) Ở bước 1, xảy ra các phản ứng trao đổi ion.
(5) Thí nghiệm trên chứng minh saccarozơ có tính khử.
(6) Các phản ứng xảy ra trong bước 4 đều là phản ứng oxi hoá – khử.
Số phát biểu đúng là
A. 2. B. 5. C. 3. D. 4.
(Xem giải) Câu 14. Để diệt chuột trong một nhà kho người ta dùng phương pháp đốt sulfur, đóng kín cửa nhà kho lại. Chuột hít phải khói sẽ bị sưng yết hầu, co giật, tê liệt cơ quan hô hấp dẫn đến bị ngạt mà chết. Chất nào sau đây là nguyên nhân chính gây ra các hiện tượng trên?
A. SO3. B. H2S. C. H2SO4. D. SO2.
(Xem giải) Câu 15. Thành phần dầu tẩy trang hoa hồng Cocoon có C15-19 Alkane, tức là các alkane có từ 15 đến 19C. Hãy cho biết vì sao người ta dùng alkane vào thành phần dầu tẩy trang?
A. Do các alkane này có khả năng làm mềm da, trơ về mặt hóa học, vô hại với sức khỏe con người, không phân cực, dễ hòa tan các chất không phân cực trong phấn, kem, bụi bẩn kéo theo và bị rửa trôi đi.
B. Do các alkane có khả năng chống nắng tốt.
C. Do alkane dễ hoa tan trong nước.
D. Do alkane dễ tác dụng với các chất trong kem, phấn bôi da thành chất tan dễ bị rửa trôi.
(Xem giải) Câu 16. Geranyl acetate là ester có trong hoa hồng và được chiết xuất để làm hương liệu cho nước hoa. Công thức cấu tạo thu gọn của geranyl acetate là
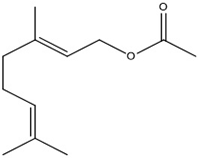
Công thức phân tử của Geranyl acetate là
A. C11H16O2. B. C12H20O2. C. C12H18O2. D. C11H18O2.
(Xem giải) Câu 17. Thủy phân 205,2 gam saccharose (có xúc tác acid) với hiệu suất 80%; sau phản ứng thu được dung dịch A. Trung hòa dung dịch A được dung dịch B. Ở điều kiện thường thể tích dung dịch B có thể hòa tan tối đa m gam Cu(OH)2. Giá trị của m là
A. 5,292 gam. B. 52,92 gam. C. 4,704 gam. D. 47,04 gam.
(Xem giải) Câu 18. Cho các chất sau: (1) CH3COOH, (2) CH3COOCH3, (3) C2H5OH, (4) C2H5COOH. Chiều tăng dần nhiệt độ sôi từ trái sang phải là
A. (1), (2), (3), (4). B. (3), (1), (2), (4).
C. (4), (3), (2), (1). D. (2), (3), (1), (4).
(Xem giải) Câu 19. Rutin là hợp chất hữu cơ có trong nụ hoa hòe, nó có tác dụng làm giảm các chứng suy giảm tĩnh mạch, giảm cholesterol trong máu. Ngoài ra rutin còn được dùng để điều chế thuốc quercetin có tác dụng chống oxy hóa mạnh, kháng viêm, chống dị ứng, ngăn ngừa tế bào ung thư. Công thức cấu tạo của rutin và quercetin như hình dưới đây:
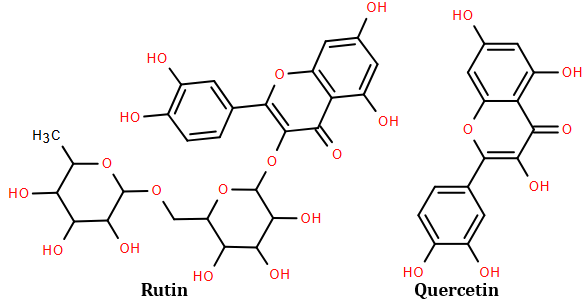
Trong môi trường acid, một phân tử rutin phân tách thành hai phân tử nước thu được sản phẩm gồm quercetin, glucose và rhamnose.
Cho các phát biểu sau:
a) Công thức phân tử của rhamnose C5H10O5.
b) Để sản xuất 1 triệu viên thuốc (mỗi viên có khối lượng 500 mg, chứa 96,64% quercetin về khối lượng) cần 4009,74 kg bột hoa hòe. (Biết hàm lượng rutin trong bột hoa hòe là 30,20%, phần còn lại không tạo ra quercetin; hiệu suất toàn bộ quá trình sản xuất đạt 80%).
c) Phân tử quercetin có 5 nhóm -OH phenol.
d) Đốt cháy hoàn toàn 1 mol rutin thu được 27 mol CO2 và 15 mol H2O.
e) Công thức phân tử của quercetin là C15H10O7.
Số phát biểu đúng là
A. 4 B. 2. C. 3 D. 5
(Xem giải) Câu 20. Cho sơ đồ phản ứng sau:
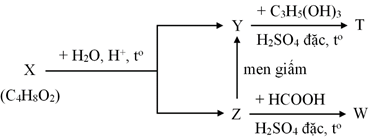
Biết rằng X, Y, Z, T, W là các hợp chất hữu cơ khác nhau; T chỉ chứa một loại nhóm chức. Phát biểu nào sau đây là sai?
A. Z có trong thành phần của nước rửa tay khô có tác dụng diệt khuẩn.
B. Y có trong thành phần của giấm ăn.
C. Phần trăm khối của O trong T là 36,36%.
D. Công thức phân tử của W là C3H6O2.
(Xem giải) Câu 21. Chất hữu cơ X chỉ có một loại nhóm chức và có công thức phân tử C8H14O4. Khi cho X tác dụng với dung dịch NaOH, đun nóng thu được sản phẩm chỉ gồm hỗn hợp muối của hai carboxylic acid kế tiếp và một alcohol Z có công thức C3H6(OH)2. Biết Z hòa tan được Cu(OH)2 ở điều kiện thường tạo thành dung dịch màu xanh lam. Số công thức cấu tạo của X thỏa mãn các đặc điểm trên là:
A. 4. B. 2. C. 1. D. 3.
(Xem giải) Câu 22. Cho hai phản ứng sau:
(1) 2NaBr + Cl2 → 2NaCl + Br2
(2) 2NaI + Br2 → 2NaBr + I2
Phát biểu nào sau đây đúng?
A. I2 có tính oxi hóa mạnh hơn Br2. B. NaI oxi hóa Br2 thành NaBr.
C. NaI có tính khử mạnh hơn NaCl. D. Br2 có tính oxi hóa mạnh hơn Cl2.
(Xem giải) Câu 23. Tiến hành thí nghiệm theo các bước sau:
• Bước 1: Cho vào cốc thủy tinh chịu nhiệt khoảng 5 gam mỡ lợn và 10 mL dung dịch NaOH 40%.
• Bước 2: Đun sôi nhẹ hỗn hợp, liên tục khuấy đều bằng đũa thủy tinh khoảng 30 phút và thỉnh thoảng thêm nước cất để giữ cho thể tích hỗn hợp không đổi. Để nguội hỗn hợp.
• Bước 3: Rót thêm vào hỗn hợp 15 – 20 mL dung dịch NaCl bão hòa nóng, khuấy nhẹ. Để yên hỗn hợp.
Cho các phát biểu sau:
(1) Sau bước 3 thấy có lớp chất rắn màu trắng nổi lên là glycerol.
(2) Vai trò của dung dịch NaCl bão hòa ở bước 3 là để tách muối sodium của acid béo ra khỏi hỗn hợp.
(3) Ở bước 2, nếu không thêm nước cất, hỗn hợp bị cạn khô thì phản ứng thủy phân không xảy ra.
(4) Ở bước 1, nếu thay mỡ lợn bằng dầu dừa thì hiện tượng thí nghiệm sau bước 3 vẫn xảy ra tương tự.
(5) Trong công nghiệp, phản ứng ở thí nghiệm trên được ứng dụng để sản xuất xà phòng và glycerol.
Có bao nhiêu phát biểu đúng?
A. 5. B. 3. C. 2. D. 4.
(Xem giải) Câu 24. Cho 20 gam CuO tác dụng vừa đủ với dung dịch H2SO4 25% đun nóng, sau đó làm nguội dung dịch đến 10°C. Biết rằng ở 10°C cứ 100 gam H2O hòa tan 14,4 gam CuSO4. Khối lượng tinh thể CuSO4.5H2O đã tách ra khỏi dung dịch là
A. 48,91 gam. B. 34,33 gam. C. 50 gam. D. 22,5 gam.
(Xem giải) Câu 25. Cách nào sau đây không dùng để dập tắt đám cháy bằng xăng dầu:
A. phun nước vào ngọn lửa.
B. dùng hệ thống chữa cháy bằng bọt Foam được dành cho các kho xăng dầu.
C. phủ cát lên ngọn lửa.
D. dùng chăn chiên ướt trùm lên ngọn lửa.
(Xem giải) Câu 26. Dịch vị dạ dày thường có pH trong khoảng từ 1,5 – 3,5. Những người nào bị mắc bệnh viêm loét dạ dày, tá tràng thường có pH < 1,5. Để chữa căn bệnh này, người bệnh thường uống trước bữa ăn chất nào sau đây?
A. Nước đường saccarose.
B. Nước đun sôi để nguội.
C. Một ít giấm ăn.
D. Dung dịch sodium hydrogen carbonate.
(Xem giải) Câu 27. Dãy gồm các ion X+, Y- và nguyên tử Z đều có cấu hình electron 1s2 2s2 2p6 là
A. Na+, Cl-, Ar. B. K+, Cl-, Ar. C. Na+, F-, Ne. D. Li+, F-, Ne.
(Xem giải) Câu 28. Hòa tan 12,675 gam một oleum A vào nước được 300 mL dung dịch Y. Chuẩn độ 10 mL dung dịch Y bằng dung dịch NaOH 0,25M thì kết quả cho ở bảng sau:
| Chuẩn độ | Lần 1 | Lần 2 | Lần 3 |
| Thể tích dung dịch NaOH 0,25M (mL) | 39,9 | 40,0 | 40,1 |
Khối lượng phân tử của oleum (amu) là
A. 418. B. 178. C. 258 D. 338
(Xem giải) Câu 29. Lactic acid (C3H6O3) là hợp chất hóa học đóng vai trò quan trọng trong nhiều quá trình sinh hóa. Khi vận động mạnh, không được cung cấp đủ oxygen, cơ thể sẽ chuyển từ hô hấp hiếu khí sang hô hấp kị khí tạo lactic acid (gây hiện tượng mỏi cơ) và năng lượng theo phương trình sau:
C6H12O6(aq) → 2C3H6O3(aq) ![]() = -150 kJ
= -150 kJ
Một người chạy bộ cần tiêu tốn 500 kcal (1 cal = 4,184 J) nhưng chỉ 98% năng lượng cho cơ thể được cung cấp nhờ oxygen qua hô hấp, phần còn lại nhờ vào sự chuyển hóa glucose thành lactic acid. Khối lượng lactic acid (gam) tạo ra từ glucose bằng cách hô hấp kị khí theo phương trình hóa học trên là a gam. Giá trị của a là (kết quả làm tròn đến hàng phần mười)
A. 30,1. B. 30,2. C. 50,2. D. 50,1.
(Xem giải) Câu 30. Cho các dung dịch có cùng nồng độ 0,1M: glucose, ammonia, aniline, ethylamine được kí hiệu ngẫu nhiên là X, Y, Z, T. Tiến hành đo giá trị pH của mỗi dung dịch thu được kết quả theo bảng sau:
| Dung dịch | X | Y | Z | T |
| pH | 8,8 | 11,1 | 11,9 | 7,0 |
Các dung dịch glucose, ammonia, aniline, ethylamine tương ứng với các kí hiệu là
A. Z, X, Y, T. B. T, X, Z, Y. C. T, Y, X, Z. D. X, T, Y, Z.
PHẦN II (8.0 điểm). Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 8. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 1. Muối Mohr có công thức (NH4)2Fe(SO4)2.6H2O. Để xác định độ tinh khiết của một loại muối Mohr (cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến hành các thí nghiệm sau: Cân chính xác 7,237 gam muối Mohr, pha thành 100 ml dung dịch X. Lấy chính xác 10 mL dung dịch X, thêm 10 mL dung dịch H2SO4 10%, được dung dịch Y. Chuẩn độ dung dịch Y bằng dung dịch chuẩn KMnO4 0,023M. Thực hiện chuẩn độ 3 lần. Kết quả đạt được như sau:
| Lần chuẩn độ | 1 | 2 | 3 |
| Thể tích dung dịch KMnO4 (ml) | 16,0 | 16,1 | 16,0 |
Chọn đúng hoặc sai trong mỗi phát biểu sau:
a) Có thể thay dung dịch H2SO4 đã dùng bằng dung dịch acid mạnh như HCl, HNO3 nhưng phải đảm bảo lượng H+ dư sau phản ứng.
b) Theo kết quả chuẩn độ ở trên, trong số các giá trị: 93,32; 98,45; 97,36; 99,87, độ tinh khiết (% khối lượng (NH4)2Fe(SO4)2.6H2O) của muối Mohr có giá trị gần nhất với 98,45.
c) Trong mỗi lần chuẩn độ, dung dịch KMnO4 được xem là phản ứng vừa đủ với muối Mohr (điểm dừng) khi giọt dung dịch KMnO4 cuối cùng nhỏ vào dung dịch Y không mất màu.
d) Dung dịch H2SO4 được thêm vào dung dịch chuẩn độ để tạo môi trường acid, giúp phản ứng xảy ra theo hướng tạo thành Mn2+.
(Xem giải) Câu 2. Kết quả phân tích thành phần của một muối sulfate ngâm nước (X) của kim loại M thu được kết quả như sau:
| Nguyên tố | M | O | S | H |
| Thành phần khối lượng (%) | 25,6 | 57,6 | 12,8 | 4,0 |
Biết trong thành phần của X , nước chiếm 36,0% khối lượng. Trong nông nghiệp, muối X được dùng đề pha chế thuốc Bordeaux dùng để dię̣t nấm mốc cho cây trồng. Cách pha chế 10 lít dung dịch Bordeaux 1% như sau:
– Bước 1: Pha 0,1 kg muối X trong 8,0 lít nước.
– Bước 2: Pha 0,1 kg vôi sống (CaO) trong 2,0 lít nước.
– Bước 3: Đổ dung địch muối X vào nước vôi, vừa đổ vừa khuấy, thu được dung dịch Bordeaux 1% ở dạng keo, màu xanh nhạt, , độ lắng chậm.
a) Có thể sử dụng thùng làm bằng aluminium hoặc iron để pha chế thuốc Bordeaux.
b) Ở bước 3, có thể thao tác ngược lại là đổ nước vôi vào dung dịch muối X .
c) Một phân từ X có chứa 5 phân tử nước.
d) Ở bước 2, nếu dùng vôi tôi thay cho vôi sống thì cần dùng 0,132 kg..
(Xem giải) Câu 3. Trong công nghiệ̣p, kim loại Al được sản xuất bằng phương pháp điện phân nóng chảy hỗn hợp và cryolite theo sơ đồ như hình dưới đây.
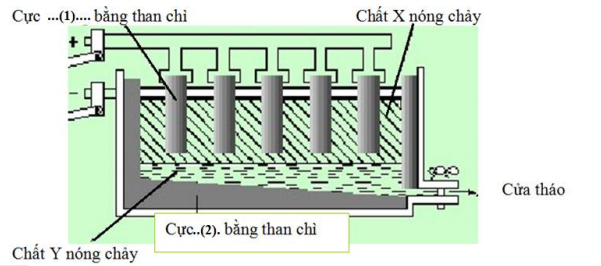
a) Chất X nóng chảy vừa là nguyên liệu của quá trình điện phân, vừa bảo vệ Al sinh ra không bị oxi hoá bởi khí oxygen.
b) Các thanh điện cực (1) sẽ bị mòn dần trong quá trình sản xuất Al do bị oxi hóa thành carbon oxide.
c) Cực (1) và (2) lần lượt là cực âm (anode) và cực dương (cathode).
d) Chất Y nóng chảy chủ yếu là Al .
(Xem giải) Câu 4. Năm 1965, trong quá trình tổng hợp thuốc chống loét dạ dày, nhà hóa học James M. Schlatter (Mỹ) đã vô tình phát hiện hợp chất X (một chất ngọt nhân tạo với tên thường gọi là “Aspartame”) có cấu tạo như hình dưới:
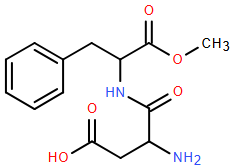
Aspartame ngọt hơn khoảng 200 lần so với đường ăn thông thường. Aspartame thường được sử dụng trong đồ uống và thực phẩm dành cho người ăn kiêng vì có ít calo hơn đường thông thường. Tổ chức Y tế thế giới (WHO) thông báo xếp chất làm ngọt nhân tạo aspartame vào danh sách các chất “có thể gây ung thư cho con người” nhưng lưu ý chất này vẫn an toàn nếu được tiêu thụ trong giới hạn khuyến nghị hằng ngày. Hướng dẫn của WHO đã không thay đổi kể từ năm 1981: tối đa 40 miligam aspartame/mỗi kg trọng lượng cơ thể/ngày. Các khuyến nghị của Mỹ “hào phóng” hơn một chút: Vào năm 1983, FDA (Cục quản lý Thực phẩm và Dược phẩm Hoa Kỳ) đưa ra mức 50 miligam/mỗi kg trọng lượng cơ thể/ngày. Hiệp hội Đồ uống Mỹ cho biết soda dành cho người ăn kiêng thường chứa trung bình 100 miligam aspartame mỗi lon.
Hãy cho biết những phát biểu sau đây là đúng hay sai?
a) Phần trăm khối lượng của nguyên tố oxygen trong aspartame khoảng 27,21%.
b) Nước ngọt có gas như pepsi vị chanh 0 calo “sảng khoái tột đỉnh, bung hết chất mình” có thể sử dụng aspartame làm chất tạo ngọt.
c) Aspartame là ester methyl với dipeptide tạo bởi acid bởi aspartic acid (HOOCCH(NH2)CH2COOH) và phenylalanine (C6H5CH2CH(NH2)COOH).
d) Số lon soda mà một người nặng trung bình ở Mỹ là 83kg nên uống theo khuyến nghị về lượng aspartame giới hạn hằng ngày của WHO và FDA hơn kém nhau khoảng 10 lon.
(Xem giải) Câu 5. Cho 1 mol ester X (C9H8O4, chứa vòng benzene) tác dụng tối đa với 3 mol NaOH, thu được 2 mol muối Y, 1 mol chất Z và 1 mol H2O. Chất Z tác dụng với dung dịch H2SO4 loãng, thu được chất hữu cơ T.
a) Chất T là hợp chất hữu cơ đa chức.
b) Phân tử chất Z có 2 nguyên tử oxygen.
c) Chất T tác dụng với Na theo tỉ lệ mol 1 : 1.
d) Chất Y có phản ứng tráng bạc (silver).
(Xem giải) Câu 6. Polymer X có tính dai, bền, mềm mại, óng mượt, ít thấm nước, giặt mau khô. Polymer X dùng để dệt vải may mặc, vải lót săm lốp xe, dệt bít tất, bện làm dây cáp, dây dù, đan lưới, … Cấu tạo một đoạn mạch polymer X như sau:

a) X được điều chế từ hexamethylenediamine và adipic acid bằng phản ứng trùng hợp.
b) X có tên là tơ nylon-6,6.
c) Các loại vải làm từ nylon-6,6 có thể giặt trong nước có độ kiềm cao.
d) Các nhóm amide trong nylon-6,6 có khả năng tạo liên kết hydrogen giữa các chuỗi polymer, giúp tăng cường các tính chất cơ học cho nylon-6,6.
(Xem giải) Câu 7. Saccharose monolaurate là ester thu được khi cho saccharose tác dụng với lauric acid.
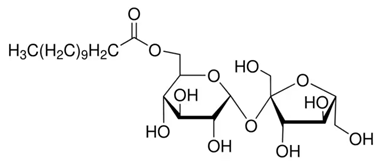
Chọn đúng hoặc sai trong mỗi phát biểu sau:
a) Saccharose monolaurate có phản ứng với thuốc thử Tollens.
b) Từ 500 g saccharose và 100 g lauric acid có thể điều chế được tối đa 123,14 gam saccharose monolaurate. Cho biết hiệu suất phản ứng đạt 47%.
c) Saccharose monolaurate được sử dụng làm chất nhũ hoá do phân tử có một đầu ưa nước gắn với một đuôi dài kị nước.
d) Công thức phân tử của saccharose monolaurate C24H45O12.
(Xem giải) Câu 8. Hợp chất Cinnamaldehyde (gọi là hợp chất A) có nhiều trong vỏ cây quế và có mùi thơm của quế chín. Kết quả phân tích nguyên tố hợp chất A cho biết %C = 81,82%; %H = 6,061%; còn lại là O. Khi chụp phổ khối lượng MS, biết peak ion phân tử [M+] của A là m/z = 132. Biết rằng chất A có chứa vòng benzene và có một nhóm thế; cấu trúc ở dạng trans và có phản ứng tráng bạc. Chọn đúng hoặc sai trong mỗi phát biểu sau:
a) Công thức phân tử của chất A là C9H8O2.
b) Vỏ quế để lâu trong không khí sẽ bị mất mùi thơm, nguyên nhân chính là cho chất A bị oxi hóa bởi oxygen trong không khí.
c) Chất A phản ứng H2 dư (xúc tác Ni, t°, áp suất cao) theo tỉ lệ mol tối đa là 1:5.
d) Chất A có phản ứng iodoform.
PHẦN III (3.0 điểm). Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
(Xem giải) Câu 1. Để hàn các vết đứt gãy trên đường ray xe lửa, người ta sử dụng hỗn hợp tecmit (gồm Al và Fe2O3 theo tỉ lệ mol tương ứng 2 : 1). Khi tiến hành hàn đường ray bằng hỗn hợp tecmit xảy ra phản ứng hóa học:
2Al(s) + Fe2O3(S) → Al2O3(s) + 2Fe(s)
Biết nhiệt tạo thành chuẩn của Fe2O3(s) và Al2O3(s) lần lượt là -826 kJ/mol và -1666 kJ/mol, hiệu suất phản ứng đạt 95%. Nhiệt lượng tỏa ra (kJ) khi dùng 107 gam hỗn hợp tecmit là bao nhiêu? (Làm tròn kết quả đến hàng đơn vị). Nguyên tử khối: O = 16, Al = 27, Fe = 56.
(Xem giải) Câu 2. Giả thiết quá trình quang hợp tạo thành 1 mol glucose ở cây lương thực cần hấp thụ 2800 kJ năng lượng từ ánh sáng Mặt Trời. Trung bình mỗi phút, 1m² mặt đất nhận được từ Mặt trời 60 kJ năng lượng và chỉ có 1% được hấp thụ ở quá trình quang hợp. Khối lượng glucose tạo ra trong 7 giờ chiếu sáng trên một sào Bắc Bộ (360 m²) trồng cây lương thực là bao nhiêu gam?
(Xem giải) Câu 3. Phương pháp trao đổi ion để làm mềm nước cứng dựa trên sự thay thế các ion Mg2+ và Ca2+ trong nước cứng (kí hiệu chung là M2+) bằng các cation Na+, H+ có trong các gốc -SO3Na hoặc -SO3H được gắn vào trong nhựa trao đổi ion. Khi nước cứng đi qua nhựa, các ion Mg2+ và Ca2+ sẽ được giữ lại và các ion H+, Na+ từ nhựa sẽ đi vào nước theo phản ứng: M2+ + 2R-SO3X → (R-SO3)2M + 2X+ (trong đó X+ là H+ hoặc Na+). Một loại nhựa cationite có phần trăm khối lượng sulfur là 7,94% được sử dụng để loại bỏ các ion trong nước cứng. Nếu khối lượng nhựa cationite đó là 500 gam thì tổng số mol Mg2+ và Ca2+ tối đa có thể được loại bỏ là x mol. Giá trị của x là bao nhiêu? (Làm tròn kết quả đến hàng phần trăm)
(Xem giải) Câu 4. Sodium dodecylbenzene sulfonate (SDBS), là một loại chất hoạt động bề mặt đa năng có nhiều ứng dụng trong chất tẩy rửa, sản phẩm làm sạch và nhiều quy trình công nghiệp khác nhau.
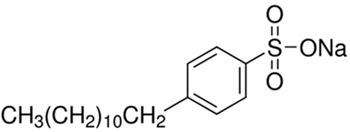
(a) SDBS có đầu ưa nước là Na+.
(b) Chất giặt rửa tổng hợp được sản xuất từ dầu mỏ qua nhiều giai đoạn.
(c) SDBS không thể dùng trong nước có hàm lượng Ca(HCO3)2 cao vì tạo kết tủa với Ca2+.
(d) SDBS có giá thành thấp, không gây ô nhiễm môi trường nên được sử dụng rộng rãi.
Số phát biểu đúng là bao nhiêu?
(Xem giải) Câu 5. Vải Thiều Lục Ngạn (Bắc Giang) là loại quả mang giá trị dinh dưỡng và kinh tế cao. Theo tính toán của một nhà vườn, cứ thu được 100 kg quả vải thì cần cung cấp khoảng 1,84 kg nitrogen, 0,62 kg phosphorus và 1,26 kg kali, để bù lại cho cây phục hồi, sinh trưởng và phát triển. Trong một vụ thu hoạch, nhà vườn đã thu được 10 tấn quả vải và đã dùng hết x kg phân bón NPK (20 – 20 – 15) trộn với y kg phân KCl (độ dinh dưỡng 60%) và z kg urea (độ dinh dưỡng 46%) để bù lại cho cây. Tổng giá trị (x + y + z) bằng bao nhiêu?. Kết quả làm tròn đến hàng đơn vị.
(Xem giải) Câu 6. PMMA (poly(methylmethacrylate)) là một nhựa nhiệt dẻo, trong suốt thường được sử dụng ở dạng tấm, miếng như một vật liệu nhẹ, khó bể vỡ có thể được dùng để thay thế cho kính và thủy tinh. PMMA được điểu chế theo 2 giai đoạn:
– Giai đoạn 1: Methyl alcohol tác dụng với methacrylic acid tạo thành methyl methacrylate.
– Giai đoạn 2: Trùng hợp methyl methacrylate tạo thành PMMA (poli(methylmethacrylate)).
Để sản xuất 500 tấm kính có chiều dài 20 cm, chiều rộng 15 cm có độ dày 2 cm (khối lượng riêng của tấm kinh là d = 1,2 gam/cm³) người ta cần tối thiểu m kg methacrylic acid. Biết trong mỗi tấm kính khối lượng PMMA chiếm 90% và hiệu suất phản ứng toàn bộ quá trình tính theo methacrylic acid là 80%. Tính giá trị của m. (kết quả làm tròn đến hàng đơn vị).


Bình luận