[2025 – 2026] Thi học sinh giỏi lớp 9 – Tỉnh Ninh Bình (Đề minh họa)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề 009-H09C năm 2025-2026
⇒ Thời gian làm bài: 150 phút
(Xem giải) Câu 1. (2,0 điểm)
Hợp chất T được tạo ra từ 3 nguyên tử của 2 nguyên tố X và Y. Tổng số hạt mang điện trong hạt nhân của các nguyên tử trong phân tử T là 22. Ở trạng thái cơ bản, nguyên tử nguyên tố X có electron phân bố trên 2 lớp, lớp thứ hai có 4 electron.
a) Xác định công thức hóa học của T (biết số proton trong nguyên tử của một số nguyên tố: Li = 3; Be = 4; B = 5; C = 6; N = 7; O = 8; F = 9; Ne = 10).
b) Khi cho sợi Mg nung nóng vào bình chứa khí T, thấy sợi Mg cháy thu được oxide M và đơn chất X. Vẽ sơ đồ mô tả sự tạo thành liên kết trong phân tử T và M. Cho biết bản chất liên kết trong phân tử T và M thuộc loại liên kết nào?
(Xem giải) Câu 2. (2,0 điểm)
Thực hiện hai thí nghiệm với cùng một lượng bột CaCO3 cho tác dụng với lượng dư dung dịch HCl có nồng độ khác nhau. Thể tích khí CO2 thoát ra theo thời gian được ghi lại trên đồ thị (hình bên).
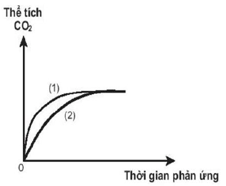
a) Thí nghiệm nào đã dùng dung dịch HCl có nồng độ cao hơn? Giải thích.
b) So sánh thể tích khí CO2 thu được trong hai thí nghiệm sau khi phản ứng kết thúc. Giải thích. Biết khí CO2 sinh ra trong cả hai thí nghiệm được thu ở cùng điều kiện nhiệt độ và áp suất, các phản ứng xảy ra hoàn toàn.
c) Đề xuất ba biện pháp làm tăng tốc độ phản ứng khi cho CaCO3 tác dụng với dung dịch HCl.
(Xem giải) Câu 3. (2,0 điểm)
Calcium carbonate là thành phần chính có trong vỏ trứng, vỏ sò, vỏ ốc,… Để xác định hàm lượng calcium carbonate có trong một mẫu vỏ trứng, một nhóm học sinh đã làm như sau:
• Bước 1: Rửa sạch vỏ trứng bằng nước cất, sấy cho đến khi khô hoàn toàn rồi nghiền thành bột.
• Bước 2: Cân chính xác 0,22 gam bột vỏ trứng rồi cho vào bình nón. Thêm 100,0 mL dung dịch hydrochloric acid 0,20 M vào bình nón, đậy hờ và để yên trong vài giờ cho phản ứng xảy ra hoàn toàn.
• Bước 3: Lọc hỗn hợp phản ứng trong bình nón, thu phần dung dịch đã lọc vào bình định mức 250,0 mL, rồi thêm nước cất đến vạch định mức và lắc đều.
• Bước 4: Rót dung dịch sodium hydroxide 0,10 M vào buret 25,0 mL, loại bỏ bọt khí và điều chỉnh mực dung dịch trùng với vạch 0.
• Bước 5: Chuyển 25,0 mL dung dịch đã chuẩn bị ở bước 3 vào bình nón, thêm vài giọt chất chỉ thị acid-base thích hợp và tiến hành chuẩn độ. Học sinh đã thực hiện chuẩn độ sơ bộ (bước thử trước khi chuẩn độ chính thức) rồi lặp lại chuẩn độ 3 lần chính thức, kết quả được ghi lại trong bảng sau:
| Chuẩn độ sơ bộ | Lần 1 | Lần 2 | Lần 3 | |
| Vdd NaOH chuẩn độ (mL) | 16,4 | 16,4 | 16,2 | 16,3 |
a) Viết các phương trình hóa học của các phản ứng xảy ra.
b) Nêu hai lí do vì sao không chuẩn độ trực tiếp calcium carbonate trong vỏ trứng bằng dung dịch HCl.
c) Học sinh lặp lại thí nghiệm chuẩn độ bằng cùng một thiết bị nhưng sử dụng dung dịch NaOH 1,0 M. Giải thích vì sao điều này lại gây ra hạn chế cho quy trình chuẩn độ.
d) Tính hàm lượng calcium carbonate trong mẫu vỏ trứng.
(Xem giải) Câu 4. (2,0 điểm)
X, Y, Z là ba hóa chất được dùng phổ biến làm phân bón hóa học. Chúng là các phân bón đơn để cung cấp ba thành phần chính: đạm, lân và kali cho cây trồng. Ba hóa chất này đều tan trong nước, biết:
– Dung dịch nước của X cho kết tủa màu trắng với dung dịch Na2CO3 dư.
– Khi cho dung dịch HCl vào dung dịch Y, không có hiện tượng. Ngược lại, khi cho dư dung dịch NaOH vào dung dịch Y rồi đun sôi, có mùi khai bay ra. Dung dịch Y cũng tạo kết tủa trắng với dung dịch BaCl2.
– Dung dịch nước của Z tạo kết tủa trắng với dung dịch AgNO3, nhưng không tạo kết tủa với dung dịch BaCl2.
Hãy xác định công thức hóa học của X, Y, Z, ghi rõ tên loại phân bón tương ứng và viết các phương trình hóa học minh họa cho các hiện tượng đã nêu trên.
(Xem giải) Câu 5. (3,0 điểm)
Sắt (iron) tinh khiết ít được sử dụng trong thực tế nhưng hợp kim của sắt là gang và thép lại được dùng rộng rãi. Một công ty sản xuất gang, thép sử dụng nguyên liệu là quặng hematite (thành phần chính Fe2O3), than cốc và chất tạo xỉ là CaCO3,… Quặng sắt, than cốc và đá vôi được đưa vào lò cao qua miệng lò, chuyển dần từ trên xuống, không khí nóng được thổi từ dưới lên. Sắt nóng chảy hòa tan một phần carbon và một lượng nhỏ các nguyên tố khác như Mn, Si,… đó là gang. Quá trình sản xuất gang có ba giai đoạn chính.
• Giai đoạn 1 – Tạo chất khử CO. Không khí nóng được thổi vào lò, đốt cháy than cốc tạo CO2; khí CO2 tiếp tục phản ứng với than cốc ở lớp trên tạo CO.
• Giai đoạn 2 – Khử oxide của sắt bằng CO thu được các sản phẩm chất rắn trung gian tương ứng là Fe3O4, FeO và cuối cùng là Fe.
• Giai đoạn 3 – Phản ứng tạo xỉ. Chất CaCO3 bị phân huỷ thành CaO, sau đó CaO kết hợp với SiO2 tạo xỉ.
a) Viết các phương trình phản ứng xảy ra trong mỗi giai đoạn trên.
b) Nêu ít nhất một vai trò của than cốc trong quá trình luyện gang.
c) Để xác định hàm lượng sắt trong một mẫu thép tái chế, người ta tiến hành cân 2,48 gam mẫu thép, nghiền nhỏ rồi cho tác dụng với dung dịch H2SO4 loãng. Lọc bỏ phần không tan, thu dung dịch rồi pha thành 100 mL dung dịch T. Biết 10,0 mL dung dịch T phản ứng vừa đủ với 8,80 mL dung dịch KMnO4 0,1 M theo phản ứng sau:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Tính hàm lượng sắt trong mẫu thép tái chế, biết các phản ứng xảy ra hoàn toàn.
(Xem giải) Câu 6. (2,0 điểm)
Trong các nhà máy cung cấp nước sinh hoạt, công đoạn cuối cùng của xử lý nước là khử trùng. Hóa chất khử trùng đang dùng phổ biến ở nước ta hiện nay là khí chlorine. Lượng chlorine được bơm vào bể tiếp xúc; một phần tan trong nước, một phần tác dụng với nước tạo hydrochloric acid và hypochlorous acid (HClO). Trong công nghiệp, chlorine được sản xuất bằng điện phân dung dịch sodium chloride bão hòa có màng ngăn xốp, thu được sodium hydroxide, khí chlorine và khí hydrogen. Nếu không có màng ngăn, các sản phẩm sau điện phân trộn lẫn và tạo muối của hydrochloric acid và hypochlorous acid.
Theo Quy chuẩn Quốc gia của Việt Nam (QCVN 01-1:2018/BYT), hàm lượng chlorine tự do đối với nước sạch sinh hoạt là 0,2–1,0 mg/L. Nếu hàm lượng chlorine nhỏ hơn 0,2 mg/L thì không tiêu diệt hết vi khuẩn và không xử lý hết chất hữu cơ; nếu lớn hơn 1,0 mg/L có thể gây kích ứng…
Hãy thực hiện các yêu cầu sau:
a) Sáng sớm khi mở vòi nước để rửa mặt, thỉnh thoảng ta ngửi thấy nước có mùi xốc khó chịu, nhưng sau một thời gian, không còn mùi đó nữa. Hãy giải thích hiện tượng trên và đề xuất biện pháp để hạn chế mùi xốc trong nước sinh hoạt tại gia đình.
b) Viết phương trình hóa học của các phản ứng xảy ra trong đoạn thông tin trên và cho biết vai trò của màng ngăn xốp.
c) Tính khối lượng chlorine tối thiểu cần dùng để khử trùng 10000 m³ nước sinh hoạt.
(Xem giải) Câu 7. (4,0 điểm)
Nhằm giảm tác động của biến đổi khí hậu, tăng cường sử dụng nguồn nhiên liệu tái tạo, hiện nay xăng sinh học E5 đã được sử dụng rộng rãi trên toàn quốc. Trong xăng sinh học E5, ethyl alcohol (hay ethanol) chiếm 5% thể tích hỗn hợp, phần còn lại là xăng truyền thống.
a) Tính thể tích mL C2H5OH và xăng truyền thống có trong 1 lít xăng E5.
b) Thực vật hấp thụ CO2 từ khí quyển và chuyển hóa thành glucose (phản ứng 1), ethanol sinh ra trong quá trình lên men glucose (phản ứng 2). Viết phương trình hoá học các phản ứng (1) và (2). Giải thích vì sao việc sử dụng xăng sinh học E5 làm giảm lượng carbon dioxide.
c) Đốt cháy một mol ethanol giải phóng 1367 kJ nhiệt lượng; đốt cháy một mol xăng truyền thống (quy đổi về C8H18) giải phóng 5450 kJ nhiệt lượng. Khối lượng riêng của ethanol nguyên chất là 0,8 g/mL, của xăng truyền thống (hay C8H18) là 0,7 g/mL. Tính nhiệt lượng giải phóng khi đốt cháy 1 lít xăng E5.
d) Cho sơ đồ điều chế: (C6H10O5)n → nC6H12O6 → 2nC2H5OH
Biết hiệu suất của mỗi quá trình là 80%, gỗ chứa 55% cellulose. Tính khối lượng gỗ cần để điều chế 100 m³ ethanol.
(Xem giải) Câu 8. (3,0 điểm)
Một học sinh thực hiện điều chế giấm gạo theo các bước sau:
• Bước 1: Nấu chín 2,0 kg gạo trộn đều với chế phẩm enzyme, sau đó cho hỗn hợp vào lọ thủy tinh, ủ trong lọ kín, tránh ánh sáng mặt trời để thực hiện quá trình lên men rượu.
• Bước 2: Chưng cất hỗn hợp sau lên men, hơi bay ra được làm lạnh sẽ hóa lỏng và chảy vào bình hứng.
• Bước 3: Thêm men giấm vào hỗn hợp lỏng trong bình hứng.
• Bước 4: Sau thời gian lên men giấm, hỗn hợp được tiến hành lọc và đóng chai lưu trữ. Biết khối lượng riêng của giấm gạo bằng 1,05 g/mL.
a) Nêu vai trò của men giấm ở bước 3.
b) Viết phương trình hóa học của các phản ứng xảy ra trong các bước trên để tạo ra acetic acid.
c) Để xác định hàm lượng acetic acid trong giấm gạo thu được sau bước 4, học sinh thực hiện thí nghiệm sau:
– Pha loãng 10 mL mẫu giấm gạo với nước cất, thu được 100 mL dung dịch T.
– Trung hòa lượng acetic acid trong 10 mL dung dịch T bằng dung dịch NaOH 0,1M thì thể tích dung dịch NaOH cần dùng là 9,0 mL. Tính nồng độ phần trăm acetic acid trong giấm gạo.
d) Sau quá trình điều chế, thu được 12 chai giấm gạo và mỗi chai chứa 500 mL dung dịch. Tính hiệu suất của toàn quá trình điều chế giấm gạo, biết gạo chứa 70% tinh bột.


đưa một số đứa bạn bảo đề 12 ai cũng tin sái cổ haha