[2025] Thi thử TN sở GDĐT Lạng Sơn (Lần 2)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 111
⇒ Đề thi, đáp án và giải chi tiết:
| 1C | 2C | 3C | 4A | 5C | 6D | 7B | 8D | 9A |
| 10D | 11B | 12B | 13A | 14B | 15D | 16C | 17D | 18B |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | S | Đ | Đ | S | 8,4 | 1234 | 2 |
| (b) | Đ | Đ | S | Đ | 26 | 27 | 28 |
| (c) | S | Đ | Đ | S | 14 | 15 | 4 |
| (d) | Đ | S | Đ | Đ |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Từ các amino acid có thể sản xuất nhiều loại tơ polyamide bền, dai nên được dùng làm vải may mặc. Trùng ngưng 101,9 kg ε-aminocaproic acid để tổng hợp tơ capron (polycaproamide) thì thu được 12,6 kg nước. Hiệu suất phản ứng tổng hợp tơ capron là
A. 80,0%. B. 85,4%. C. 90,0%. D. 91,7%.
(Xem giải) Câu 2. Trong các phát biểu sau, phát biểu sai là
A. có thể phân biệt được fructose và saccharose bằng phản ứng tráng gương.
B. có thể phân biệt được glucose và saccharose bằng phản ứng tráng gương.
C. có thể phân biệt được saccharose và glycerol bằng Cu(OH)2.
D. có thể phân biệt được hồ tinh bột và cellulose bằng I2.
(Xem giải) Câu 3. Chất nào sau đây được dùng làm thành phần chính của xà phòng?
A. CH3[CH2]11OSO3Na. B. CH3[CH2]3COONa.
C. CH3[CH2]14COONa. D. CH3[CH2]16COOH.
(Xem giải) Câu 4. Điện phân dung dịch CuSO4 với các điện cực trơ. Cho các phát biểu sau:
(a) Khi có dòng điện chạy qua, các ion sẽ di chuyển về các điện cực trái dấu.
(b) Tại anode xảy ra quá trình oxi hoá SO42-.
(c) Tại cathode có thể xảy ra quá trình khử Cu2+ và H2O.
(d) Khối lượng dung dịch giảm trong quá trình điện phân.
Số phát biểu đúng là
A. 2. B. 4. C. 3. D. 1.
(Xem giải) Câu 5. Chất thuộc loại polymer thiên nhiên là
A. tơ visco. B. tơ nylon-6,6. C. tơ tằm. D. tơ nitron.
(Xem giải) Câu 6. Chất nào sau đây ít tan trong nước ở điều kiện thường?
A. CH3COOH. B. CH3CH2OH. C. HCHO. D. C2H5COOCH3.
(Xem giải) Câu 7. Có ba ống nghiệm (1), (2), (3) chứa riêng biệt ba hoá chất sau: ethanol, glycerol, phenol (có thể không theo thứ tự). Một học sinh tiến hành thí nghiệm để nhận biết các chất trên, thu được kết quả ở bảng sau:
| Thuốc thử | (1) | (2) | (3) |
| H2O | Tan tốt | Ít tan | Tan tốt |
| Dung dịch bromine | Không hiện tượng | Kết tủa trắng | Không hiện tượng |
| Cu(OH)2 | Tạo phức xanh lam | Không tạo phức | Không tạo phức |
Thứ tự hoá chất trong các ống nghiệm (1), (2), (3) lần lượt là
A. phenol, glycerol, ethanol. B. glycerol, phenol, ethanol.
C. glycerol, ethanol, phenol. D. ethanol, glycerol, phenol.
(Xem giải) Câu 8. Phát biểu nào sau đây đúng?
A. Phân tử Gly-Ala có bốn nguyên tử oxygen.
B. Dung dịch glycine làm quỳ tím chuyển màu đỏ.
C. Ở điều kiện thường, aniline là chất khí tan nhiều trong nước.
D. Gly-Ala-Ala có phản ứng màu biuret.
(Xem giải) Câu 9. Số oxi hoá của nguyên tử trung tâm trong phức chất [Co(NH3)4(OH2)2]2+ là
A. +2. B. +6. C. +4. D. +3.
(Xem giải) Câu 10. Hiện tượng phú dưỡng là sự tích tụ lượng lớn các chất dinh dưỡng trong các nguồn nước, do các tác động của con người. Sự tích tụ lượng lớn các hợp chất của nguyên tố nào sau đây có thể gây ra hiện tượng phú dưỡng?
A. Chlorine. B. Calcium. C. Magnesium. D. Nitrogen.
(Xem giải) Câu 11. Một phân tử saccharose có
A. một đơn vị β–glucose và một đơn vị α–fructose.
B. một đơn vị α–glucose và một đơn vị β–fructose.
C. một đơn vị β–glucose và một đơn vị β–fructose.
D. hai đơn vị α–glucose.
(Xem giải) Câu 12. Kim loại nào sau đây có khối lượng riêng nhỏ nhất trong các kim loại?
A. Fe. B. Li. C. Al. D. Mg.
(Xem giải) Câu 13. Điểm chớp cháy của một chất là nhiệt độ thấp nhất ở áp suất khí quyển mà hơi của chất đó sẽ bốc cháy trong không khí khi tiếp xúc với nguồn lửa. Cho dãy các chất và điểm chớp cháy (°C) tương ứng như sau: Triethylamine (-7), pentane (-49), hexane (-22), benzene (-11). Chất nào trong các chất trên dễ bốc cháy nhất?
A. Pentane. B. Hexane. C. Benzene. D. Triethylamine.
(Xem giải) Câu 14. Phản ứng monochlorine hoá methane có phương trình hoá học:
(I) CH4 + Cl2 → CH3Cl + HCl
Giai đoạn tạo thành sản phẩm trong cơ chế của phản ứng (I) xảy ra như sau:
(II) •CH3 + Cl2 → CH3Cl + Cl•
Nhận định nào sau đây đúng?
A. Phản ứng (I) thuộc loại phản ứng cộng.
B. Trong giai đoạn (II), có sự tạo thành liên kết cộng hoá trị phân cực.
C. Trong giai đoạn (II), có sự hình thành liên kết π.
D. Trong phản ứng (I), dẫn xuất halogen tạo thành là chloroform.
(Xem giải) Câu 15. Carbon monoxide thay thế oxygen trong hemoglobin đã bị oxi hoá theo phản ứng:
HbO2(aq) + CO(aq) ⇋ HbCO(aq) + O2(aq)
Tại nhiệt độ trung bình trong cơ thể, hằng số cân bằng của phản ứng trên là Kc = 170.
Giả sử một hỗn hợp không khí bị ô nhiễm carbon monoxide ở mức 0,08% (theo thể tích). Coi không khí chứa 20,0% oxygen về thể tích; tỉ lệ oxygen và carbon monoxide hoà tan trong máu giống với tỉ lệ của chúng trong không khí. Tỉ lệ nồng độ [HbCO] so với [HbO2] trong máu có giá trị là
A. 0,765. B. 0,400. C. 0,450. D. 0,680.
(Xem giải) Câu 16. Cho các hợp kim: Fe – Cu, Fe – C, Fe – Zn, Fe – Mg. Khi để lâu trong không khí ẩm, số hợp kim trong đó Fe bị ăn mòn điện hóa là
A. 3. B. 1. C. 2. D. 4.
(Xem giải) Câu 17. Cho vào ống nghiệm khoảng 1 mL dung dịch CuSO4 0,5 M, sau đó thêm từ từ dung dịch HCl đặc, vừa cho vừa lắc ống nghiệm. Xảy ra quá trình sau:
[Cu(OH2)6]2+(aq) + 4Cl-(aq) → [CuCl4]2-(aq) + 6H2O(l)
Cho các phát biểu sau:
(a) Số oxi hóa của Cu trong hai phức [Cu(OH2)6]2+ và [CuCl4]2- lần lượt là +2 và -2.
(b) Phối tử của hai phức [Cu(OH2)6]2+ và [CuCl4]2- lần lượt là H2O và HCl.
(c) Phản ứng trên là phản ứng thay thế phối tử của phức chất trong dung dịch.
(d) Khi quá trình trên đạt trạng thái cân bằng, nếu tiếp tục thêm từ từ dung dịch HCl vào hệ thì cân bằng dần chuyển dịch sang trái.
Số phát biểu đúng là
A. 3. B. 2. C. 4. D. 1.
(Xem giải) Câu 18. Chromium (Z = 24) là kim loại chuyển tiếp dãy thứ nhất. Cấu hình electron nguyên tử của nguyên tố chromium là
A. [Ar] 3d4 4s2. B. [Ar] 3d5 4s1. C. [Ar] 3d6 4s2. D. [Ar] 4s2 4p4.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. Xét 3 amino acid sau: glycine, alanine, valine. Cho các phát biểu:
a) Từ ba amino acid: glycine, alanine, valine có thể tạo được tối đa 3 tripeptide (mỗi tripeptide đều chứa ba amino acid khác nhau).
b) Dipeptide X (chứa 2 trong 3 gốc α-amino acid trên). Khi phân tích thành phần nguyên tố trong X thu được phần trăm khối lượng của các nguyên tố như sau: %C= 41,10; %H=6,85; %N=19,18; còn lại là oxygen. Công thức cấu tạo của X có thể là Gly-Ala hoặc Ala-Gly.
c) Số nhóm amino và số nhóm carboxyl có trong một phân tử valine tương ứng là 2 và 1.
d) Phân tử khối của alanine là 89.
(Xem giải) Câu 20. Cho độ tan của các muối sulfate kim loại nhóm IIA ở 20°C như sau:
| Muối sulfate | MgSO4 | CaSO4 | SrSO4 | BaSO4 |
| Độ tan (g/100 g nước) | 33,7 | 0,2 | 0,0132 | 0,0028 |
(Nguồn: Dean, J.A (1999), Landge’s hand book of chemistry, United States of America, McGraw-Hill, Inc.)
a) Trong các chất trên, có 2 chất ít tan trong nước ở 20°C.
b) Biết rằng ở 20°C, nếu trong dung dịch có tích nồng độ ion (mol/L) của [Ca2+].[SO42-] > 2,15.10-4 thì xuất hiện kết tủa CaSO4. Nếu cho 20 mL dung dịch CaCl2 0,015 M tác dụng với 30 mL dung dịch Na2SO4 0,1 M ở 20°C thì có kết tủa xuất hiện (coi thể tích dung dịch sau phản ứng bằng 50 mL).
c) Theo bảng số liệu trên, độ tan của các muối sulfate giảm dần từ MgSO4 đến BaSO4.
d) Ở 20°C, nồng độ dung dịch MgSO4 bão hoà là 33,7%.
(Xem giải) Câu 21. Bộ phận quan trọng nhất của máy tạo nhịp tim là một hệ pin điện hóa lithium – iodine (gồm hai cặp oxi hóa khử Li+/Li và I2/2I-). Hai điện cực được đặt vào tim, phát sinh dòng điện nhỏ kích thích tim đập ổn định. Cho biết: E°Li+/Li = -3,04V; E°I2/2I- = +0,54V; Nguyên tử khối của Li = 6,9; điện tích của 1 mol electron là 96500 C/mol; q = I.t, trong đó q là điện tích (C), I là cường độ dòng điện (A), t là thời gian (s). Khi pin hoạt động:
a) Nếu pin tạo ra một dòng điện có cường độ ổn định bằng 2,5.10-5A thì một pin được chế tạo bởi 0,1 gam lithium có thể hoạt động liên tục tối đa trong 647,5 ngày (Kết quả cuối cùng làm tròn đến hàng phần mười).
b) Ở cực âm xảy ra quá trình khử Li+ thành Li.
c) Iodine đóng vai trò là cathode và lithium đóng vai trò là anode.
d) Sức điện động chuẩn của pin điện hoá lithium – iodine có giá trị là +3,58 V.
(Xem giải) Câu 22. Phân tích nguyên tố hợp chất hữu cơ E cho kết quả phần trăm khối lượng carbon, hydrogen và oxygen lần lượt là 60%; 8% và 32%. Dựa vào phương pháp phân tích khối phổ (MS) xác định được phân tử khối của E là 100. Mặt khác, phổ hồng ngoại (IR) cho thấy phân tử E không chứa nhóm -OH (peak có số sóng > 3000 cm-1) nhưng lại chứa nhóm C=O (1780 cm-1). Thuỷ phân hoàn toàn E trong dung dịch NaOH, thu được muối của carboxylic acid X mạch phân nhánh và chất Y. Chất Y có nhiệt độ sôi (64,7 °C) nhỏ hơn nhiệt độ sôi của ethanol (78,3 °C) (nhiệt độ sôi đều đo ở áp suất 1 atm).
a) Chất E có thể được điều chế trực tiếp từ phản ứng ester hoá giữa chất Y với acrylic acid.
b) Tổng hợp E từ acid X và alcohol Y bằng phản ứng ester hoá với hiệu suất là 60%. Trùng hợp E để sản xuất polymer Z với hiệu suất là 80%. Để tổng hợp 120 kg polymer Z cần dùng 215 kg acid X và 80 kg alcohol Y.
c) Trong công nghiệp, chất Y được phối trộn với xăng RON 92 để tạo ra xăng sinh học.
d) E là nguyên liệu chính để sản xuất thuỷ tinh hữu cơ.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Theo QCVN 01-1:2018/BYT, hàm lượng sắt tối đa cho phép trong nước sinh hoạt là 0,3 mg/L. Một mẫu nước có hàm lượng sắt tồn tại ở dạng Fe2(SO4)3 và FeSO4 với tỉ lệ mol tương ứng là 1 : 8. Để đánh giá hàm lượng sắt trong mẫu nước trên người ta tiến hành tách loại sắt trong 10 m³ mẫu nước bằng cách sử dụng 122,1 gam vôi tôi (vừa đủ) để tăng pH, sau đó sục không khí, các phản ứng hoá học xảy ra theo các phương trình sau:
Fe2(SO4)3 + 3Ca(OH)2 → 2Fe(OH)3 + 3CaSO4 (1)
4FeSO4 + 4Ca(OH)2 + O2 + 2H2O → 4Fe(OH)3 + 4CaSO4 (2)
Giả thiết vôi tôi chỉ chứa Ca(OH)2. Xác định hàm lượng sắt (mg/L) trong mẫu nước trên (Kết quả cuối cùng làm tròn đến hàng phần mười).
(Xem giải) Câu 24. Hiện nay, trữ lượng các mỏ quặng kim loại ngày càng cạn kiệt, trong khi nhu cầu sử dụng kim loại ngày càng tăng và lượng phế thải kim loại tạo ra ngày càng nhiều. Do đó, tái chế kim loại là công việc cần thiết, vừa đảm bảo nguồn cung, vừa gia tăng giá trị kinh tế và thực hiện mục tiêu phát triển bền vững.
(1) Tái chế kim loại là quá trình thu gom kim loại từ các phế liệu kim loại.
(2) Tái chế kim loại đúng cách góp phần tiết kiệm nguồn tài nguyên thiên nhiên.
(3) Tái chế kim loại đúng cách góp phần bảo vệ môi trường.
(4) Sắt (dưới dạng thép) được tái chế nhiều hơn nhôm và đồng.
Viết số thứ tự của các phát biểu đúng theo thứ tự tăng dần từ trái sang phải (ví dụ: 12 hoặc 123 hoặc 23…).
(Xem giải) Câu 25. Cho các hydrogen halide: HF (1), HCl (2), HBr (3), HI (4) và các giá trị nhiệt độ sôi (°C, được sắp xếp không theo thứ tự): -66,7; -84,9; -35,8; 19,5. Số thứ tự của chất có giá trị nhiệt độ sôi bằng -84,9°C là bao nhiêu?
(Xem giải) Câu 26. Cellulose là nguồn nguyên liệu dồi dào, dễ tìm và có thể dùng để sản xuất ethanol. Dưới đây là cấu trúc của cellulose:
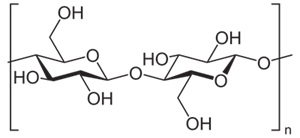
(1) Cellulose là polymer mạch không phân nhánh.
(2) Phân tử cellulose tạo bởi nhiều đơn vị α-glucose, nối với nhau qua liên kết α-1,4-glycoside.
(3) Cellulose có nhiều nhất trong trái cây chín.
(4) Với những tiến bộ công nghệ đạt được, từ 1 tấn cellulose có thể tạo được khoảng 400 lít ethanol. Hiệu suất của quá trình điều chế ethanol từ cellulose đạt được khi đó là 55,6% (kết quả cuối cùng làm tròn đến hàng phần mười). Cho khối lượng riêng của ethanol là 0,79 g/mL.
Sắp xếp các phát biểu đúng theo thứ tự tăng dần từ trái sang phải (ví dụ: 12 hoặc 123 hoặc 23…).
(Xem giải) Câu 27. Cơ quan Quản lý thực phẩm và Dược phẩm Hoa Kì (FDA) khuyến cáo rằng các chất bổ sung omega-3 có chứa EPA và DHA là an toàn nếu tổng liều lượng EPA và DHA không vượt quá 3000 mg mỗi ngày. Một loại thực phẩm dầu cá có bảng thành phần như hình sau:

Coi số viên được sử dụng trong một ngày là tối đa theo như khuyến cáo của FDA. Để sử dụng hết 150 viên nang thì cần tối thiểu bao nhiêu ngày? (kết quả cuối cùng làm tròn đến hàng đơn vị).
(Xem giải) Câu 28. Một nhà máy sản xuất túi nylon từ HDPE cần sản xuất túi đựng hình chữ nhật (có kích thước là 20 cm x 30 cm, bề dày của lớp nylon là 0,02 cm. Biết hiệu suất phản ứng trùng hợp ethylene để điều chế HDPE là 60%, quá trình chuyển nhựa thành túi có hiệu suất là 95% và khối lượng riêng của nhựa HDPE là 0,95 g/cm³. Khối lượng nguyên liệu ethylene (tấn) cần dùng để sản xuất đơn hàng 100.000 túi trên bằng bao nhiêu? (kết quả cuối cùng làm tròn đến hàng đơn vị).


Bình luận