[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Quảng Nam
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề 060-H12A năm 2024-2025
⇒ Thời gian làm bài: 90 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1A | 2B | 3D | 4A | 5D | 6A | 7B | 8B | 9D | 10C |
| 11B | 12C | 13C | 14D | 15C | 16B | 17B | 18C | 19D | 20B |
| 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | |
| (a) | S | Đ | Đ | Đ | Đ | Đ | 2550 | 1,65 |
| (b) | S | S | S | S | S | Đ | ||
| (c) | S | S | Đ | Đ | S | Đ | 29 | 30 |
| (d) | Đ | Đ | Đ | Đ | S | S | 2115 | 34 |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 20. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Cho bốn amine sau:
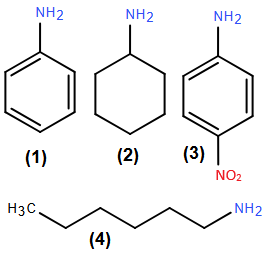
Chất nào trong các chất trên là aniline?
A. (1). B. (2). C. (3). D. (4).
(Xem giải) Câu 2. Một ha rừng cây bạch đàn 5 tuổi có mật độ trung bình là 1 cây/2m². Mỗi cây thu hoạch được 100 kg gỗ (chứa 60% cellulose). Từ 1 ha rừng trên sản xuất được m tấn giấy (chứa 95% cellulose, 5% chất phụ gia). Biết hiệu suất chung của quá trình là 80%, giá trị m gần đúng là
A. 228. B. 252,6. C. 263,2. D. 2526.
(Xem giải) Câu 3. Giá trị pH mà khi đó amino acid có nồng độ ion lưỡng cực là cực đại được gọi là điểm đẳng điện (pI). Cho các giá trị pI của 3 amino acid sau:
| H2NCH2COOH (glycine) | HOOCCH2CH2CH(NH2)COOH (glutamic acid) | H2N[CH2]4CH(NH2)COOH (lysine) |
| 6,0 | 3,2 | 9,7 |
Khi đặt hỗn hợp 3 amino acid trên trong điện trường, giá trị pH nào là tối ưu nhất để tách 3 chất ra khỏi dung dịch hỗn hợp của chúng?
A. pH = 14,0. B. pH = 9,7. C. pH = 3,2. D. pH = 6,0.
(Xem giải) Câu 4. Cho các phát biểu sau:
(1) Cao su thiên nhiên chứa các mắt xích isoprene, liên kết đôi trong mạch đều ở dạng cis.
(2) Vật liệu composite thường gồm hai thành phần chính là vật liệu cốt và vật liệu nền.
(3) Phương pháp xử lí rác thải nhựa không gây ô nhiễm môi trường là đốt cháy.
(4) Tơ tằm có thành phần chính là protein, chúng rất bền nhiệt và bền trong môi trường kiềm.
(5) Keo dán epoxy có thành phần chính là chất hữu cơ có nhóm –COOH và -NH2 ở hai đầu.
Có bao nhiêu phát biểu đúng?
A. 2. B. 3. C. 4. D. 5.
(Xem giải) Câu 5. Cho bảng giá trị ![]() của một số chất:
của một số chất:
| Chất | H2O(l) | H2O(g) | SO2(g) | H2S(g) |
| -285,83 | -241,82 | -296,83 | -20,63 |
Giá trị ![]() của phản ứng 2H2S(g) + 3O2(g) → 2SO2(g) + 2H2O(g) là
của phản ứng 2H2S(g) + 3O2(g) → 2SO2(g) + 2H2O(g) là
A. -1036,04 J. B.-1124,96 kJ. C. -1036,40 kJ. D. -1036,04 kJ.
(Xem giải) Câu 6. Công thức phức chất aqua của ion Mn2+ và ion Co3+ có dạng hình học bát diện là
A. [Mn(H2O)6]2+ và [Co(H2O)6]3+. B. [Mn(H2O)6]4+ và [Co(H2O)6]6+.
C. [Mn(H2O)4]2+ và [Co(H2O)6]3+. D. [Mn(H2O)6]2+ và [Co(H2O)3]3+.
(Xem giải) Câu 7. Cho sơ đồ chuyển hoá sau:
![]()
Biết X là dipeptide của α-amino acid T có cấu tạo không phân nhánh; Y và Z là hợp chất hữu cơ; mỗi mũi tên ứng với một phương trình hoá học của phản ứng giữa 2 chất tương ứng. Cho 2,7525 gam Z tác dụng với 100 mL dung dịch NaOH 0,5 M, cô cạn dung dịch sau phản ứng thu được bao nhiêu gam chất rắn khan?
A. 2,865. B. 3,9425. C. 3,295. D. 3,065.
(Xem giải) Câu 8. Cho các phát biểu sau:
(1) Đun chất béo với dung dịch kiềm đặc ta thu được muối của acid béo (thành phần chính của xà phòng) và glycerol.
(2) Thủy phân hoàn toàn 442 kg chất béo (có chứa 75% triolein về khối lượng) trong dung dịch KOH dư thu được 500 kg xà phòng chứa 75% potassium oleate về khối lượng.
(3) Trong phân tử linoleic acid có chứa 2 liên kết đôi C=C đều ở dạng cis.
(4) Chất giặt rửa tổng hợp có thể sử dụng được với nước cứng, xà phòng thì không nên vì tạo kết tủa và gây hỏng quần áo.
(5) Xà phòng và chất giặt rửa tự nhiên khó bị phân hủy sinh học nên gây ô nhiễm môi trường.
(6) Khi hòa tan xà phòng hoặc chất giặt rửa tổng hợp vào nước sẽ tạo dung dịch có sức căng bề mặt lớn làm cho vật cần giặt dễ thấm ướt.
Có bao nhiêu phát biểu đúng ?
A. 4. B. 3. C. 5. D. 6.
(Xem giải) Câu 9. Phát biểu nào sau đây về nhóm Halogen là đúng?
A. Đơn chất halogen tồn tại ở dạng phân tử X2, liên kết trong phân tử là liên kết cộng hóa trị có cực.
B. Từ fluorine đến iodine, khối lượng phân tử và bán kính nguyên tử tăng, dẫn đến nhiệt độ nóng chảy giảm.
C. Nước Javel được dùng để tẩy vết bẩn trên tất cả các loại áo quần.
D. HF có liên kết hydrogen liên phân tử nên nhiệt độ sôi cao bất thường so với các hydrogen halide còn lại.
(Xem giải) Câu 10. Cho các phát biểu sau:
(1) Tất cả các kim loại nhóm IIA đều tan trong nước.
(2) Các kim loại nhóm IA khử được kim loại yếu hơn trong dung dịch muối của chúng.
(3) Các ion Na+, Mg2+, Al3+ có cùng cấu hình electron ở trạng thái cơ bản và có tính oxi hoá yếu.
(4) Các kim loại kiềm K, Rb, Cs tự bốc cháy khi tiếp xúc với nước.
(5) Magnesium có E°Mg2+/Mg = −2,356V nên tác dụng mãnh liệt với H2O ở nhiệt độ thường.
Có bao nhiêu phát biểu đúng?
A. 3. B. 4. C. 2. D. 5.
(Xem giải) Câu 11. Cho các phát biểu sau:
(1) Để làm mềm nước cũng tạm thời có thể dùng dung dịch Ca(OH)2 hoặc NaOH.
(2) Nhúng thanh Cu trong dung dịch Fe2(SO4)3 có nhỏ vài giọt dung dịch H2SO4 có xuất hiện ăn mòn điện hóa.
(3) Các kim loại nhóm IIA có nhiệt độ sôi, nhiệt độ nóng chảy biến đổi không theo qui luật nhất định.
(4) Các kim loại đều có bán kính nhỏ hơn các phi kim thuộc cùng một chu kì.
(5) Khử zinc oxide ở nhiệt độ cao bằng than cốc thu được zinc ở trạng thái khí.
(6) Dùng dung dịch Fe2(SO4)3 dư có thể tách Ag ra khỏi hỗn hợp Ag và Cu.
Có bao nhiêu phát biểu đúng?
A. 3. B. 4. C. 5. D. 6.
(Xem giải) Câu 12. Cho phát biểu về sự ăn mòn của gang, thép trong không khí ẩm:
(1) Ăn mòn hoá học là chủ yếu.
(2) Carbon bị khử tại cathode.
(3) Oxygen đóng vai trò là chất oxi hoá.
(4) Tại anode, sắt bị oxi hoá.
(5) Carbon là cực âm, sắt là cực dương.
Các phát biểu đúng là
A. (1), (2). B. (2), (3). C. (3), (4). D. (4), (5).
(Xem giải) Câu 13. Phát biểu nào sau đây sai?
A. Tính dẫn điện và dẫn nhiệt của hợp kim thường kém hơn kim loại thành phần.
B. Độ cứng của hợp kim thường lớn hơn độ cứng của kim loại thành phần.
C. Hợp kim được tạo ra bằng cách trộn các kim loại theo tỷ lệ xác định.
D. Gang có nhiệt độ nóng chảy thấp hơn sắt nguyên chất.
(Xem giải) Câu 14. Hoà tan 23,2 gam một mẫu quặng X (chỉ chứa Fe3O4 và tạp chất trơ) bằng dung dịch sulfuric acid loãng dư. Lọc bỏ chất không tan, thêm nước cất vào dung dịch lọc, thu được 200 ml dung dịch X. Chuẩn độ 5,0 ml dung dịch X đã dùng hết 17,5 ml dung dịch KMnO4 0,02M. Phần trăm khối lượng Fe3O4 trong mẫu quặng X là
A. 14%. B. 23%. C. 80%. D. 70%.
(Xem giải) Câu 15. Phát biểu nào dưới đây là sai về quá trình sản xuất aluminium (Al) trong công nghiệp?
A. Điện phân nóng chảy Al2O3 với cryolite (Na3AlF6) làm xúc tác thu được Al ở cathode dưới dạng nóng chảy.
B. Trong quá trình điện phân phải hạ thấp dần các điện cực anode vào thùng điện phân, do khí O2 thoát ra đốt cháy dần điện cực.
C. Al có thể được tái chế nhiều lần do các tính chất vốn có của nó bị biến đổi, nên chủ yếu sử dụng trong xây dựng, …
D. Vai trò cryolite để tiết kiệm năng lượng, tạo chất lỏng có tính dẫn điện tốt và nổi lên trên Al lỏng để ngăn cách Al lỏng với không khí.
(Xem giải) Câu 16. Trong quá trình sản xuất sulfuric acid, sulfur dioxide được chuyển thành sulfur trioxide ở nhiệt độ 400 – 500°C theo phản ứng 2SO2(g) + O2(g) ⇋ 2SO3(g) ΔrH < 0.
Sau khi hệ đạt trạng thái cân bằng, một số yếu tố được thay đổi, kể cả thêm chất xúc tác, dẫn đến sự chuyển dịch trạng thái cân bằng như đồ thị bên.
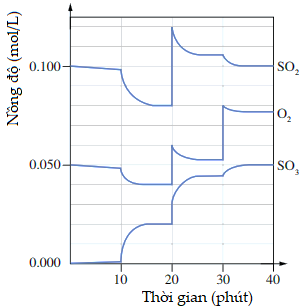
Cho các phát biểu sau:
(1) Biểu thức hằng số Kc của phản ứng Kc = p(SO3)²/[p(SO2)².p(O2)]
(2) Hệ đạt trạng thái cân bằng trong các khoảng thời gian: 15 – 20 phút, 25 – 30 phút, 35 – 40 phút.
(3) Tại thời điểm 18 phút, hệ đạt trạng thái cân bằng, có Kc = 0,02²/[0,08².0,04] = 1,5625 (L/mol)
(4) Tại thời điểm 20 phút đã thực hiện tăng áp suất bằng cách giảm thể tích của hệ, nên cân bằng chuyển dịch về phía thuận.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 1.
(Xem giải) Câu 17. Cho sơ đồ chuyển hóa:
![]()
Biết X, Y, Z, E là các hợp chất khác nhau và khác BaCO3; mỗi mũi tên ứng với một phương trình hóa học của phản ứng giữa hai chất tương ứng. Các chất X, Y thỏa mãn sơ đồ trên lần lượt là
A. CO2, BaCl2. B. Ba(HCO3)2, Ba(OH)2.
C. NaHCO3, BaCl2. D. NaHCO3, Ba(OH)2.
(Xem giải) Câu 18. Cho các phát biểu sau:
(1) Dùng phương pháp chưng cất để tách riêng các alkane có mạch carbon không phân nhánh sau: pentane (sôi ở 36°C), heptane (sôi ở 98°C), octane (sôi ở 126°C).
(2) Trong phương pháp kết tinh, người ta thường chọn dung môi mà chất cần tinh chế tan tốt ở nhiệt độ thường, độ tan của nó giảm nhanh khi tăng nhiệt độ.
(3) Mật ong để lâu thường thấy có những hạt rắn xuất hiện ở đáy chai, do nước trong mật ong bay hơi làm kết tinh đường saccharose.
(4) Phương pháp sắc kí cột có pha tĩnh là bột silicagel hoặc bột aluminium oxygende…, pha động là dung môi thích hợp được đổ ở phía dưới pha tĩnh.
(5) Tách tinh dầu từ hỗn hợp tinh dầu và nước bằng dung môi hexane thuộc phương pháp chiết lỏng – lỏng.
Có bao nhiêu phát biểu đúng?
A. 3. B. 1. C. 2. D. 5.
(Xem giải) Câu 19. Cho các phát biểu sau:
(1) Oxi hóa glucose bằng thuốc thử Tollens tạo ra gluconic acid.
(2) Dung dịch của glucose, saccharose đều có thể hòa tan Cu(OH)2 ở điều kiện thường.
(3) Cellulose trinitrate là nguyên liệu để sản xuất tơ nhân tạo và thuốc súng không khói.
(4) Trong cellulose, các gốc β-glucose chỉ liên kết với nhau bằng liên kết β-1,4-glycoside.
(5) Glucose và fructose có thể chuyển hóa lẫn nhau trong môi trường kiềm.
(6) Glucose là hợp chất hữu cơ đa chức.
Có bao nhiêu phát biểu đúng?
A. 6. B. 4. C. 5. D. 3.
(Xem giải) Câu 20. Một em học sinh thiết lập thí nghiệm như hình vẽ dưới đây:
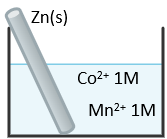
Biết thể điện cực chuẩn:
Mn2+(aq) + 2e ⇋ Mn(s) E° = -1,18V
Zn2+(aq) + 2e ⇋ Zn(s) E° = -0,76V
Co2+(aq) + 2e ⇋ Co(s) E° = -0,28V
Em đó đưa ra các phát biểu sau:
(1) Phản ứng xảy ra giữa Zn(s) và Co2+(aq) tạo được 1 pin điện có thế là 0,48V.
(2) Năng lượng hóa học dự trữ trong các chất phản ứng chủ yếu được chuyển hóa thành năng lượng điện khi phản ứng xảy ra.
(3) Nồng độ của các ion tăng bởi vì Zn(s) nhường 2e.
(4) Sau một thời gian xảy ra phản ứng, thanh Zn(s) bị ăn mòn dần ở phần nhúng trong dung dịch do xảy ra phản ứng Zn(s) + Mn2+(aq) → Zn2+(aq) + Mn(s).
Có bao nhiêu phát biểu sai?
A. 1. B. 2. C. 4. D. 3.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 21 đến câu 26. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 21. Cho các phát biểu sau về hợp chất chứa nitrogen:
a) Tất cả các peptide đều có phản ứng màu biuret.
b) Từ ba amino acid: glycine, alanine, valine có thể tạo được tối đa 3 tripeptide chứa ba amino acid khác nhau, tạo phản ứng màu biuret.
c) Fibroin, một loại protein có trong tơ tằm, có cấu tạo: GAGAGSGAAG[SGAGAG]8Y thuộc loại protein phức tạp (G = glycine, A = alanine, S = serine, Y = tyrosine, đều là các α-amino acid).
d) Dipeptide X, khi phân tích X thu được phần trăm khối lượng của các nguyên tố như sau: %C = 41,10; %H = 6,85; %N = 19,18; còn lại là oxygen. Công thức cấu tạo của X có thể là Gly-Ala
hoặc Ala-Gly.
(Xem giải) Câu 22. Hợp chất E là thành phần của một số thuốc giảm đau, được điều chế từ alcohol X và carboxylic acid Y (biết Y là hợp chất tạp chức chứa vòng benzene). Thành phần về khối lượng các nguyên tố trong E như sau: 63,16%C; 5,26%H và 31,58%O. Phổ MS của E được cho như hình dưới đây:
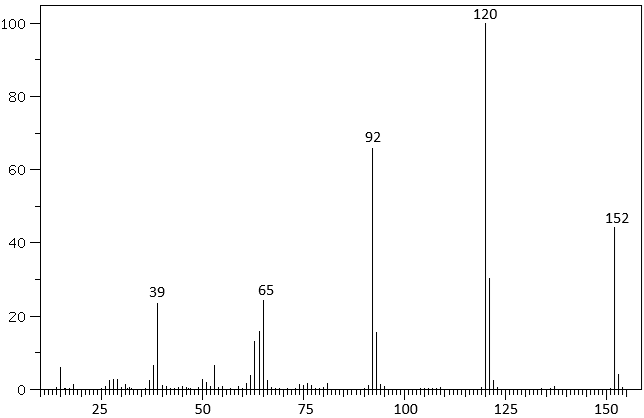
Phân tích E bằng phổ IR của E cho các peak đặc trưng sau:
| Liên kết | C=O | C-O | O-H |
| Số sóng cm-1 | 1750 – 1735 | 1300 – 1000 | 3650 – 3200 |
a) X là methyl alcohol.
b) Tổng số nguyên tử trong phân tử E là 20.
c) Y có nhóm -OCH3 và -COOH.
d) Nếu lấy 1 mol Y tác dụng NaOH thì số mol NaOH cần để phản ứng vừa đủ là 2 mol.
(Xem giải) Câu 23. Cho các quá trình diễn ra trong dung dịch:
Fe3+(aq) + 6H2O(l) → [Fe(OH2)6]3+ (I)
[Fe(OH2)6]3+(aq) + SCN-(aq) ⇋ [Fe(OH2)5(SCN)]2+(aq) + H2O(l) Kc = 1,4.10² (II)
[Fe(OH2)6]3+(aq) + F-(aq) ⇋ [Fe(OH2)5F]2+(aq) + H2O(l) Kc = 2,0.10⁵ (III)
Biết dung dịch [Fe(OH2)6]3+ có màu vàng nâu, dung dịch [Fe(OH2)5(SCN)]2+ có màu đỏ; dung dịch [Fe(OH2)5F]2+ và các anion SCN-, F- đều không có màu.
a) Quá trình (I) tạo phức chất aqua [Fe(OH2)6]3+.
b) So với anion F-, anion SCN- dễ thay thế phối tử H2O trong [Fe(OH2)6]3+ hơn.
c) Quá trình (II) nếu thêm F- dư vào dung dịch sẽ mất màu.
d) Fe3+ có cấu hình electron [Ar] 3d5, đa số phức chất của Fe3+ có cấu hình bát diện.
(Xem giải) Câu 24. Trong công nghiệp, một lượng lớn NaHCO3 và Na2CO3 được sản xuất theo phương pháp Solvay bằng cách cho khí CO2 (lấy từ nhiệt phân đá vôi) vào dung dịch chứa sodium chloride (NaCl) bão hoà và ammonia (NH3) bão hoà.
CO2(aq) + H2O(l) + NH3(aq) + NaCl(aq) → NH4Cl(aq) + NaHCO3(s) (1)
NaHCO3 tách ra đem nhiệt phân thu được soda:
2NaHCO3 → Na2CO3 + CO2 + H2O (2)
và NH4Cl được sử dụng để tái tạo NH3 bằng cách tác dụng với Ca(OH)2 tạo ra từ CaO.
2NH4Cl(aq) + CaO(s) → 2NH3(g) + CaCl2(aq) + H2O (3)
a) Khi làm lạnh, NaHCO3 kết tinh và được lọc ra khỏi hệ phản ứng.
b) Trong sản xuất, đun nóng hỗn hợp các chất tham gia phản ứng (1) để thu được Na2CO3 ngay.
c) Nguyên liệu chính của quá trình sản xuất soda bằng phương pháp Solvay là NaCl và CaCO3.
d) NaHCO3 được ứng dụng làm bột nở, làm giảm chứng đau dạ dày do thừa acid.
(Xem giải) Câu 25. Để tiến hành mạ một tấm huy chương hình trụ, đáy tròn với bán kính 2,5 cm; chiều cao hình trụ 0,3 cm; với lớp mạ bằng copper dày 0,1 cm như hình bên.
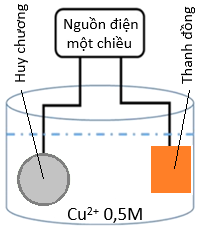
Người ta có thể tiến hành điện phân dung dịch X (CuSO4) nồng độ 0,5M, dư với cường độ dòng điện không đổi 2A, khi kết thúc điện phân (quá trình mạ hoàn thành) thì hết thời gian là t giây. Biết khối lượng riêng của copper là 8,95 g/cm³ và hiệu suất điện phân là 100%, giả thiết lớp mạ huy chương dày như nhau, toàn bộ lượng copper tạo ra đều bám hết vào tấm huy chương. Cho hằng số Faraday F = 96500, π = 3,14.
a) Thanh copper là cực dương, huy chương được mạ sẽ đóng vai trò cực âm.
b) Khi kết thúc điện phân bên điện cực anode thoát ra 8,193 lít (đkc).
c) Chiều dòng electron di chuyển từ huân chương được mạ qua dây dẫn đến thanh copper.
d) Thời gian điện phân 64800 giây.
(Xem giải) Câu 26. Ở áp suất 1 bar và nhiệt độ 25°C, cho các phương trình nhiệt hóa học sau:
½S(s) + ½O2(g) → ½SO2(g) ![]() = -148,45 kJ
= -148,45 kJ
C(s) + O2(g) → CO2(g) ![]() = -393,5 kJ
= -393,5 kJ
a) Enthalpy tạo thành chuẩn của sulfur dioxide bằng -296,9 kJ/mol.
b) Sulfur dioxide vừa là chất khử vừa là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia.
c) 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45 kJ năng lượng dưới dạng nhiệt.
d) Trung bình mỗi ngày một hộ gia đình dùng hết 1,8 kg than chứa 90% carbon và 1,2% sulfur về khối lượng, còn lại là các tạp chất trợ, tương đương với 12 số điện (1 số điện = 1 kWh = 3600 kJ).
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 27. Từ một loại quặng người ta tách ra được hợp chất vô cơ X chỉ có hai nguyên tố là Cu và S. Biết khối lượng phân tử (amu) của X là 160. Từ 3,2 gam X có thể tạo ra lượng tối đa là 2,56 gam Cu. Từ X người ra điều chế chất rắn copper (II) sulfate pentahydrate theo sơ đồ sau:
![]()
Từ 1,0 tấn nguyên liệu chứa 96% X về khối lượng (còn lại là tạp chất trơ) sẽ điều chế được m kg copper (II) sulfate pentahydrate. Biết hiệu suất cả quá trình là 85%. Tính m?
(Xem giải) Câu 28. Một trong các phương pháp dùng để loại bỏ sắt trong nguồn nước nhiễm sắt là sử dụng lượng vôi tôi vừa đủ để tăng pH của nước nhằm kết tủa ion sắt khi có mặt oxi, theo sơ đồ phản ứng:
(1) Fe3+ + OH- → Fe(OH)3
(2) Fe2+ + OH- + O2 + H2O → Fe(OH)3
Một mẫu nước có hàm lượng sắt cao gấp 28 lần so với ngưỡng cho phép quy định là 0,30 mg/l (theo QCVN01-1:2018/BYT). Giả thiết sắt trong mẫu nước trên chỉ tồn tại ở hai dạng là Fe3+ và Fe2+ với tỉ lệ mol Fe3+ : Fe2+ = 3 : 1. Cần tối thiểu bao nhiêu mol Ca(OH)2 để kết tủa hoàn toàn lượng sắt trong 8 m³ mẫu nước trên.
(Xem giải) Câu 29. Hiện nay, môi trường đang phải chứa đựng một lượng khổng lồ rác thải nhựa, bên cạnh việc nâng cao ý thức của con người, các nhà khoa học không ngừng tìm kiếm các giải pháp. Các nhà nghiên cứu Nhật Bản đã phát hiện một loại vi khuẩn có tên là Ideonella sakaiensis. Loại vi khuẩn này có khả năng phân hủy nhựa PET (polyethylene terephthalate) bằng cách xử lý sinh học. Tốc độ phân hủy sinh học của nhựa PET bởi vi khuẩn này là 0,12 mg/cm²/ngày.
Cho biết hạt nhựa dạng hình cầu rỗng; có đường kính 1,05 cm; khối lượng riêng là 1,45 g/cm³, lấy π = 3,14. Hãy tính số ngày cần thiết để vi khuẩn Ideonella sakaiensis phân hủy hết khối lượng của một hạt nhựa PET. (đáp án làm tròn đến hàng đơn vị)
(Xem giải) Câu 30. Một hợp chất T có công thức phân tử C28H38O19 được tạo ra bởi phản ứng giữa saccharose với acetic anhydride (điều kiện xúc tác đầy đủ), dùng làm chất nhũ hoá, chất kháng nấm trong các chế phẩm thuộc lĩnh vực dược phẩm, mĩ phẩm, chất phụ gia thực phẩm, chất chống cắn móng tay và mút ngón tay ở trẻ do tính chất rất đắng của nó. Cho các phát biểu sau về T:
(1) T hòa tan Cu(OH)2 ở điều kiện thường.
(2) Một mol T phản ứng tối đa với 6 mol NaOH.
(3) T không độc nên được sử dụng làm dược phẩm, mỹ phẩm.
(4) Theo phương pháp “Hoá học xanh”, người ta tiến hành ester hoá saccharose trong điều kiện chiếu xạ siêu âm, cho 10 gam saccharose phản ứng với 30 ml acetic anhydride (D = 1,08 g/ml) hiệu suất phản ứng là 75% thu được khối lượng của T (làm tròn đến hàng phần mười) là 14,9 gam.
Liệt kê các phát biểu đúng theo thứ tự từ bé đến lớn.

Tr oi mất giải roi😞