[2024 – 2025] Khảo sát HSG trường Hậu Lộc 3 – Thanh Hóa
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề 050-H12A năm 2024-2025
⇒ Thời gian làm bài: 90 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1D | 2D | 3B | 4C | 5C | 6C | 7B | 8C | 9D | 10C |
| 11D | 12D | 13B | 14D | 15B | 16C | 17A | 18D | 19A | 20A |
| Câu 21 | Câu 22 | Câu 23 | Câu 24 | Câu 25 | Câu 26 | |
| (a) | Đ | Đ | S | Đ | S | Đ |
| (b) | S | Đ | Đ | S | S | Đ |
| (c) | Đ | S | Đ | S | S | S |
| (d) | Đ | Đ | S | S | Đ | S |
| Câu 27 | Câu 28 | Câu 29 | Câu 30 | Câu 31 | Câu 32 |
| 13,85 | 5 | 5 | 1,3125 | 2076,5 | 22,24 |
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 20. Mỗi câu thí sinh chỉ chọn một phương án đúng
(Xem giải) Câu 1. Thực hiện phản ứng sau: CaCO3 + 2HCl → CaCl2 + CO2 + H2O. Theo dõi và ghi lại thể tích khí CO2 thoát ra theo thời gian, thu được đồ thị như sau (Thể tích khí đo được ở áp suất khí quyển và nhiệt độ phòng).
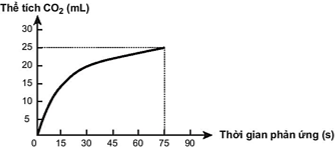
Trong các phát biểu sau, phát biểu nào không đúng?
A. Ở thời điểm 90 giây, tốc độ phản ứng bằng 0.
B. Khi phản ứng hóa học xảy ta, tốc độ phản ứng giảm dần theo thời gian.
C. Tốc độ trung bình của phản ứng trong khoảng thời gian từ thời điểm đầu đến 75 giây là 0,33 mL/s.
D. Tốc độ trung bình của phản ứng trong các khoảng thời gian 15 giây là như nhau.
(Xem giải) Câu 2. Ammonia là một hợp chất vô cơ có công thức phân tử NH3. Trong tự nhiên, ammonia sinh ra trong quá trình bài tiết và xác sinh vật thối rữa. Ammonia (NH3) nặng gần bằng nửa không khí. Sau khi nén và làm lạnh, nó biến thành chất lỏng giống như nước nhưng sôi ở nhiệt độ -33°C. Khi bị nén xong, NH3 dễ bay hơi. Ở điều kiện tiêu chuẩn, nó là một chất khí, không màu, có mùi khai, tan nhiều trong nước do hình thành liên kết hydro với phân tử nước. Trong dung dịch NH3 (hỗn hợp NH3 và H2O) tồn tại số loại liên kết hydrogen là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 3. Cho các phát biểu sau:
(a) Nitrogen monoxide được tạo thành khi mưa dông kèm theo sấm sét do phản ứng giữa nitrogen và oxygen trong không khí.
(b) Xét phản ứng tạo ra NO: N2(g) + O2(g) → 2NO(g) ![]() = 180,6 kJ
= 180,6 kJ
Nhiệt tạo thành chuẩn của NO(g) là -90,3 kJ/mol.
(c) Trong phần tử HNO3, nguyên tử N có cộng hoá trị bằng 4.
(d) Công thức Lewis của HNO3 cho thấy trong phân tử acid còn 6 cặp electron chưa liên kết.
(e) Hiện tượng phú dưỡng gây cản trở sự hấp thụ ánh sáng mặt trời vào nước, làm giảm sự quang hợp của thực vật thủy sinh.
Các phát biểu đúng là
A. (b); (c); (e). B. (a); (c); (e).
C. (a); (b); (d). D. (a); (b); (d); (e).
(Xem giải) Câu 4. Cho sulfur lần lượt phản ứng với mỗi chất sau (trong điều kiện thích hợp): H2, O2, Hg, H2SO4 loãng, Al, Fe, F2, HNO3 đặc nóng, H2SO4 đặc nóng. Số phản ứng chứng minh tính khử của sulfur là
A. 5. B. 2. C. 4. D. 3.
(Xem giải) Câu 5: Trong phản ứng dưới đây, cặp acid – base liên hợp là
H2PO4-(aq) + NH3(aq) ⇋ HPO42-(aq) + NH4+(aq)
A. H2PO4- và NH3. B. HPO42- và NH4+
C. H2PO4- và HPO42-. D. Không có cặp acid – base liên hợp.
(Xem giải) Câu 6: Cho các nhóm chức của các hợp chất hữu cơ và tên loại hợp chất như sau:
(1) -OH (2) -CHO (3) -COOH (4) -NH2
(a) aldehyde (b) alcohol (c) amine (d) carboxylic acid
Cách sắp xếp đúng của nhóm chức với tên loại hợp chất tương ứng là:
A. (1)-(a); (2)-(b); (3)-(c); (4)-(d). B. (1)-(b); (2)-(c); (3)-(a); (4)-(d).
C. (1)-(b); (2)-(a); (3)-(d); (4)-(c). D. (1)-(a); (2)-(c); (3)-(d); (4)-(b).
(Xem giải) Câu 7. Xylitol là chất tạo ngọt thiên nhiên, được dùng tạo vị ngọt cho kẹo cao su, là thực phẩm thân thiện với những người bị bệnh tiểu đường và các sản phẩm chăm sóc răng miệng. Thực nghiệm cho biết, công thức phân tử của xylitol là C5H12O5 phân tử có mạch carbon không phân nhanh và 1,52 gam xylitol tác dụng với Na dư, tạo ra xấp xỉ 619,7 mL khí H2 (đo ở điều kiện chuẩn 25°C, 1 bar). Công thức cấu tạo của xylitol là
A. CH2OH-CH2OH. B. CH2OH(CHOH)3CH2OH.
C. CH2OH(CHOH)4CH2OH. D. CH2OH(CHOH)CH2OH
(Xem giải) Câu 8. Hexylresorcinol được biết đến nhiều nhất với công dụng làm mờ thâm nám và làm đều màu da, ngoài ra còn đóng vai trò như một chất chống oxy hóa và một thành phần ổn định công thức mỹ phẩm. Khi phân tích thành phần nguyên tố trong hexylresorcinol cho kết quả phần trăm về khối lượng các nguyên tố C, H, O lần lượt là 74,227%; 9,278%; 16,495%. Bằng phương pháp phổ khối lượng (phổ MS) cho kết quả phân tử khối của hexylresorcinol là 194. Kết quả nghiên cứu cho biết 1 mol hexylresorcinol phản ứng được tối đa với 2 mol NaOH. Hãy cho biết hexylresorcinol là hợp chất hữu cơ thuộc loại nào sau đây?
A. Ester. B. Carboxylic acid. C. Phenol. D. Tạp chức.
(Xem giải) Câu 9: Mật ong để lâu hoặc ở nhiệt độ dưới 20°C và thấp hơn, thường thấy có những hạt rắn xuất hiện ở đây chai là hiện tượng gì? Biết trong mật ong chứa chủ yếu là đường glucose và frutose.
A. Nước trong mật ong bay hơi làm kết tinh tinh bột.
B. Mật ong bị oxi hóa chậm trong không khi tạo kết tủa.
C. Nước trong mật ong bay hơi làm kết tinh đường saccharose.
D. Nước trong mật ong bay hơi làm kết tinh đường glucose và fructose.
(Xem giải) Câu 10: Các phát biểu sau:
(a) Trong môi trường acid, glucose và fructose có thể chuyển hóa lẫn nhau.
(b) Có thể phân biệt glucose và fructose bằng phản ứng với dung dịch AgNO3 trong NH3.
(c) Glucose và fructose đều hòa tan Cu(OH)2 ở nhiệt độ thường cho dung dịch màu xanh lam.
(d) Fructose là hợp chất đa chức.
(e) Có thể điều chế ethyl alcohol từ glucose bằng phương pháp sinh hóa.
Số phát biểu đúng là
A. 3. B. 4. C. 2. D. 5.
(Xem giải) Câu 11. Hình vẽ bên mô tả thí nghiệm điều chế và thử tính chất của khí X:
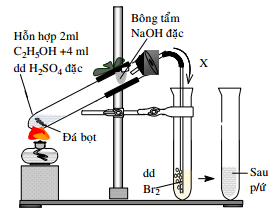
Cho các phát biểu về thí nghiệm trên như sau:
(a) Đá bọt được sử dụng có thành phần hóa học là CaCO3 tinh khiết.
(b) Thay dung dịch Br2 bằng dung dịch KMnO4 có kết tủa xuất hiện.
(c) Bông tẩm NaOH có tác dụng hấp thụ khí SO2 và CO2.
(d) Dung dịch Br2 bị nhạt màu dần.
(e) Khí X đi vào dung dịch Br2 là C2H4.
Số phát biểu đúng là
A. 1. B. 5. C. 2. D. 4.
(Xem giải) Câu 12: Cho các phát biểu sau:
(a) Đốt cháy hoàn toàn ester no, đơn chức, mạch hở luôn thu được số mol CO2 bằng số mol H2O.
(b) Trong hợp chất hữu cơ nhất thiết phải có carbon và hydrogen.
(c) Những hợp chất hữu cơ có thành phần nguyên tố giống nhau, thành phần phân tử hơn kém nhau một hay nhiều nhóm CH2 là đồng đẳng của nhau.
(d) Dung dịch glucose bị khử bởi AgNO3 trong NH3 tạo ra Ag.
(e) Saccharose chỉ có cấu tạo mạch vòng.
Số phát biểu đúng là
A. 5. B. 4. C. 3. D. 2.
(Xem giải) Câu 13: Công thức cấu tạo của peptide sau có tên là
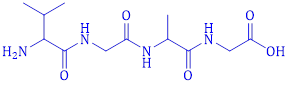
A. Val-Ala-Gly-Gly. B. Val-Gly-Ala-Gly.
C. Gly-Gly-Ala-Val. D. Val-Gly-Gly-Ala.
(Xem giải) Câu 14: Terephthalic acid (p-HOOCC6H4COOH) là nguyên liệu để sản xuất poly (ethylene terephthalate) (PET, một loại polymer quan trọng được sử dụng làm sợi dệt và chai nhựa,…). Hãy cho biết terephthalic acid được điều chế từ chất nào sau đây:
A. m-CH3-C6H4-CH3 B. o-CH3-C6H4-CH3
C. o-CH3-C6H4-CH=CH2 D. p-CH3-C6H4-CH3
(Xem giải) Câu 15: Cao su thiên nhiên không dẫn điện, không thấm nước và khí, có tính đàn hồi tốt. Tuy nhiên, cao su thiên nhiên dễ bị lão hoá dưới tác động của không khí, ánh sáng, nhiệt. Ngoài ra, tính đàn hồi của cao su chỉ tồn tại trong một khoảng nhiệt độ hẹp. Cao su lưu hóa (loại cao su được tạo thành khi cho cao su thiên nhiên tác dụng với sulfur) có khoảng 2,0% sulfur về khối lượng.
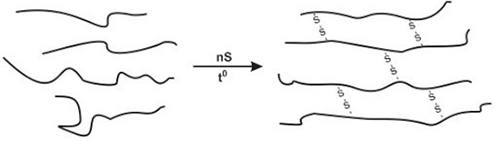
Cho các phát biểu sau:
a. Bản chất của quá trình lưu hóa cao su là phản ứng giữ nguyên mạch polymer, chủ yếu tạo cầu nối disulfide (-S-S-) giữa các phân tử polyisoprene tạo thành polymer có cấu tạo mạng lưới không gian.
b. Cứ khoảng 46 mắt xích isoprene có một cầu disulfide (-S-S-).
c. Để sản xuất cao su lưu hóa, có thể lưu hóa cao su thiên nhiên là polymer của isoprene có cấu hình trans.
d. Cao su đã được lưu hóa có các ưu điểm tốt hơn về độ đàn hồi, chống thấm khí, chống ẩm, bền với nhiệt và các tác nhân khác hơn với cao su thiên nhiên và cao su buna.
Số phát biểu đúng là:
A. 1. B. 2. C. 3. D. 4
(Xem giải) Câu 16. Một khối đồng kim loại hình trụ đường kính 5 cm, chiều dài 30 cm cần được mạ vàng với chiều dày lớp mạ 5,0 μm. Cho biết: cường độ dòng điện đi qua bể mạ là 3,0 A; dung dịch trong bể mạ là Au(NO3)3; hiệu suất điện phân là 100%; khối lượng riêng của Au bằng 19,3 g/cm³; hằng số Faraday F = 96500 C/mol. Thời gian cần để mạ khối kim loại trên gần nhất với (Cho biết nguyên tử khối của các nguyên tố: N = 14; O = 16; Au = 197)
A. 13,40 phút. B. 37,11 phút. C. 40,20 phút. D. 38,66 phút.
(Xem giải) Câu 17. Tiến hành điện phân dung dịch chứa 43,24 gam hỗn hợp gồm MSO4 và NaCl bằng điện cực trơ màng ngăn xốp với cường độ dòng điện không đổi. Sau thời gian t giây thì nước bắt đầu điện phân ở cả 2 điện cực, thấy khối lượng catot tăng so với ban đầu, đồng thời anot thoát ra một khí duy nhất có thể tích là 4,958 L (đkc). Nếu thời gian điện phân là 2t giây thì khối lượng dung dịch giảm 25,496 gam. Kim loại M là
A. Ni. B. Cu. C. Fe. D. Zn.
(Xem giải) Câu 18. Trong phương pháp phân tích nhiệt, một chất rắn khối lượng m1 được gia nhiệt, thu được chất rắn mới khối lượng m2 và chất khí hoặc hơi. Giản đồ phân tích nhiệt hình bên cho biết sự biến đối khối lượng của canxi oxalat ngậm nước CaC2O4.H2O trong môi trường khí trơ theo nhiệt độ:
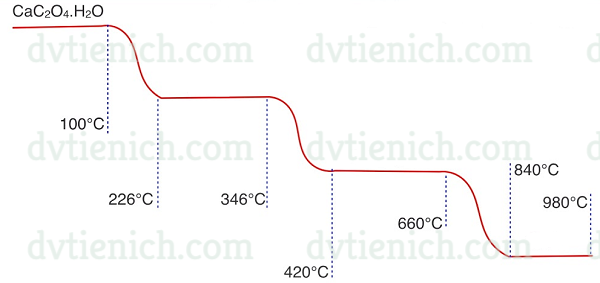
| Nhiệt độ | 226°C | 420°C | 840°C |
| Lượng m2 còn lại so với m1 | 87,7% | 68,5% | 38,4% |
Cho các phương trình hóa học (theo đúng tỷ lệ mol) ứng với ba giai đoạn phân ứng có kèm theo thay đổi khối lượng của các chất rắn như sau:
(1) CaC2O4.H2O (t°) → R1 + K1
(2) R1 (t°) → R2 + K2
(3) R2 (t°) → R3 + K3
Ký hiệu R cho các chất rắn, K cho các chất khí hoặc hơi. Trong các phát biểu sau, phát biểu nào đúng?
A. K2 là oxit axit.
B. R2 không tan trong axit.
C. R3 tan trong nước tạo môi trường trung tính.
D. K3 là chất khí nặng hơn không khí.
(Xem giải) Câu 19: Cho các chất hữu cơ X, Y, Z, T, E thỏa mãn các phương trình hóa học sau:
(1) C6H10O4 + 2NaOH (t°) → X + Y + Z
(2) X + NaOH (CaO, t°) → CH4 + Na2CO3
(3) Y + CuO (t°) → T + Cu + H2O
(4) T + 2AgNO3 + 3NH3 + H2O (t°) → CH3COONH4 + 2Ag + 2NH4NO3
(5) Z + HCl → M + NaCl
Cho các nhận định sau về M:
(1) M có khả năng phản ứng tối đa với Na theo tỉ lệ 1:2
(2) Dung dịch M làm quỳ tím hóa xanh
(3) M là hợp chất hữu cơ đa chức
(4) Trong 1 phân tử M có 2 nguyên tử O
Số nhận định đúng là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 20: Đồng hồ mạ vàng được làm từ thép không gỉ và được mạ một lớp vàng mỏng bên ngoài để tạo độ thẩm mỹ, sự sang trọng cho người dùng. Để mạ vàng cho chiếc đồng hồ, người ta dùng phương pháp điện phân dung dịch với cực dương tan.
Cho các phát biểu sau:
(1) Cathode được gắn với thanh kim loại gold (Au); anode là chiếc đồng hồ.
(2) Anode và cathode cùng đặt trong bình điện phân chứa dung dịch muối Au3+.
(3) Khi có dòng điện chạy qua, các ion Au3+ sẽ di chuyển về anode, bị khử thành Au và phủ lên bề mặt chiếc đồng hồ.
(4) Nồng độ ion Au3+ giảm dần theo thời gian điện phân.
(5) Trong qua trình điện phân, anode tan ra, khối lượng cathode tăng lên.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 5
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 21 đến câu 26. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 21: Ester X mạch hở có công thức phân tử C7H10O4. Từ X thực hiện các phản ứng sau:
(1) X + 2NaOH → X1 + X2 + X3
(2) X2 (LiAlH4) → X3
(3) X1 + H2SO4 → Y + Na2SO4
(4) 2Z + O2 → 2X2
Biết các phản ứng xảy ra theo đúng tỉ lệ mol. Phát biểu nào sau đây là sai?
a) Đun nóng X3 với H2SO4 đặc (170°C), thu được chất Z.
b) Trong Y có số nguyên tử carbon bằng số nguyên tử hydrogen.
c) X có mạch carbon không phân nhánh.
d) X3 có nhiệt độ sao cao hơn X2.
(Xem giải) Câu 22. Một số loại thực vật chỉ phát triển tốt ở môi trường có pH phù hợp, việc nghiên cứu pH của đất rất quan trọng trong nông nghiệp. Một số loại cây trồng phù hợp với đất có giá trị pH cho trong bảng sau:
| Cây trồng | pH thích hợp | Cây trồng | pH thích hợp |
| Bắp | 5,7 – 7,5 | Cây chè | 4,5 – 5,5 |
| Cà chua | 6,0 – 7,0 | Thanh long | 4,0 – 6,0 |
| Cải thảo | 6,5 – 7,0 | Lúa | 5,5 – 6,5 |
| Hành tây | 6,4 – 7,9 | Mía | 5,0 – 8,0 |
Một học sinh làm thí nghiệm xác định độ pH của đất như sau: Lấy một lượng đất cho vào nước rồi lọc lấy phần dung dịch. Dùng máy pH đo được giá trị pH là 4,52. Cho các phát biểu sau:
a) Vùng đất trên phù hợp trồng cây chè và thanh long.
b) Loại đất trên bị nhiễm chua, để trồng hành tây, cà chua, mía phát triển tốt ta cần khử chua cho đất bằng cách rắc vôi bột (chứa chủ yếu CaO) hoặc bón tro thực vật (tro đốt rơm rạ).
c) Để cây cải thảo và hành tây phát triển tốt, ta cần bón nhiều đạm hai lá (NH4NO3) qua nhiều vụ liên tiếp để đất có giá trị pH phù hợp.
d) Để cải tạo đất cằn cỗi thì một biện pháp hữu hiệu là sử dụng phân bón hữu cơ như phân chuồng, phân trùn quế.
(Xem giải) Câu 23: Thí nghiệm: Phản ứng thế bromine vào hexane
Dụng cụ: Ống nghiệm, ống hút nhỏ giọt, kẹp gỗ, giá để ống nghiệm.
Hóa chất: Hexane, nước bromine.
Tiến hành:
• Bước 1: Lấy 2 ống nghiệm, dùng ống hút nhỏ giọt cho vào mỗi ống nghiệm khoảng 2 mL nước bromine.
• Bước 2 : Dùng ống hút nhỏ giọt nhỏ tiếp khoảng 2 mL hexane vào cả hai ống nghiệm, lắc đều. Sau đó đưa ống nghiệm (1) ra nơi có ánh sáng mặt trời (hoặc ngâm trong cốc nước nóng khoảng 50°C). Ống (2) để nguyên trong phòng tối.
Quan sát hiện tượng xảy ra ở hai ống nghiệm. Các phát biểu dưới đây là đúng hay sai?
a) Sau bước 1: các ống nghiệm có hai lớp, lớp dưới là bromine màu vàng, lớp trên là hexane không màu.
b) Sau bước 2: Ống nghiệm (1) nhạt màu dần đến mất màu; ống nghiệm (2) tách thành hai lớp.
c) Ống 1 xảy ra phương trình hoá học: Br2 + C6H14 → C6H13Br + HBr.
d) Phản ứng trên chứng tỏ alkane dễ dàng phản ứng nước bromine ngay ở điều kiện thường.
(Xem giải) Câu 24: Cho sơ đồ chuyển hóa sau:
![]()
Biết X là glutamic acid, Y, Z, T là các chất hữu cơ chứa nitrogen.
a) Công thức phân tử của glutamic acid là C5H9NO4.
b) Công thức phân tử của Y là C8H16O4NCI.
c) 1 mol Z tác dụng tối đa được với 1 mol NaOH thu được T.
d) T có công thức cấu tạo thu gọn là: ClH3NC3H5(COONa)2.
(Xem giải) Câu 25: Để tách lấy lượng phân bón KCl người ta thường tách KCl khỏi quặng sylvinite, thành phần chính của quãng là NaCl, KCl. Vì NaCl và KCl có nhiều tính chất tương tự nhau nên người ta không dùng phương pháp hóa học để tách chúng. Thực tế người ta dựa vào độ tan (S) khác nhau trong nước theo nhiệt độ để tách hai chất này.
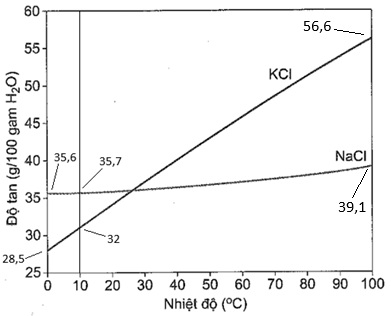
Bước 1: Hòa tại một lượng quặng sylvinite được nghiền nhỏ vào 1000 gam nước ở 100°C, lọc bỏ phần không tan thu được dung dịch bão hòa.
Bước 2: Làm lạnh dung dịch bão hòa đến 0°C (lượng nước không đổi) thấy tách ra m1 gam chất rắn.
Bước 3: Tiếp tục cho m1 gam chất rắn này vào 100 gam H2O ở 10°C, khuấy đều thì tách ra m2 gam chất rắn không tan.
Nhận định nào sau đây đúng:
a) Giá trị m1 = 281 gam.
b) Trong chất rắn m2 vẫn còn một lượng nhỏ muối NaCl.
c) Sau bước 2 đã tách được hoàn toàn KCl ra khỏi hỗn hợp.
d) Giá trị m2 = 249 gam.
(Xem giải) Câu 26: Cho hai hiện tượng sau:
(1) Trong môi trường acid, diệp lục có màu vàng đến đỏ còn trong môi trường kiềm, diệp lục có màu xanh.
(2) “Ợ nóng” là cảm giác đau rát ở thực quản gây ra do sự gia tăng nồng độ hydrochloric acid (HCl) trong dạ dày.
Trên thực tế, nước bọt có chứa ion bicarbonate (HCO3-). Trong y học, dược phẩm “sữa magie” có thành phần (magnesium hydroxide lơ lửng trong nước) được dùng làm thuốc để chữa bệnh khó tiêu, ợ chua.
Hãy cho biết những phát biểu sau là đúng hay sai?
a) Khi vắt chanh hoặc nhỏ giấm ăn vào nước luộc rau muống thì màu xanh của nước lại bị nhạt đi.
b) Khi bị ợ nóng nhẹ, cách đơn giản nhất để triệu chứng này là nuốt nước bọt nhiều lần.
c) Khi luộc bánh chưng, cho thêm một chút muối sinh lí sẽ làm lá dong gói bánh có màu xanh đẹp hơn.
d) “Sữa magie” là dạng dung dịch của Mg(OH)2 với nước có thể làm thuốc kháng acid để giảm nồng độ H+ trong thực quản hiệu quả hơn nước bọt
PHẦN III: Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 27 đến câu 32.
(Xem giải) Câu 27: Cho 1,344 lít O2 phản ứng hết với m gam hỗn hợp X gồm K, Na và Ba thu được chất rắn Y có chứa các kim loại còn dư và các oxit kim loại. Hòa tan Y vào nước dư, thu được 200 ml dung dịch Z và 0,672 lít khí H2. Cho 100 ml dung dịch H2SO4 a (mol/l) vào Z thì thu được 300 ml dung dịch có pH = 1 và 11,65 gam kết tủa; Mặt khác, hấp thụ 6,048 lít khí CO2 vào 200 ml dung dịch Z, thấy thu được dung dịch T chứa 24,38 gam chất tan. Các thể tích khí ở đktc, các phản ứng xảy ra hoàn toàn, coi H2SO4 điện li hoàn toàn hai nấc Giá trị m là?
(Xem giải) Câu 28: Thực hiện các thí nghiệm sau:
(1) Điện phân dung dịch NaCl bằng điện cực trơ, không có màng ngăn xốp.
(2) Cho BaO vào dung dịch CuSO4.
(3) Nhiệt phân AgNO3.
(4) Điện phân hỗn hợp nóng chảy của Al2O3 và Na3AlF6.
(5) Cho dung dịch FeCl2 vào dung dịch AgNO3 (dư).
(6) Cho Mg vào dung dịch FeCl3 (dư).
(7) Cho Na vào dung dịch CuSO4 (dư).
Số thí nghiệm thu được đơn chất là?
(Xem giải) Câu 29. Thí nghiệm thủy phân bromoethane trong dung dịch được thực hiện như sau:
Bước 1: Lấy khoảng 2 mL bromoethane cho vào ống nghiệm, thêm tiếp khoảng 3 mL nước cất và lắc mạnh. Để ổn định, sau đó tách bỏ lớp chất lỏng phần trên. Lặp lại 2 lần, kiểm tra chất phần lỏng ở trên bằng dung dịch AgNO3 đến khi không còn vết vẩn đục.
Bước 2: Thêm tiếp khoảng 1 mL dung dịch NaOH, đun nóng nhẹ và lắc đều ống nghiệm trong khoảng 2 phút.
Bước 3: Để nguội hỗn hợp, acid hóa dung dịch sau phản ứng bằng vài giọt HNO3. Bước 4: Nhỏ vài giọt dung dịch AgNO3 vào ống nghiệm, xuất hiện kết tủa vàng nhạt.
Cho các phát biểu sau:
(1) Ở bước 4, kết tủa màu vàng nhạt là AgBr sinh ra từ phản ứng giữa bromoethane và dung dịch AgNO3.
(2) Ở bước 1, mục đích tách bỏ lớp chất lỏng ở trên để rửa ion Br- để không làm sai lệch kết quả thí nghiệm.
(3) Ở bước 2, có thể thay dung dịch NaOH bằng dung dịch KOH.
(4) Ở bước 3, có thể thay dung dịch HNO3 bằng dung dịch HCl hoặc dung dịch H2SO4.
(5) Sản phẩm hữu cơ thu được ở bước 2 có công thức cấu tạo là CH3OH
(6) Ở bước 1, lớp chất lỏng ở trên gồm nước và ion Br- và lớp chất lỏng ở dưới là bromoethane.
(7) Ở bước 3, mục đích thêm dung dịch HNO3 vào để trung hòa lượng NaOH còn dư.
(8) Ở bước 1, dung dịch AgNO3 thêm vào để kiểm tra nước còn ion Br- hay không.
Số phát biểu đúng là?
(Xem giải) Câu 30. Một người ngủ quên trong ô tô tắt máy, đóng kín cửa. Sau một thời gian, khi hàm lượng oxygen trong xe giảm xuống còn 16% thể tích không khí thì có người kịp thời phát hiện, phá vỡ kính xe để đưa đi cấp cứu. Tại thời điểm được cứu, tốc độ “phản ứng hô hấp” (v hô hấp = k.C(O2)) của người trong xe giảm bao nhiêu lần so với bình thường? Biết ban đầu oxygen chiếm 21% thể tích không khí.
(Xem giải) Câu 31: Các nhiên liệu hóa thạch có nhiều mức sulfur khác nhau (0,05- 6,0% với dầu thô, 0,5 -3% với than và khoảng 10 ppm với khí thiên nhiên, về khối lượng). Dù đã trải qua quá trình loại bỏ sulfur khỏi các nhiên liệu hóa thạch nhưng cặn sulfur còn lại (tối đa là 10 ppm sulfur trong xăng và dầu diesel theo tiêu chuẩn Châu Âu V) vẫn gây ra nhiều vấn đề vì sản phẩm cháy của nó là SO2, là chất làm ô nhiễm không khí chính. Người ta đã ước tính tổng mức tiêu thụ năng lượng toàn cầu hàng năm 4,8.10²² J, trong đó 30,6% đến từ các sản phẩm dầu. Hãy tính lượng SO2 (theo nghìn tấn) sinh ra từ các sản phẩm dầu. Giả sử rằng thành phần chính các sản phẩm dầu là octane (C8H18) và hàm lượng sulfur là 10 ppm. Đồng thời giả sử rằng 90% năng lượng từ sự đốt cháy hoàn toàn octane đã được sử dụng. Biết 1ppm = 10^-6, một số giá trị năng lượng liên kết (E, tính theo kJ/mol) dưới đây:
| Liên kết | H-H | C-H | C-C | C=O (CO2) | O=O | H-O |
| E | 436 | 414 | 347 | 799 | 498 | 464 |
(Xem giải) Câu 32: Hòa tan hoàn toàn 7,2 gam FeO bằng một lượng vừa đủ dung dịch H2SO4 nồng độ 24,5% thu được dung dịch X. Làm lạnh dung dịch X xuống đến 50°C thì tách ra được m gam chất rắn (FeSO4.7H2O). Dung dịch còn lại có nồng độ 12,18%. Giá trị của m là?


Bình luận