[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Bình Phước
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề 025-H12C năm 2024-2025
⇒ Thời gian làm bài: 120 phút
Câu 1. (2,0 điểm)
(Xem giải) 1.1. (1,0 điểm) Viết công thức Lewis, công thức cấu tạo của H2S, CO2.
(Xem giải) 1.2. (1,0 điểm) Nguyên tử của nguyên tố R có cấu hình electron lớp ngoài cùng là ns²np⁴. Trong hợp chất khí của R với hydrogen, nguyên tố R chiếm 94,12% khối lượng.
a) Xác định R và viết công thức oxide ứng với hoá trị cao nhất của R.
b) Tính phần trăm khối lượng của R trong oxide cao nhất.
Câu 2. (2,0 điểm)
(Xem giải) 2.1. (1,0 điểm) Xét phản ứng oxi hóa tripalmitin:
(C15H31COO)3C3H5(s) + 72,5O2(g) → 51CO2(g) + 49H2O(l) ![]() = -31604,0 kJ
= -31604,0 kJ
Cho nhiệt tạo thành chuẩn của CO2(g) và H2O(l) lần lượt là -393,5 kJ/mol và -285,8 kJ/mol.
a) Tính nhiệt tạo thành chuẩn của tripalmitin ở thể rắn.
b) Tính năng lượng (kJ) tối đa cung cấp bởi 1 gam chất béo tripalmitin ở thể rắn khi bị oxi hóa hoàn toàn.
(Xem giải) 2.2. (1,0 điểm) Thời gian cần để hoà tan hết một mẫu CaCO3 trong dung dịch HCl được biểu diễn ở bảng sau:
| Nhiệt độ (°C) | 20 | 40 | 55 |
| Thời gian (phút) | 27 | 3 | t |
Câu 3. (2,0 điểm)
(Xem giải) 3.1. (1,0 điểm) N2O4 (không màu) bị phân hủy thành NO2 (màu nâu đỏ) theo phương trình: N2O4(g) ⇋ 2NO2(g)
Ban đầu, trong bình phản ứng dung tích không đổi 1,2 lít có chứa 0,72 mol N2O4. Khi cân bằng nồng độ N2O4 ở các nhiệt độ khác nhau như sau:
| Nhiệt độ | Nồng độ N2O4 trạng thái cân bằng (mol/L) |
| 0°C | 0,45 |
| 20°C | 0,25 |
a) Khi tăng nhiệt độ, màu sắc hỗn hợp khí trong bình thay đổi như thế nào? Giải thích?
b) Tính hằng số cân bằng Kc của phản ứng ở 20°C.
(Xem giải) 3.2.(1,0 điểm) Trộn lẫn 7 mL dung dịch NH3 1M với 3 mL dung dịch HCl 1M thu được dung dịch A.
a) Tính pH của dung dịch A
b) Thêm 0,001 mol NaOH vào dung dịch A thu được dung dịch B (coi thể tích dung dịch B bằng thể tích dung dịch A). Xác định pH của dung dịch B. Biết NH3 + H2O ⇋ NH4+ + OH- có hằng số cân bằng 1,8.10^-5.
Câu 4. (2,0 điểm)
(Xem giải) 4.1. (1,0 điểm) Có thể tạo thành một hệ pin đơn giản từ các điện cực đồng và kẽm nối với nhau bằng dây dẫn cắm vào một quả chanh. Phương trình nửa phản ứng ở:
+ Điện cực đồng là: 2H+(aq) + 2e → H2(g).
+ Điện cực kẽm là: Zn(s) → Zn2+(aq) + 2e.
Phương trình ion tổng khi pin hoạt động là: 2H+(aq) + Zn(s) → Zn2+(aq) + H2(g).
a) Trong pin này, điện cực nào là cathode và điện cực nào là anode?
b) Khi sử dụng một quả chanh già, khô quắt thì pin không hoạt động được. Giải thích tại sao?
(Xem giải) 4.2. (1,0 điểm) Chuẩn độ dung dịch H2C2O4 bằng dung dịch KMnO4.
• Bước 1: Rót dung dịch KMnO4 0,002M vào burete (tối màu), điều chỉnh đến vạch ‘0’.
• Bước 2: Dùng pipete lấy 10 mL dung dịch mẫu chứa H2C2O4 (nồng độ C₀) cho vào bình định mức, sau đó cho tiếp nước cất đến vạch định mức 100 ml (lắc đều). Lấy 10 mL dung dịch từ bình định mức cho vào bình tam giác, cho thêm 5 mL dung dịch HClO4 (dùng dư so với lượng phản ứng), rồi cho thêm nước cất đến khoảng 25mL.
• Bước 3: Tiến hành chuẩn độ: Cho từ từ dung dịch KMnO4 0,002M từ burete vào bình tam giác đã chứa hỗn hợp H2C2O4 và HClO4 ở bước 2 và lắc đều cho đến khi dung dịch chuyển sang màu hồng (bền trong 30s) thì dừng chuẩn độ.
Lặp lại thí nghiệm trên thêm 2 lần nữa, kết quả ghi nhận được thể tích dung dịch KMnO4 0,002M như sau:
| Thí nghiệm | 1 | 2 | 3 |
| V(KMnO4 0,002M) | 11,5 mL | 11,8 mL | 11,7 mL |
a) Cân bằng phương trình chuẩn độ sau: MnO4- + H2C2O4 + H+ → CO2 + H2O + Mn2+
b) Tính nồng độ C₀ (mol/l) của dung dịch H2C2O4 ban đầu.
Câu 5 (2,0 điểm)
(Xem giải) 5.1. (1,0 điểm) Phân tích nhiệt trọng là kỹ thuật phân tích để xác định thành phần các chất rắn bị phân hủy khi đun nóng. Sự thay đổi khối lượng được đo trong quá trình đun nóng sẽ cung cấp các thông tin về thành phần của chất ban đầu. Đun nóng 4,96 gam hỗn hợp CaC2O4 và MgC2O4 đến 1200°C, trong quá trình này khối lượng hỗn hợp chất rắn được đo liên tục. Biết rằng có 2 phản ứng phân hủy xảy ra ở khoảng 400°C: MgC2O4 → MgO + CO + CO2; CaC2O4 → CaCO3 + CO
Ở 900°C quan sát được phản ứng phân hủy thứ 3.
a) Viết phương trình phản ứng phân hủy thứ 3.
b) Khi các phản ứng xảy ra hoàn toàn thu được 2,008 gam chất rắn. Tính phần trăm khối lượng mỗi chất trong 4,96 gam hỗn hợp.
(Xem giải) 5.2. (1,0 điểm) Quá trình sản xuất Cu từ Cu5FeS4 bằng phương pháp hỏa luyện kim thường diễn ra qua các giai đoạn sau:
(1) Đun nóng Cu5FeS4 trong oxygen tạo ra Cu2S, Fe3O4 và SO2.
(2) Cho Fe3O4 phản ứng với CO và một hợp chất X chứa hai nguyên tố (X gồm phi kim M và oxygen, trong đó có 53,25% khối lượng oxygen) có nhiệt độ nóng chảy cao, thu được hợp chất Y (Y chứa 31,41 %O và 54,81 %Fe về khối lượng và phi kim M) và CO2. Trong pha lỏng, hợp chất Y không trộn lẫn được với Cu2S, do đó nhanh chóng bị tách ra dưới dạng xỉ.
(3) Đun nóng Cu2S với oxygen để chuyển hoá một phần thành Cu2O.
(4) Khi Cu2S và Cu2O đạt tỉ lệ hợp thức sẽ phản ứng với nhau, tạo thành Cu và SO2.
a) Xác định công thức phân tử của X, Y.
b) Viết các phương trình phản ứng tương ứng với các giai đoạn từ (1) đến (4).
Câu 6. (2,0 điểm)
(Xem giải) 6.1. (1,0 điểm): So sánh nhiệt độ sôi của các hợp chất hữu cơ sau và giải thích.
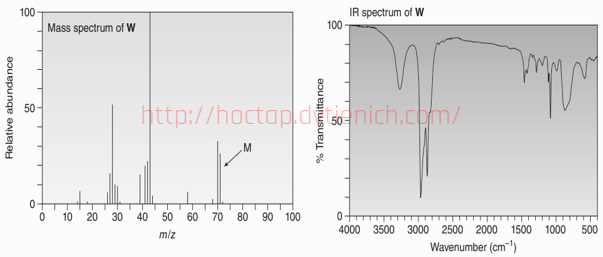
(Xem giải) 6.2. (1,0 điểm): Phản ứng của BrCH2CH2CH2CH2NH2 với NaH sinh ra chất W, có phổ IR và khối phổ như hình bên dưới. Lập luận đề xuất công thức cấu tạo của W.
Bảng tín hiệu phổ hồng ngoại một số liên kết cơ bản
| Liên kết | Số sóng (cm-1) |
| O – H | 3600 – 3300 |
| C – H | 3000 – 2700 |
| C = O | 1700 – 1750 |
| C = C | 1600 – 1680 |
| N – H | 3500 – 3300 |
Câu 7. (2,0 điểm)
(Xem giải) 7.1. (1,0 điểm): Cho hydrocarbon Y có chứa vòng benzene và có công thức phân tử C8H6.
Viết các phương trình phản ứng xảy ra (nếu có) khi cho Y tác dụng lần lượt với:
– Dung dịch KMnO4 (trong môi trường H2SO4).
– Dung dịch AgNO3/NH3.
– H2O (xúc tác HgSO4/H+, t°).
– HBr theo tỉ lệ 1 : 2.
(Xem giải) 7.2. (1,0 điểm): Ngô và mía là hai nguyên liệu chính được sử dụng trong sản xuất ethanol. Tuy nhiên chúng là những loại cây lương thực quan trọng, trong khi cellulose cũng có thể sản xuất ethanol, nhưng cellulose là nguồn nguyên liệu dồi dào, dễ tìm. Tuy giá thành sản xuất ethanol từ cellulose còn cao, xuất phát từ loại nấm được nuôi cấy để tạo cellulase là enzyme xúc tác cho phản ứng thuỷ phân cellulose thành glucose còn tốn kém nhiều về năng lượng, nhưng hướng đi này đang hứa hẹn nhiều viễn cảnh mới ở tương lai.
a) Viết phương trình hoá học của các phản ứng điều chế ethanol từ cellulose.
b) Hiện tại, 1 tấn nguyên liệu cellulose khô tạo ra khoảng 240 lít ethanol. Tính hiệu suất của quá trình điều chế. Cho khối lượng riêng của ethanol là 0,79 g/mL.
Câu 8. (2,0 điểm)
(Xem giải) 8.1. (1,0 điểm): Methyl butanoate có mùi thơm của trái cây nên thường được sử dụng trong công nghiệp sản xuất bánh kẹo, nước giải khát…Trong phòng thí nghiệm, methyl butanoate được tổng hợp bằng cách đun nóng hỗn hợp gồm methanol, butanoic acid và sulfuric acid đặc trong bình cầu chịu nhiệt ở điều kiện thích hợp. Sau một thời gian thu được hỗn hợp E gồm alcohol, acid, ester và nước. Biết một số tính chất vật lí của các chất trong hỗn hợp E như sau:
| Chất | Khối lượng riêng ở 25°C (g.mL-1) | Độ tan ở 25°C (g/100g nước) | Nhiệt độ sôi (°C) |
| H2O | 1,00 | 100 | |
| CH3OH | 0,79 | tan vô hạn | 78 |
| CH3CH2CH2COOH | 0,96 | tan vô hạn | 163,5 |
| CH3CH2CH2COOCH3 | 0,89 | 1,4 | 102 |
a) Để yên bình cầu một thời gian, hỗn hợp bị phân thành 2 lớp. Hãy cho biết thành phần các chất trong mỗi lớp?
b) Để tách methyl butanoate ra khỏi hỗn hợp E, sử dụng phương pháp chiết hay phương pháp chưng cất sẽ phù hợp hơn? Vì sao?
(Xem giải) 8.2. (1,0 điểm): Tiến hành thí nghiệm sau: cho hỗn hợp A gồm benzoic acid và phenol vào dung dịch NaHCO3 dư, lắc kỹ một thời gian, sau đó để yên rồi tách riêng phần dung dịch và chất không tan. Cho phần dung dịch vào phễu chiết, thêm dung dịch HCl dư, làm lạnh hỗn hợp, thêm tiếp hexane vào và lắc đều. Để yên phễu chiết để hỗn hợp phân thành 2 lớp.
a) Viết các phương trình hóa học đã xảy ra.
b) Trong thí nghiệm trên, có thể thay NaHCO3 bằng Na2CO3 được không? Vì sao?
Câu 9. (2,0 điểm)
(Xem giải) 9.1. (1,0 điểm): Một thí nghiệm được mô tả như hình bên dưới.
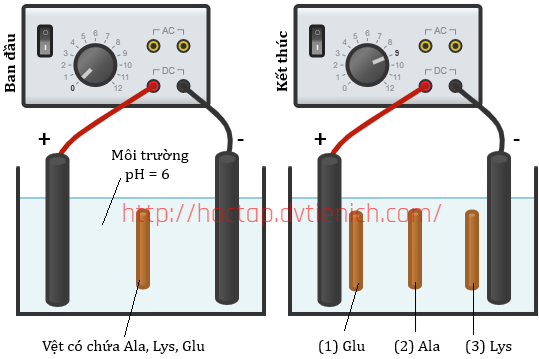
Hãy cho biết các vệt được đánh dấu (1), (2), (3) tồn tại chủ yếu ở dạng cation, anion hay ion lưỡng cực? Vì sao?
(Xem giải) 9.2. (1,0 điểm): Rutin là hợp chất hữu cơ có trong nụ hoa hòe, có tác dụng làm giảm các chứng suy giảm tĩnh mạch, giảm cholesterol trong máu. Ngoài ra rutin còn được dùng để điều chế thuốc quercetin có tác dụng chống oxy hóa mạnh, kháng viêm, chống dị ứng, ngăn ngừa tế bào ung thư. Công thức cấu tạo của rutin (trái) và quercetin (phải) cho ở hình dưới đây:
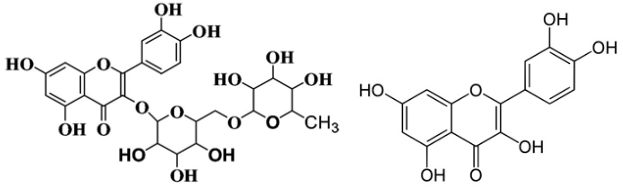
Trong môi trường acid, một phân tử rutin phản ứng với hai phân tử nước thu được sản phẩm gồm quercetin, glucose và rhamnose.
a) Xác định công thức phân tử của rhamnose.
b) Biết hàm lượng quercetin trong một viên thuốc có khối lượng 500 mg là 96,64% về khối lượng, phần còn lại là tá dược khác. Để sản xuất 1 triệu viên thuốc trên, cần bao nhiêu kg bột hoa hòe? (Biết hàm lượng rutin trong bột hoa hòe là 30,20%, phần còn lại không tạo ra quercetin; hiệu suất toàn bộ quá trình sản xuất đạt 80%).
Câu 10. (2,0 điểm):
(Xem giải) 10.1. (1,0 điểm): Trước khi tiêm cho các bệnh nhân thường dùng cồn 70° xoa lên da để sát trùng chỗ tiêm mà không dùng cồn 90° hoặc cồn nồng độ thấp. Dùng cơ sở hóa học giải thích việc làm này.
(Xem giải) 10.2. (1,0 điểm): Có những vật liệu bằng Fe được tráng Sn hoặc tráng Zn. Nếu trên bề mặt của những vật đó có vết sây sát sâu tới lớp Fe bên trong. Hãy cho biết:
a) Hiện tượng gì xảy ra khi để những vật đó trong không khí ẩm.
b) Trình bày cơ chế ăn mòn với những vật trên.

Bình luận