[2024 – 2025] Thi học sinh giỏi lớp 12 tỉnh Nam Định
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề 061-H12A năm 2024-2025
⇒ Thời gian làm bài: 90 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1B | 2D | 3D | 4C | 5B | 6D | 7D | 8B | 9B | 10C |
| 11A | 12B | 13A | 14C | 15B | 16D | 17B | 18D | 19C | 20A |
| 21C | 22A | 23D | 24B | 25B | 26C | 27B | 28C | 29B | 30A |
| 31 | 32 | 33 | 34 | 35 | 2 | 40 | 39 | ||
| (a) | Đ | S | S | Đ | 36 | 126 | 41 | 181 | |
| (b) | Đ | Đ | Đ | S | 37 | 2314 | 42 | 5,00 | |
| (c) | S | S | Đ | S | 38 | 11,2 | 43 | 14 | |
| (d) | Đ | Đ | S | Đ | 39 | 558 | 44 | 5 |
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 30. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Cho các nguyên tố X, Y, T, R cùng một chu kỳ và thuộc nhóm A trong bảng tuần hoàn hóa học. Bán kính nguyên tử của các nguyên tố được biểu diễn như hình vẽ sau:
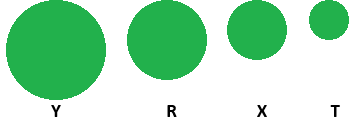
Nguyên tố có độ âm điện lớn nhất là
A. Y. B. T. C. X. D. R.
(Xem giải) Câu 2. Biết những chất lỏng có điểm chớp cháy thấp hơn 37,8°C là chất lỏng dễ cháy. Cho bảng số liệu về điểm chớp cháy của một số chất lỏng sau:
| Chất | Pentane | Ethanol | Formic acid | Ethylen glycol |
| Điểm chớp cháy | -49 | 13 | 50 | 111 |
Nhận định nào sau đây không đúng?
A. Trong số các chất trên, pentane có khả năng gây cháy, nổ cao nhất.
B. Trong số các chất trên, ethylene glycol có khả năng gây cháy, nổ thấp nhất.
C. Pentane có điểm chớp cháy thấp hơn ethanol nên dễ bốc cháy hơn.
D. Trong số các chất trên, có một chất lỏng dễ cháy.
(Xem giải) Câu 3. Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do NaH có khả năng giải phóng hydrogen. Trong sodium hydride, trạng thái oxi hoá của hydrogen là
A. -2. B. +2. C. +1. D. -1.
(Xem giải) Câu 4. Năng lượng hóa học của một số phản ứng được mô tả bằng các sơ đồ dưới đây

Số phản ứng tỏa nhiệt là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 5. Tiến hành pha loãng dung dịch HCl 0,6M bằng nước theo bảng sau:
| Hóa chất | Cốc 1 | Cốc 2 | Cốc 3 | Cốc 4 |
| Dung dịch HCl 0,6M (mL) | 50 | 60 | 40 | 30 |
| Nước cất (mL) | 10 | 20 | 15 | 5 |
Rót đồng thời 10 mL dung dịch Na2CO3 0,1M vào các cốc. Tốc độ khí thoát ra ở cốc nào là lớn nhất?
A. Cốc 2. B. Cốc 4. C. Cốc 3. D. Cốc 1.
(Xem giải) Câu 6. Cặp chất nào sau đây có thể phân biệt bằng phản ứng tạo iodoform?
A. CH3CHO và CH3COCH3. B. CH3CHO và C2H5COCH3.
C. CH3OCH3 và C2H5COC2H5. D. CH3CHO và C2H5COC2H5.
(Xem giải) Câu 7. X là isopropyl formate là một ester có trong cà phê Arabica; chất Y có công thức phân tử C4H6O4; biết rằng Y được tạo thành từ các chất alcohol bền và carboxylic acid đều chỉ có một loại nhóm chức. Cho các phát biểu sau:
(1) Công thức cấu tạo của X là HCOOCH(CH3)2.
(2) Có 3 đồng phân ester khác cùng công thức phân tử với X.
(3) Chất Y có 3 công thức cấu tạo phù hợp.
(4) X và Y thuộc cùng dãy đồng đẳng ester no, mạch hở.
Số phát biểu đúng là
A. 3. B. 1. C. 4. D. 2.
(Xem giải) Câu 8. Saccharose và maltose đều tham gia phản ứng nào sau đây?
A. Phản ứng với thuốc thử Tollens. B. Phản ứng thuỷ phân trong môi trường acid.
C. Phản ứng với dung dịch nước bromine. D. Phản ứng với Cu(OH)2 tạo kết tủa đỏ gạch.
(Xem giải) Câu 9. Aspartame (APM) là một chất làm ngọt nhân tạo, còn được gọi là đường hóa học không chứa đường saccharide, có độ ngọt gấp 200 lần đường ăn thông thường. APM có chứa năng lượng tương đương saccarose (khoảng 17 kJ/g), tuy nhiên chỉ cần một lượng rất nhỏ APM đã tạo ra độ ngọt cần thiết, do đó năng lượng chúng ta đưa vào cơ thể sẽ không đáng kể. Công thức cấu tạo của APM cho như hình bên
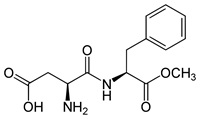
Cho các phát biểu sau:
(a) Công thức phân tử của APM là C14H18N2O5.
(b) APM là ester của methanol với dipeptide tạo bởi acid bởi aspartic acid (HOOCCH(NH2)CH2COOH) và phenylalanine (C6H5CH2CH(NH2)COOH).
(c) APM bền trong môi trường axit nhưng kém bền trong môi trường kiềm.
(d) 1 mol APM phản ứng được tối đa với 2 mol NaOH trong dung dịch.
(e) APM có khả năng làm mất màu nước bromine do có phản ứng cộng bromine vào vòng benzene.
Số phát biểu đúng là
A. 4. B. 2. C. 3. D. 1.
(Xem giải) Câu 10. Trong số các polymer sau:
(1) (-NH[CH2]6NHCO[CH2]4CO-)n; (2) (-NH[CH2]5CO-)n;
(3) (-NH[CH2]6CO-)n ; (4) [C6H7O2(OOCCH3)3]n;
(5) (-CH2-CH2-)n; (6) (-CH2-CH=CH-CH2-)n.
Polymer được dùng để sản xuất tơ là
A. (3), (4), (1), (6). B. (1), (2), (6). C. (1), (2), (3), (4). D. (1), (2), (3).
(Xem giải) Câu 11. Một phương pháp xử lí nước thải chứa các cation kim loại nặng bằng cách điện phân dung dịch nước thải (pH ≤ 5, mật độ dòng điện khoảng 10mA/cm²) để tạo ra các chất kết tủa tại khu vực điện cực. Hãy cho biết quá trình kết tủa này xảy ra ở khu vực điện cực nào trong điện phân?
A. tại cathode. B. tại bề mặt dung dịch. C. cả anode và cathode. D. tại anode.
(Xem giải) Câu 12. Trong định nghĩa về liên kết kim loại: “Liên kết kim loại là liên kết hình thành do lực hút tĩnh điện giữa các electron…(1)… với các ion…(2)… kim loại ở các nút mạng.
Các từ cần điền vào vị trí (1), (2) là
A. ngoài cùng, dương B. tự do, dương. C. hóa trị, lưỡng cực. D. hóa trị, âm.
(Xem giải) Câu 13. Amine X có phân tử khối nhỏ hơn 80. Trong phân tử X, nitrogen chiếm 19,18% về khối lượng. Cho X tác dụng với nitrous acid (HNO2) ở nhiệt độ thường thu được alcohol và giải phóng khí. Số công thức cấu tạo thỏa mãn X là
A. 4. B. 8. C. 3. D. 2.
(Xem giải) Câu 14. Liệu pháp điều trị bằng rượu thuốc là một phương pháp hết sức độc đáo của y học cổ truyền đã có lịch sử hàng nghìn năm; được ứng dụng trong phòng bệnh, điều trị bệnh và bồi bổ sức khỏe. Rượu thuốc là sự kết hợp giữa thuốc, bài thuốc y học cổ truyền và rượu. Người ta tiến hành ngâm các loại thuốc y học cổ truyền vào trong rượu; các hợp chất quý có tác dụng chữa bệnh có trong vị thuốc sẽ hòa tan vào trong rượu và dung dịch rượu sau khi ngâm thuốc sẽ được sử dụng như thuốc xoa bóp hoặc thuốc uống. Phương pháp ngâm rượu thuốc là ứng dụng của
A. phương pháp chiết lỏng – lỏng. B. phương pháp chưng cất.
C. phương pháp chiết lỏng – rắn. D. phương pháp kết tinh.
(Xem giải) Câu 15. Phương pháp nấu rượu truyền thống bằng cách lên men tinh bột vẫn được nhiều người dân sử dụng từ xưa đến nay. Tinh bột sau khi thủy phân, lên men thì được đem chưng cất để thu lấy ethanol. Trong quá trình chưng cất, chất lỏng ban đầu thu được có vị rất nồng, sau đó nhạt dần và cuối cùng có vị chua. Để đảm bảo chất lượng, khi chưng cất người ta thường bỏ đi khoảng 100 – 200 mL chất lỏng chảy ra đầu tiên. Cho các phát biểu sau:
(a) Hỗn hợp đem chưng cất chỉ có C2H5OH, H2O.
(b) Sau khi lên men tinh bột để chuyển hoá thành rượu, người ta dùng phương pháp chưng cất lôi cuốn hơi nước để thu được ethanol.
(c) Bỏ đi khoảng 100 – 200 mL chất lỏng chảy ra đầu tiên là để loại bỏ chất độc như CH3CHO.
(d) Để có được rượu 45° phải tiến hành thêm 20mL nước vào 60 mL rượu 60°. Biết khối lượng riêng của ethanol d = 0,8 gam/mL. Coi thể tích dung dịch thay đổi không đáng kể.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 16. Phát biểu nào sau đây là không đúng?
A. Trong tự nhiên, không tồn tại đơn chất halogen.
B. Tính oxi hoá của đơn chất halogen giảm dần từ F2 đến I2.
C. Khí chlorine ẩm và nước chlorine đều có tính tẩy màu.
D. Trong công nghiệp có thể điều chế Cl2 bằng cách dùng F2 để oxi hoá ion Cl- trong dung dịch NaCl.
(Xem giải) Câu 17. Chất nào sau đây là chất điện li yếu?
A. CH3COONH4. B. CH3COOH. C. HCl. D. HClO4.
(Xem giải) Câu 18. Hiện nay người ta không sản xuất ammonia từ nitrogen và hydrogen tinh khiết mà tiến hành sự chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí thiên nhiên (có thành phần chính là methane).
Phản ứng điều chế hydrogen: CH4 + 2H2O → CO2 + 4H2. (1)
Phản ứng khử oxygen để thu nitrogen trong không khí: CH4 + 2O2 → CO2 + 2H2O. (2)
Phản ứng tổng hợp ammonia: N2(g + 3H2(g) ⇋ 2NH3g) (3)
Để sản xuất 0,5 tấn khí ammonia cần lấy 420,85 m3 không khí (chứa 21,03% O2; 78,02% N2; còn lại là khí hiếm). Hỏi cần phải lấy bao nhiêu m³ khí methane để có đủ lượng nitrogen và hydrogen theo tỉ lệ 1 : 3 về thể tích dùng cho phản ứng tổng hợp ammonia. Giả thiết phản ứng (1) và (2) đều xảy ra hoàn toàn và các thể tích khí đo ở cùng điều kiện.
A. 492,5. B. 328,5. C. 404,0. D. 290,5.
(Xem giải) Câu 19. Phương trình hoá học thuỷ phân 2-bromo-2-methylpropane trong NaOH là
(CH3)3CBr + NaOH → (CH3)3COH + NaBr
Phản ứng trên diễn ra theo 2 giai đoạn được mô tả như sau:
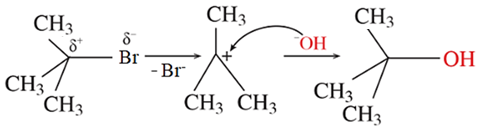
Nhận định nào sau đây đúng?
A. Phản ứng thuỷ phân 2-bromo-2-methylpropane là phản ứng tách hydrogen halide.
B. Trong giai đoạn (1) do độ âm điện C lớn hơn Br nên liên kết phân cực về phía Br.
C. Trong giai đoạn (2) có sự hình thành liên kết σ.
D. Sản phẩm thu được sau phản ứng thủy phân là alcohol bậc IV.
(Xem giải) Câu 20. Một loại xăng là hỗn hợp lỏng gồm 4 alkane và nhiệt độ sôi tương ứng như sau:
| Alkane | Hexane | Heptane | Octane | Nonane |
| Nhiệt độ sôi (°C) | 68,7 | 98,4 | 125,7 | 150,8 |
| % số mol | 10 | 20 | 60 | 10 |
| Nhiệt đốt cháy (kcal/mol) | – 47,52 | – 53,63 | – 59,74 | -65,84 |
Cho các phát biểu sau: (Làm tròn kết quả đến hàng phần trăm)
(a) Điều kiện thường, 4 alkane đều ở trạng thái lỏng.
(b) Có thể tách các chất trong hỗn hợp bằng phương pháp chưng cất.
(c) Thể tích CO2 thoát ra khi đốt cháy hoàn toàn 2 kg loại xăng trên ở điều kiện chuẩn là 3,48 m³.
(d) Nhiệt tỏa ra khi đốt cháy của loại xăng trên là 527,38 kcal/kg.
Số phát biểu đúng là
A. 4. B. 2. C. 3. D. 1.
(Xem giải) Câu 21. Hợp chất hữu cơ X (mạch carbon không phân nhánh) chứa 3 nguyên tố C, H, O. Kết quả phân tích nguyên tố của hợp chất hữu cơ X có chứa 64,61% carbon, 10,77% hydrogen, 24,62% oxygen về khối lượng. Người ta đã tiến hành phân tích nguyên tố và đo phổ khối lượng của X, thu được giá trị m/z của peak ion phân tử [M+] bằng 130. Cho biết phổ hồng ngoại của X như hình vẽ:

Bảng số sóng hấp thụ đặc trưng trên phổ hồng ngoại của một số nhóm chức
| Hợp chất | Liên kết | Số sóng | Hợp chất | Liên kết | Số sóng |
| Alcohol | O-H | 3500-3200 | Carboxylic acid | C=O | 1760-1690 |
| Aldehyde | C-H | 2830-2695 | O-H | 3300-2500 | |
| C=O | 1740-1685 | Ester | C=O | 1750-1715 | |
| Ketone | C=O | 1715-1666 | C-O | 1300-1000 |
Cho các phát biểu sau:
(a) X có công thức phân tử là C7H14O2.
(b) Tổng số liên kết xích ma (σ) và liên kết pi (π) trong một phân tử X là 23.
(c) X hòa tan trong nước tốt hơn acetic acid.
(d) X vừa tác dụng được với dung dịch KOH, vừa tác dụng được với Na2CO3.
Số phát biểu đúng là
A. 4. B. 2. C. 3. D. 1.
(Xem giải) Câu 22. Một loại chất béo có chứa tristearin, tripalmitin, stearic acid, palmitic acid. Thành phần phần trăm về khối lượng và hiệu suất phản ứng của các chất khi xà phòng hóa chất béo này bằng dung dịch NaOH được thể hiện trong bảng sau:
| Thành phần | Tristearin | Tripalmitin | Stearic acid | Palmitic acid | Tạp chất |
| Phần trăm khối lượng | 53,4% | 32,24% | 1,136% | 1,536% | 11,688% |
| Hiệu suất phản ứng với NaOH | 90% | 88% | 100% | 100% | 0% |
Một nhà máy cần sản xuất 30000 bánh xà phòng, khối lượng tịnh của mỗi bánh xà phòng là 90 gam (chứa 72% khối lượng muối sodium của các acid béo) bằng cách xà phòng hóa x kg chất béo nói trên với dung dịch NaOH. Biết trong quá trình đóng gói, lượng xà phòng bị hao hụt 4%. Giá trị của x là
A. 2475. B. 2578,2. C. 3437,4. D. 3299,8
(Xem giải) Câu 23. Cho phản ứng tổng quát tổng hợp polymer sau:
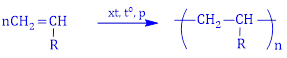
Cho các phát biểu sau:
(a) Polymer trên được tổng hợp theo phương pháp trùng hợp.
(b) Khi -R lần lượt là các gốc -H, -CH3, -Cl, -C6H5 (phenyl), các polymer dùng làm chất dẻo tương ứng lần lượt là polyethylene, polypropylene, poly(vinyl chloride), poly(phenol formaldehyde).
(c) Khi -R là gốc -CN (cyanide), polymer tạo thành gọi là tơ nitron (olon) để dệt vải may quần áo ấm, bện thành len đan áo rét, vải bạt,…
(d) Khi gốc -R là -OCOCH3 thì phản ứng thủy phân polymer tương ứng trong dung dịch NaOH là phản ứng cắt mạch polymer.
Số phát biểu đúng là
A. 3. B. 1. C. 4. D. 2.
(Xem giải) Câu 24. Để mạ đồng một vật dụng kim loại có tổng diện tích bề mặt là 10 cm², lớp mạ có độ dày đồng nhất 0,1 mm người ta tiến hành điện phân dung dịch CuSO4 với cực âm là vật dụng cần mạ và cực dương là lá đồng thô. Biết cường độ dòng điện không đổi là 2 A, hiệu suất điện phân là 90%, khối lượng riêng của tinh thể Cu là 8,94 g/cm³ và lượng đồng tạo ra được tính theo công thức Faraday là m = A.I.t/nF (với A là nguyên tử khối của Cu = 64; I là cường độ dòng điện, F là hằng số Faraday = 96485 C/mol, n là số electron mà 1 ion Cu2+ nhận, t là thời gian điện phân tính bằng giây). Coi nước bay hơi không đáng kể trong quá trình điện phân. Cho các phát biểu sau:
(a) Nồng độ mol của ion Cu2+ trong dung dịch giảm dần trong quá trình điện phân.
(b) Thời gian điện phân t = 25 phút. (Làm tròn kết quả đến hàng đơn vị).
(c) Khi kết thúc điện phân bên điện cực anode thoát ra 0,173 lít (ở điều kiện chuẩn). (Làm tròn kết quả đến hàng phần trăm).
(d) Trong quá trình mạ điện trên, cathode là vật dụng cần mạ và anode là lá đồng thô.
Số phát biểu đúng là:
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 25. Sulfuric acid là một trong những hoá chất quan trọng nhất được sử dụng trong công nghiệp; được sản xuất hàng trăm triệu tấn mỗi năm, chiếm nhiều nhất trong ngành công nghiệp hoá chất. Phương pháp sản xuất sulfuric acid phổ biến nhất là phương pháp tiếp xúc, theo đó acid có thể được điều chế qua các giai đoạn sau:
(1) FeS2(s) + O2(g) → Fe2O3(s) + SO2(g)
(2) SO2(g) + O2(s) ⇋ SO3(g)  = -196 kJ
= -196 kJ
(3) H2SO4(aq) + SO3(g) → H2SO4.nSO3(l)
(4) H2SO4.nSO3(l) + H2O(l) → H2SO4(aq)
Cho các phát biểu sau:
(a) Trong quá trình sản xuất H2SO4, giai đoạn (1) có nguy cơ cao gây ô nhiễm môi trường.
(b) Nhiệt độ phù hợp thực hiện phản ứng khoảng 450°C, khi giảm nhiệt độ cân bằng chuyển dịch theo chiều thuận, nhưng nhiệt độ càng hạ thấp thì tốc độ phản ứng càng chậm.
(c) Có thể dùng nước hấp thụ SO3 tạo sulfuric acid đặc có nồng độ cao, thuận tiện hơn cho việc vận chuyển và rút ngắn giai đoạn ở phản ứng (3) và (4).
(d) Cho 0,015 mol một loại hợp chất oleum vào nước thu được 200 mL dung dịch X. Để trung hoà 100 mL dung dịch X cần dùng 200 mL dung dịch NaOH 0,15 M. Phần trăm về khối lượng của nguyên tố sulfur trong oleum trên là 37,21%.(Làm tròn kết quả đến hàng phần trăm).
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 26. Cho phản ứng đốt cháy propane và butane theo sơ đồ sau:
C3H8 (g) + O2 (g) → CO2 (g) + H2O (g)
C4H10 (g) + O2 (g) → CO2 (g) + H2O (g)
Biết năng lượng liên kết trong các hợp chất là:
| Liên kết | C-C | C-H | O=O | C=O | O-H |
| Phân tử | C3H8, C4H10 | C3H8, C4H10 | O2 | CO2 | H2O |
| Eb (kJ/mol) | 346 | 418 | 495 | 799 | 467 |
Giả thiết mỗi ấm nước chứa 0,9 lít nước ở 25°C, nhiệt dung của nước là 4,2 J/g.K, có 20% nhiệt đốt cháy bị thất thoát ra ngoài môi trường. Một loại gas dân dụng chứa 12 kg khí hoá lỏng có tỉ lệ mol propane : butane là 2 : 3 có thể đun sôi bao nhiêu ấm nước? (Nhiệt dung riêng là nhiệt lượng cần cung cấp để 1 gam chất tăng lên 1 độ). Khối lượng riêng của nước là 1 g/mL (Làm tròn kết quả đến hàng đơn vị).
A. 770. B. 866. C. 1540. D. 385.
(Xem giải) Câu 27. Một loại gương soi có diện tích bề mặt là 0,4 m². Để tráng được 216 chiếc gương trên với độ dày lớp bạc được tráng là 0,2 μm thì cần dùng m gam glucose tác dụng với lượng dư dung dịch AgNO3 trong NH3. Biết hiệu suất phản ứng tráng bạc là 80% và khối lượng riêng của bạc là 10,49 g/cm³. Giá trị của m là
A. 234,43. B. 188,82. C. 152,51. D. 453,46.
(Xem giải) Câu 28. Cho sơ đồ chuyển hóa:
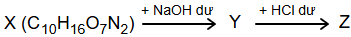
Biết X là dipeptide của một α-amino acid T có cấu tạo mạch carbon không phân nhánh; Y và Z là các hợp chất hữu cơ; mỗi mũi tên ứng với một phương trình hóa học của phản ứng giữa hai chất tương ứng.
Cho các phát biểu sau:
(a) Ở điều kiện thường, chất T dễ tan trong nước và có nhiệt độ nóng chảy cao.
(b) 1 mol X tác dụng tối đa với 2 mol NaOH.
(c) X là hợp chất hữu cơ tạp chức.
(d) Phần trăm khối lượng của oxygen trong phân tử chất Z chiếm 28,13%. (Làm tròn kết quả đến hàng phần trăm).
(e) Có thể dùng quỳ tím để phân biệt 3 dung dịch: dung dịch T, dung dịch Y, dung dịch glycine.
Số phát biểu đúng là
A. 1. B. 2. C. 3 D. 4.
(Xem giải) Câu 29. Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: acetylene, ethanal, ethanol, acetic acid. Nhiệt độ sôi của chúng được ghi lại trong bảng sau:
| Chất | X | Y | Z | T |
| Nhiệt độ sôi (°C) | 21 | 78,3 | -75 | 118 |
Cho các phát biểu sau:
(a) Chất Z có khả năng tham gia phản ứng tráng bạc với thuốc thử Tollens.
(b) Chất T hòa tan được Cu(OH)2 ở nhiệt độ thường.
(c) Phản ứng giữa chất Y và chất T (xúc tác) được gọi là phản ứng ester hóa. Sản phẩm H2O trong phản ứng có nguồn gốc từ nguyên tử H của chất T và nhóm OH của chất Y.
(d) Chất Y, T có nhiệt độ sôi cao hơn 2 chất còn lại do có liên kết hydrogen giữa các phân tử với nhau.
(e) Từ Y hoặc Z đều có thể tạo ra X bằng 1 phản ứng; từ X hoặc Y đều có thể tạo ra T bằng 1 phản ứng.
Số phát biểu đúng là
A. 2. B. 3. C. 5. D. 4.
(Xem giải) Câu 30. Xét quá trình hoạt động của một pin điện hoá Cu – Ag được thiết lập ở các điều kiện như hình vẽ.
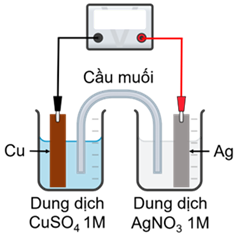
Cho thế điện cực chuẩn của các cặp Cu2+/Cu và Ag+/Ag lần lượt là +0,340 V và +0,799 V. Cho các phát biểu sau:
(a) Giá trị sức điện động chuẩn của pin điện hoá trên là 0,459 V.
(b) Ở anode xảy ra quá trình oxi hoá Cu, ở cathode xảy ra quá trình khử Ag+.
(c) Điện cực Cu giảm khối lượng, điện cực Ag tăng khối lượng.
(d) Phản ứng hoá học xảy ra trong pin: Cu + 2Ag+ → Cu2+ + 2Ag.
(e) Chiều dòng điện là chiều từ lá Cu sang lá Ag.
(g) Vai trò của cầu muối là cân bằng điện tích của các ion trong hai dung dịch.
Số phát biểu đúng là
A. 5. B. 4. C. 3. D. 6.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 31 đến câu 34. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 31. Aspirin là một hợp chất được sử dụng làm giảm đau, hạ sốt được điều chế theo sơ đồ sau:
(CH3CO)2O + HOC6H4COOH → CH3COOC6H4COOH + CH3COOH
Khi uống aspirin, phản ứng thủy phân trong môi trường acid tạo ra salicylic acid. Salicylic acid ức chế quá trình sinh tổng hợp prostaglandin (chất gây đau, sốt và viêm khi nồng độ trong máu cao hơn mức bình thường). Hiện nay có nhiều nghiên cứu tập trung vào phản ứng thủy phân này và các yếu tố ảnh hưởng đến tốc độ phản ứng. Dữ liệu về quá trình thủy phân của một mẫu aspirin trong nước (môi trường trung tính) ở 37°C thể hiện trong bảng:
| Thời gian (giờ) | 20 | 40 | 50 | 100 | |
| Nồng độ aspirin (M) | 5,55.10^-3 | 5,15.10^-3 | 4,78.10^-3 | 4,61.10^-3 | 3,83.10^-3 |
a. Tốc độ trung bình của phản ứng thủy phân aspirin trong thời gian 20 giờ đầu là 2,000.10^-5 (mol/L.giờ)
b. Tốc độ trung bình của phản ứng thủy phân aspirin giảm dần theo thời gian.
c. 1 mol aspirin phản ứng tối đa với 2 mol NaOH.
d. Để sản xuất 2700000 viên nén uống (hàm lượng aspirin 500 mg/viên) cần tối thiểu 1,725 tấn salicylic acid với hiệu suất phản ứng tính theo salicylic acid là 60%.
(Xem giải) Câu 32. Một nhóm học sinh nghiên cứu khoa học, khảo sát sự ảnh hưởng của pH môi trường đến khả năng hoạt động của enzyme trong quá trình tiêu hóa ở người. Một trong số thí nghiệm, nhóm học sinh đã khảo sát sự thủy phân albumin (protein có trong lòng trắng trứng) bằng enzyme pepsin được trình bày dưới bảng sau:
| Ống nghiệm | Thành phần | Thời điểm t = 0 (phút) | Thời điểm t = 20 (phút) |
| 1 | Albumin + Pepsin + HCl 0,01 M | Đục | Trong |
| 2 | Albumin + Pepsin + H2O | Đục | Đục |
| 3 | Albumin + Pepsin + NaHCO3 0,01 M | Đục | Đục |
Tiến hành thí nghiệm tương tự đối với chymotrypsin (một loại enzyme), thu được đồ thị sau:
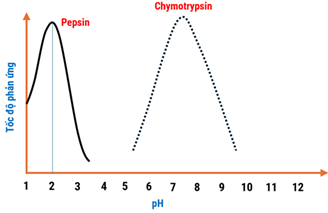
Cho các phát biểu sau:
a. Albumin là protein dạng sợi, không tan trong nước nên ban đầu dung dịch bị đục.
b. Pepsin hoạt động tốt nhất ở pH = 2.
c. Từ kết quả thí nghiệm thì enzyme pepsin và chymotrypsin đều hoạt động tốt trong môi trường acid.
d. Ở ống nghiệm 3, nếu thay Pepsin thành Chymotrypsin thì hiện tượng quan sát được là “từ đục thành trong” sau thí nghiệm.
(Xem giải) Câu 33. Sodium chloride được dùng trong chế biến và bảo quản thực phẩm, làm nguyên liệu chính của quy trình công nghiệp chlorine – kiềm. Công đoạn chính của công nghiệp chlorine – kiềm là điện phân dung dịch sodium chloride bão hòa trong bể điện phân có màng ngăn xốp. Phương trình hóa học của phản ứng điện phân dung dịch NaCl bão hòa trong bể điện phân có màng ngăn như sau:
2NaCl (aq) + 2H2O (l) → 2NaOH (aq) + H2 (g) + Cl2 (g)
a. Khí thoát ra ở anode là H2. Khí thoát ra ở cathode là Cl2.
b. Dung dịch NaOH thu được sau điện phân còn lẫn NaCl, cô đặc NaCl tan ít hơn so với NaOH nên kết tinh trước và được tách ra khỏi dung dịch.
c. Nếu bỏ màng ngăn xốp thì dung dịch thu được sau điện phân có tính tẩy màu.
d. Trong trường hợp không có màng ngăn, khi điện phân hoàn toàn dung dịch chứa 300 kg dung dịch NaCl bão hòa ở 25°C thì thu được dung dịch chứa NaClO 17%. (Biết độ tan của NaCl ở nhiệt độ này là 36,2 gam, coi nước bay hơi không đáng kể. Làm tròn kết quả đến hàng đơn vị).
(Xem giải) Câu 34. Cho cân bằng hoá học và sơ đồ tổng hợp ammonia:
N2(g) + 3H2(g) ⇋ 2NH3(g) ΔrH = -92 kJ
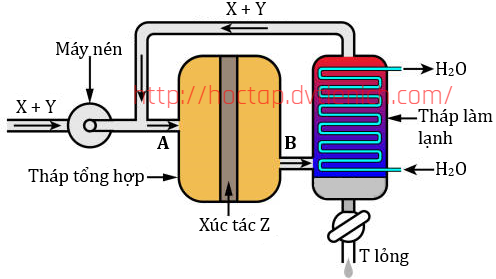
a. Bộ phận nén có vai trò tăng áp suất của hệ phản ứng trong tháp phản ứng lên đến gần 200 bar để cân bằng phản ứng tổng hợp ammonia chuyển dịch theo chiều thuận (chiều tạo ammonia).
b. Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch còn hằng số cân bằng không thay đổi
c. Nhiệt độ sôi của T thấp hơn so với X và Y nên tại tháp làm lạnh toàn bộ khí T sẽ hóa lỏng sau đó tách ra, còn X và Y vẫn ở trạng thái khí và thực hiện vòng tuần hoàn mới.
d. Nếu thể tích chất X và chất Y lấy ban đầu lần lượt bằng 3,7185 m³ và 1,2395 m³ thì sau phản ứng thể tích chất T thu được là 0,4958 m³ (các khí đo ở điều kiện chuẩn). Hiệu suất phản ứng tổng hợp ammonia bằng 20%. Biết ở điều kiện thường Y khá trơ.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 35 đến câu 44.
(Xem giải) Câu 35. Có bao nhiêu chất có thể sử dụng làm thành phần chủ yếu của xà phòng: CH3[CH2]14COONa (1), CH3[CH2]10CH2OSO3Na (2), CH3[CH2]11C6H4SO3Na (3), CH3[CH2]16COOK (4), (C17H33COO)3C3H5 (5), CH3CH(CH3)CH2COONa (6)?
(Xem giải) Câu 36. Liệt kê các thí nghiệm xảy ra phản ứng oxi hóa – khử theo số thứ tự tăng dần: (ví dụ: 234,…)
(1) Glucose phản ứng thuốc thử Tollens.
(2) Glucose phản ứng với nước bromine.
(3) Glucose phản ứng với methanol khi có mặt HCl khan xúc tác.
(4) Saccharose phản ứng với copper(II) hydroxide trong môi trường kiềm ở điều kiện thường.
(5) Cellulose phản ứng với HNO3 đặc có mặt H2SO4 đặc, đun nóng.
(6) Glucose phản ứng với copper(II) hydroxide và NaOH đun nóng.
(Xem giải) Câu 37. Arginine là một trong những amino acid thiết yếu đối với cơ thể con người. Với mỗi môi trường có giá trị pH tương ứng, coi Arginine chỉ tồn tại ở dạng cho dưới đây:
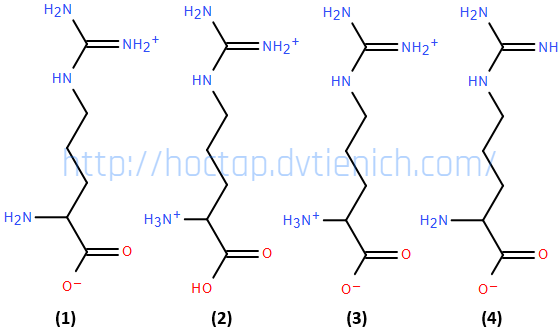
Hãy sắp xếp theo chiều tăng dần pH của các dạng tồn tại đó? (ví dụ: 1234 hoặc 4321,…)
(Xem giải) Câu 38. Chlorinated poly(vinyl chloride) (CPVC) có tính năng tương tự PVC, nhưng khả năng chịu nhiệt cao hơn, chống cháy tốt hơn và chịu được áp suất cao hơn. Người ta điều chế CPVC bằng cách cho khí chlorine đi vào dung dịch PVC trong tetrachloroethane ở 50°C – 100°C. Từ 9 tấn PVC thu được bao nhiêu tấn CPVC? Giả thiết CPVC thu được chứa 67,62% chlorine theo khối lượng và hiệu suất phản ứng đạt 95% (Làm tròn kết quả đến hàng phần chục).
(Xem giải) Câu 39. Hàn hóa nhiệt xảy ra theo nguyên lí hoạt động là sử dụng phản ứng nhiệt nhôm để sinh nhiệt làm nóng chảy kim loại trong một khuôn kín. Để hàn một chân vịt tàu thủy được làm bằng đồng bị một vết nứt có thể tích 35 cm³ người ta cần dùng một hỗn hợp X chứa Al và CuO theo tỉ lệ mol tương ứng 2 : 3. Giả thiết toàn bộ lượng đồng sinh ra đều được dùng để hàn, khối lượng riêng của đồng là 8,96 g/cm³, hiệu suất của phản ứng là 86%. Khối lượng hỗn hợp X cần dùng là bao nhiêu gam? (Làm tròn kết quả đến hàng đơn vị).
(Xem giải) Câu 40. Glucose là chất dinh dưỡng có giá trị đối với con người. Trong giai đoạn đường phân ở tế bào chất, một phân tử glucose bị chuyển hóa thành hai phân tử piruvic acid (C3H4O3); piruvic acid có thể bị khử để tạo ra acid X1. Khi nghiên cứu cấu trúc bằng phương pháp phổ 1HNMR, người ta thấy phân tử X1 có hai nhóm hydroxyl và một nhóm methyl. Khi đun nóng X1 với sulfuric acid đặc sẽ thu được chất X2, sau đó X2 chuyển thành hợp chất X3. Kết quả phân tích phổ IR cho thấy trong phân tử X2 vẫn còn nhóm hydroxyl, nhưng trong phân từ X3 thì không còn nhóm hydroxyl nào. Kết quả phân tích phổ MS cho biết phân tử khối của X3 là 144. Tổng số nguyên tử trong 2 phân tử X2 và X3 là bao nhiêu?
(Xem giải) Câu 41. Tinh dầu chuối được sản xuất nhiều trong thực tế dựa trên phản ứng giữa acetic acid và isoamyl alcohol có xúc tác sulfuric acid đậm đặc. Để giảm giá thành sản xuất người ta cho isoamyl alcohol 98% tác dụng với acetic acid bằng 96% với xúc tác acid H2SO4 đặc 100%. Tuy nhiên nếu thực hiện phản ứng theo tỷ lệ mol 1 : 1 thì hiệu suất phản ứng chỉ đạt 60%. Để tăng hiệu suất lên trong cùng điều kiện thì người ta phải tăng lượng acetic acid lên. Vậy để đạt hiệu suất 80% (tính theo alcohol) thì người ta phải dùng m kg acetic acid với 110 kg alcohol ở trên. Giá trị của m bằng bao nhiêu kg? (Làm tròn kết quả đến hàng đơn vị).
(Xem giải) Câu 42. Trong công nghiệp, giấm ăn được sản xuất bằng phương pháp lên men theo sơ đồ sau:
![]()
Từ 16,875 tấn bột sắn (chứa 80% tinh bột, còn lại là tạp chất trơ) sản xuất được 30 tấn dung dịch acetic acid có nồng độ a%. Tính giá trị của a? (Làm tròn kết quả đến hàng phần trăm).
(Xem giải) Câu 43. Cho ba mẫu kim loại X, Y và Z:
(a) Cho X vào dung dịch muối của Y thấy bề mặt X đổi màu, có kim loại mới bám vào.
(b) Cho Y vào dung dịch HCl thấy có bọt khí tạo thành trên bề mặt Y.
(c) Cho X vào dung dịch muối của Z không thấy hiện tượng xảy ra.
(d) Cho Z vào nước thu được sản phẩm gồm chất khí và dung dịch chứa chất tan.
Cho các phát biểu sau:
(1) Các kim loại X, Y, Z đều đứng trước hydrogen trong dãy điện hoá.
(2) Kim loại Z khử được ion của kim loại Y trong dung dịch.
(3) Dãy sắp xếp theo chiều giảm dần tính khử là Z, Y, X.
(4) Kim loại Z khử được ion H+ tạo thành H2.
Hãy liệt kê các phát biểu đúng theo thứ tự tăng dần (ví dụ: 12 hoặc 234,…)
(Xem giải) Câu 44. Trong một đề tài khôi phục nước trên sao hỏa của NASA. Tiến hành sấy các mẫu Iron(II) sulfate heptahydrate (FeSO4.7H2O) với độ tinh khiết 99,99% với các khoảng nhiệt độ tăng dần, người ta xử lý số liệu độ giảm khối lượng của chất rắn thu được đồ thị như sau:
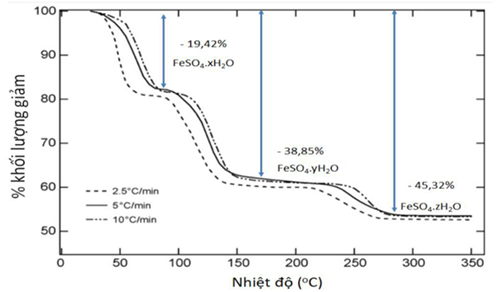
Tổng giá trị (x + y) là bao nhiêu? (Làm tròn kết quả đến hàng đơn vị).


Bình luận