[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Ninh Bình
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 055-H12A năm 2024-2025
⇒ Thời gian làm bài: 50 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1B | 2C | 3B | 4A | 5A | 6B | 7C | 8C | 9D |
| 10B | 11D | 12A | 13A | 14C | 15D | 16D | 17D | 18B |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | Đ | S | Đ | S | 1234 | 2 | 1 |
| (b) | S | S | Đ | Đ | 26 | 27 | 28 |
| (c) | Đ | S | Đ | S | 10 | 2576 | 145 |
| (d) | S | Đ | Đ | Đ |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Các loại nhựa được tạo ra từ chất dẻo khi thải ra môi trường phải mất rất nhiều thời gian để phân hủy (lên đến hàng trăm năm). Để hạn chế tình trạng ô nhiễm môi trường khi sử dụng đồ nhựa chúng ta không nên sử dụng cách nào sau đây?
A. Tái chế và tái sử dụng đồ nhựa đã dùng.
B. Đốt nhựa ngoài môi trường.
C. Thay thế đồ nhựa bằng vật liệu phân hủy sinh học.
D. Phân loại rác thải tại nguồn.
(Xem giải) Câu 2. Chất Z được dùng trong lĩnh vực thực phẩm; làm chất giữ ẩm, chất chống oxi hoá trong mĩ phẩm và sử dụng trong y tế, dược phẩm. Cho sơ đồ phản ứng điều chế chất Z như sau:
![]()
Biết (X), (Y), (Z) là các sản phẩm chính của phản ứng. Phát biểu nào sau đây không đúng?
A. a mol chất Y tác dụng với kim loại Na dư thu được tối đa 0,5a mol khí H2.
B. Chất Z hoà tan được copper(II) hydroxide tạo thành phức chất màu xanh lam.
C. Chất X là 3-chloropropane.
D. Chất C3H6 trong sơ đồ trên là monomer dùng tổng hợp polypropylene (PP).
(Xem giải) Câu 3. Khi để ngoài môi trường không khí, đinh sắt thường bị oxi hoá một phần thành gỉ sắt (Fe2O3.nH2O). Để xác định thành phần của chiếc đinh sắt đã bị oxi hoá, tiến hành thí nghiệm như sau:
• Bước 1: Hoà tan hoàn toàn đinh sắt vào dung dịch H2SO4 loãng, dư thu được 0,055 mol khí H2 và 100 mL dung dịch X.
• Bước 2: Lấy 20 mL dung dịch X, cho tác dụng với dung dịch NaOH dư, lọc lấy kết tủa, nung trong không khí đến khối lượng không đổi thu được 1,28 gam chất rắn.
• Bước 3: Chuẩn độ 10 mL dung dịch X (trong môi trường H2SO4 loãng, dư) bằng dung dịch KMnO4 0,07 M đến khi xuất hiện màu hồng nhạt thì dừng. Lặp lại thí nghiệm chuẩn độ thêm 2 lần nữa. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 20,0 mL.
Giả thiết toàn bộ gỉ sắt tạo ra bám trên đinh sắt. Phần trăm khối lượng sắt đã bị oxi hoá thành gỉ sắt là
A. 15,5%. B. 25,0%. C. 20,0%. D. 22,5%.
(Xem giải) Câu 4. Vôi sống (CaO) có nhiều ứng dụng trong đời sống và trong sản xuất như vật liệu xây dựng, tẩy uế, sát trùng, xử lí nước thải, … Hiện nay, nhiều lò vôi thủ công hoạt động tự phát, gây ảnh hưởng xấu đến môi trường xung quanh. Tuy nhiên, ở lò vôi công nghiệp, quá trình kiểm soát chất thải ô nhiễm được thực hiện chặt chẽ hơn. Xét một lò vôi công nghiệp sử dụng than đá làm nhiên liệu. Trong lò nung vôi công nghiệp xảy ra 2 phản ứng hoá học chính sau:
(1) C(s) + O2(g) → CO2(g) ![]() = –393,5 kJ
= –393,5 kJ
(2) CaCO3(s) → CaO(s) + CO2(g) ![]() = 178,3 kJ
= 178,3 kJ
Biết than đá chứa 80% là carbon, còn lại là tạp chất không cháy; CaCO3 là thành phần chính của đá vôi; hiệu suất sử dụng nhiệt là 60%. Để sản xuất được 1,0 tấn vôi sống thì cần tối thiểu bao nhiêu kg than đá (làm tròn đến hàng phần trăm)?
A. 202,28. B. 168,82. C. 13,49. D. 210,12.
(Xem giải) Câu 5. Kim loại X được điều chế bằng phương pháp điện phân nóng chảy oxide của X. Kim loại Y được điều chế bằng phương pháp điện phân dung dịch muối của Y hoặc khử oxide của Y bằng CO. Cho Y tác dụng với dung dịch muối của M thì thu được kim loại M. Các kim loại X, Y, M lần lượt là
A. Al, Fe, Cu. B. Na, Ag, Fe. C. Al, Mg, Cu. D. Ca, Al, Fe.
(Xem giải) Câu 6. Tiến hành các thí nghiệm sau:
(1) Khử ZnO ở nhiệt độ cao bằng than cốc.
(2) Điện phân dung dịch ZnSO4 với hai điện cực than chì.
(3) Điện phân NaCl nóng chảy với điện cực trơ.
(4) Điện phân dung dịch NaCl bão hoà với điện cực trơ, có màng ngăn xốp.
Chọn phát biểu đúng về các thí nghiệm trên:
A. Sau phản ứng, cả 4 thí nghiệm đều thu được kim loại.
B. Dung dịch thu được sau khi kết thúc thí nghiệm (2) và (4) đều làm đổi màu quỳ tím.
C. Ở thí nghiệm (3) và (4) đều thu được Cl2 ở cathode.
D. Ở thí nghiệm (1) nếu thay than cốc bằng CO2 thì vẫn điều chế được Zn.
(Xem giải) Câu 7. Thí nghiệm chiết tinh dầu bưởi:
– Dụng cụ: Phễu chiết 60 mL, ống đong 50 mL, giá thí nghiệm, bình tam giác 100 mL, bình chứa tinh dầu.
– Hóa chất: Hexane, hỗn hợp tinh dầu bưởi và nước.
– Tiến hành:
+ Bước 1: Cho khoảng 30 mL hỗn hợp tinh dầu bưởi và nước vào phễu chiết, thêm tiếp khoảng 15 mL hexane.
+ Bước 2: Đậy nắp phễu, một tay giữ nắp và một tay giữ phễu, cẩn thận lắc nhẹ và đảo ngược phễu nhiều lần. Đặt phễu vào giá, mở nắp phễu rồi nhanh chóng đậy lại, để yên một thời gian cho hỗn hợp trong phễu tách lớp.
+ Bước 3: Mở nắp, vặn khóa phễu từ từ cho lớp chất lỏng phía dưới chảy hết vào bình tam giác thì khoá phiễu chiết, lớp chất lỏng ở phía trên lấy ra khỏi phễu bằng cách rót qua cổ phễu vào bình khác.
+ Bước 4: Làm bay hơi dung môi của dịch chiết để thu được chất cần tách.
Cho các phát biểu sau:
(1) Phương pháp chiết trên là chiết lỏng – lỏng.
(2) Sau bước 3, tách được riêng nước với phần dung dịch tinh dầu bưởi và hexane.
(3) Sau bước 2, hỗn hợp trong phễu tách lớp, lớp chất lỏng phía trên là nước.
(4) Sau bước 4, hexane bay hơi hết thu được tinh dầu bưởi.
Số phát biểu đúng là
A. 4. B. 1. C. 3. D. 2.
(Xem giải) Câu 8. Trong dung dịch nước, acid HA phân li không hoàn toàn theo cân bằng: HA ⇋ H+ + A- (1)
Hằng số cân bằng của phương trình (1) bằng 1,8.10-5. Giá trị pH của dung dịch HA 0,1M (làm tròn đến hàng phần trăm) bằng
A. 2,25. B. 1,00. C. 2,88. D. 3,88.
(Xem giải) Câu 9. Cho các phát biểu sau:
(1) Glucose tác dụng với CH3OH khi có mặt HCl khan tạo thành methyl glucose.
(2) Saccharose chỉ tồn tại ở dạng mạch vòng, trong khi maltose tồn tại cả ở dạng mở vòng và dạng mạch vòng.
(3) Maltose được sử dụng làm nguyên liệu sản xuất bia và chất tạo ngọt cho một số loại bánh kẹo.
(4) Phân tử amylose có cấu tạo phân nhánh, còn phân tử cellulose có cấu tạo không nhánh.
(5) Fructose, glucose và saccharose đều có khả năng tham gia phản ứng với thuốc thử Tollens.
Số phát biểu đúng là
A. 5. B. 4. C. 3. D. 2.
(Xem giải) Câu 10. Glutamic acid là một amino acid có vai trò quan trọng trong việc trao đổi chất của cơ thể động vật, đây là amino acid mà cơ thể con người có thể tự tổng hợp được. Glutamic acid có công thức cấu tạo như hình bên và có điểm đẳng điện pHI = 3,1 (pHI là giá trị pH mà khi đó amino acid tồn tại chủ yếu ở dạng ion lưỡng cực có tổng điện tích bằng không). Khi pH < pHI thì amino acid tồn tại chủ yếu ở dạng cation, còn khi pH > pHI thì amino acid đó tồn tại chủ yếu ở dạng anion.
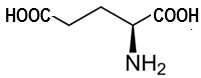
Cho các phát biểu sau:
(1) Glutamic acid là amino acid thiết yếu thuộc loại hợp chất hữu cơ tạp chức, trong phân tử chứa hai loại nhóm chức.
(2) Tên thay thế của glutamic acid là 2-aminopentane-1,5-dioic acid.
(3) Dung dịch glutamic acid làm quỳ tím hoá đỏ.
(4) Trong dung dịch có pH = 6,0 không thể tách hỗn hợp gồm glutamic acid, glycine (pHI = 6,0) và lysine (pHI = 9,7) bằng phương pháp điện di.
(5) Glutamic acid có công thức phân tử C5H9O4N.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 5.
(Xem giải) Câu 11. Hỗn hợp tecmit dùng hàn gắn đường ray có thành phần chính là aluminium (Al) và iron (III) oxide (Fe2O3). Phản ứng xảy ra khi đun nóng hỗn hợp tecmit như sau: 2Al + Fe2O3 → Al2O3 + 2Fe. Trong phản ứng hoá học trên, xảy ra quá trình khử chất nào?
A. Al2O3. B. Al. C. Fe. D. Fe2O3.
(Xem giải) Câu 12. Tiến hành thí nghiệm theo các bước sau:
• Bước 1: Chuẩn bị ba ống nghiệm, đánh số (1), (2), (3); cho vào mỗi ống nghiệm 2 mL dung dịch H2SO4 1M.
• Bước 2: Cho đồng thời ba lá kim loại có kích thước như nhau, đã làm sạch bề mặt vào ba ống nghiệm. Lá nhôm vào ống nghiệm (1), lá kẽm vào ống nghiệm (2) và lá đồng vào ống nghiệm (3). Biết: E°Cu2+/Cu = +0,340V, E°Al3+/Al = -1,676V, E°Zn2+/Zn = -0,762V; E°2H+/H2 = 0V.
Cho các phát biểu sau:
(1) Sau bước 2, ở cả ba ống nghiệm đều có khí thoát ra.
(2) Sau bước 2, tốc độ khí thoát ra ở ống (1) nhanh hơn ống (2).
(3) Ở bước 1, nếu thay dung dịch H2SO4 1M bằng dung dịch H2SO4 đặc, nguội thì hiện tượng ở ba ống nghiệm sau bước 2 sẽ không đổi.
(4) Sau bước 2, nếu thêm vào ống nghiệm (2) vài giọt dung dịch CuSO4 thì tốc độ thoát khí ở ống nghiệm (2) sẽ giảm.
Số phát biểu không đúng là
A. 3. B. 2. C. 4. D. 1.
(Xem giải) Câu 13. Để mạ đồng cho một tấm sắt có diện tích tổng 10 cm², người ta dùng tấm sắt làm cathode của một bình điện phân đựng dung dịch CuSO4 và anode là một thanh đồng nguyên chất, sau đó cho dòng điện có cường độ I = 1 A chạy qua trong thời gian 9650 giây. Khối lượng m (gam) của chất thoát ra ở điện cực được tính theo công thức sau: m = AIt/nF (A là khối lượng mol, n là số electron mà 1 ion Cu2+ nhận, I là cường độ dòng điện, t là thời gian điện phân tính bằng giây, F là hằng số Faraday, F = 96500 C/mol). Cho biết đồng có khối lượng riêng D = 8,96 g/cm³. Khi dừng điện phân, lớp mạ bám trên mặt tấm sắt có độ dày đồng nhất là x (mm). Giá trị của x (làm tròn đến hàng phần trăm) là
A. 0,36. B. 0,16. C. 0,14. D. 0,12.
(Xem giải) Câu 14. Phát biểu nào sau đây không đúng?
A. Muối ammonium tác dụng với dung dịch kiềm khi đun nóng sinh ra khí ammonia có mùi khai.
B. Phân tử NH3 có dạng hình học là chóp tam giác, trên nguyên tử nitrogen còn một cặp electron không liên kết.
C. Hiện tượng phú dưỡng là sự tích tụ lượng lớn các chất dinh dưỡng, bao gồm những hợp chất của nitrogen và hợp chất của sulfur trong các nguồn nước.
D. Trong tự nhiên, phản ứng giữa nitrogen và oxygen thường xảy ra trong những cơn mưa dông kèm sấm sét.
(Xem giải) Câu 15. Dãy chất nào sau đây, trong phân tử chỉ chứa liên kết cộng hóa trị
A. Mg(NO3)2, CO2, O2, NaOH. B. H2SO4, H2S, N2, NH4NO3.
C. CH3COONa, NH3, CH4, H2O. D. NH3, CO2, CH4, Cl2.
(Xem giải) Câu 16. Nhận định nào sau đây đúng?
A. Ethylamine tác dụng với HNO3 đặc ở nhiệt độ thường tạo thành ethanol.
B. Dung dịch lysine không đổi màu quỳ tím.
C. Glycine có công thức cấu tạo là H2N-CH(CH3)-COOH.
D. Dimethylamine là amine bậc hai.
(Xem giải) Câu 17. Pin Cu-Ag gồm hai điện cực Cu2+/Cu và Ag+/Ag. Cho thế điện cực chuẩn của hai cặp oxi hóa-khử Cu2+/Cu và Ag+/Ag lần lượt là +0,340V và + 0,799V. Nhận định nào sau đây đúng?
A. Thanh Ag là cực âm (anode).
B. Tại điện cực Cu xảy ra sự khử Cu2+.
C. Sức điện động chuẩn của pin Cu-Ag là -0,459V.
D. Ag+ dễ bị khử hơn Cu2+.
(Xem giải) Câu 18. Nhận định nào sau đây không đúng khi nói về phức chất [Co(NH3)6]3+?
A. Dạng hình học của phức là hình bát diện.
B. Nguyên tử trung tâm là Co.
C. Phối tử là NH3.
D. Liên kết giữa phối tử và nguyên tử trung tâm là liên kết cho-nhận.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. Chất béo là triester của glycerol với acid béo, gọi chung là triglyceride. Chất béo là nguồn cung cấp và dự trữ năng lượng ở người và động vật. Trong quá trình chuyển hoá, các triglyceride được thủy phân thành các chất nhỏ hơn là glycerol và các acid béo, sau đó các chất này được sử dụng cho nhiều mục đích khác nhau trong cơ thể. Cho triglyceride X có công thức cấu tạo như hình bên:
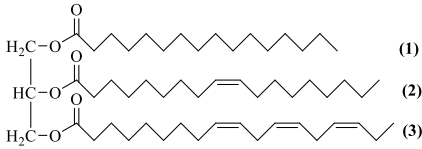
a) Tổng số liên kết π (pi) trong phân tử X là 7.
b) Công thức phân tử của X là C55H96O6.
c) Acid béo có gốc kí hiệu (3) thuộc loại acid béo omega-3.
d) Trong điều kiện thích hợp, X có thể phản ứng với hydrogen tạo thành chất béo Y chứa gốc acid béo no. Chất béo Y để sản xuất bơ nhân tạo, chất giặt rửa tổng hợp, …
(Xem giải) Câu 20. Tiến hành điện phân dung dịch chứa x mol CuSO4 và y mol NaCl (biết y < 2x) với hai điện cực than chì.
a) Thứ tự điện phân tại cathode: Na+, Cu2+, H2O.
b) Tại anode xảy ra sự khử Cl-.
c) Các quá trình oxi hoá tại anode không thay đổi khi thay anode than chì bằng anode Cu.
d) Dung dịch thu được sau điện phân (dừng điện phân khi cathode bắt đầu có bọt khí) có môi trường acid.
(Xem giải) Câu 21. Cho X, Y, Z, E, G, Q là các chất khác nhau trong số 6 chất sau: NH3, CH3COOH, HCl, HF, CH3NH2, CH3CHO và thông tin về các chất được ghi trong bảng sau:
| Chất | X | Y | Z | E | G | Q |
| Nhiệt độ sôi (°C) | -33,3 | +19,5 | -6,4 | -84,9 | +20,2 | +117,9 |
| pH (0,001M) | 10,12 | 3,20 | 10,81 | 3,00 | 7,00 | 3,90 |
a) Chất Z là CH3NH2.
b) Trong dung dịch, chất Y có khả năng hoà tan silicon dioxide nên được sử dụng để khắc các chi tiết lên thuỷ tinh vô cơ.
c) Chất G tan tốt trong nước do tạo liên kết hydrogen với nước.
d) Có thể chuyển hoá chất G thành chất Q bằng một phản ứng hoá học.
(Xem giải) Câu 22. Aniline là nguyên liệu tổng hợp một số chất quan trọng trong các lĩnh vực khác nhau như công nghiệp phẩm nhuộm, dược phẩm.
a) Aniline là alkylamine bậc một.
b) Ở điều kiện thường, aniline là chất lỏng, ít tan trong nước.
c) Aniline tác dụng với nitrous acid ở 0 – 5°C tạo thành phenol.
d) Do ảnh hưởng của nhóm -NH2, aniline dễ tham gia phản ứng thế nguyên tử H của vòng benzene hơn so với benzene.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Phân tích nguyên tố hợp chất hữu cơ mạch hở E cho kết quả phần trăm khối lượng carbon, hydrogen, oxygen, nitrogen lần lượt là 46,6%; 8,74%; 31,07% ; 13,59%. Phương pháp phân tích phổ khối lượng (phổ MS) cho biết E có phân tử khối bằng 103. Từ E thực hiện sơ đồ các phản ứng sau theo đúng tỉ lệ mol:
(a) E + NaOH (t°) → X + Y
(b) X + 2HCl → T + NaCl
Biết các chất X và Y có cùng số nguyên tử carbon. Cho các phát biểu sau:
(1) Chất Y có tên thay thế là ethanol.
(2) Chất T có 6 nguyên tử hydrogen trong phân tử.
(3) Chỉ cần dùng quỳ tím có thể phân biệt được dung dịch X và dung dịch T.
(4) Cho chất T tác dụng dung dịch NaOH dư lại thu được chất X.
(5) X là chất lưỡng tính.
Hãy sắp xếp thứ tự các phát biểu đúng theo chiều tăng dần (giả sử các phát biểu đúng là (3), (5), (1) thì kết quả là 135).
(Xem giải) Câu 24. Thả một đinh sắt nặng m1 gam đã được đánh sạch bề mặt vào cốc chứa dung dịch CuSO4 màu xanh. Sau một thời gian, lấy đinh sắt ra khỏi cốc, sấy khô, đem cân được m2 gam (giả sử toàn bộ lượng đồng sinh ra đã bám hết vào đinh sắt). Cho các phát biểu sau:
(1) Phản ứng diễn ra là: 2Fe + 3Cu2+ → 2Fe3+ + 3Cu
(2) Màu xanh của dung dịch CuSO4 nhạt dần.
(3) So sánh khối lượng đinh sắt trước và sau thí nghiệm, thu được kết quả m2 > m1.
(4) Nếu thay đinh sắt ban đầu bằng thanh kẽm thì màu xanh của dung dịch CuSO4 không thay đổi.
Có bao nhiêu phát biểu đúng?
(Xem giải) Câu 25. Cho các phát biểu sau:
(1) Mưa acid ăn mòn các công trình xây dựng, kiến trúc bằng đá và kim loại.
(2) Các khí SO2 và NOx là tác nhân chính gây mưa acid.
(3) Khi pha loãng dung dịch H2SO4 đặc, để đảm bảo an toàn phải rót từ từ dung dịch H2SO4 đặc vào nước, vừa rót vừa khuấy.
(4) Khi bị bỏng bởi dung dịch H2SO4 đặc cần rửa ngay bằng dung dịch NaOH đặc.
(5) Pin mặt trời là loại pin biến đổi trực tiếp quang năng thành điện năng, là nguồn năng lượng sạch và được các nhà khoa học khuyến cáo các nước tăng cường sản xuất và sử dụng.
Có bao nhiêu phát biểu không đúng?
(Xem giải) Câu 26. Soda (Na2CO3) khi để lâu ngoài không khí ẩm bị chuyển hóa một phần thành NaHCO3 và hút ẩm tạo thành hỗn hợp X. Lấy một lượng X hòa tan hoàn toàn vào nước thu được 200 ml dung dịch Y. Tiến hành các thí nghiệm sau:
– Thí nghiệm 1: Cho 25,0 mL dung dịch HCl 1M vào 10,0 mL dung dịch Y, sau đó đun nhẹ. Chuẩn độ dung dịch thu được với chỉ thị phenolphtalein tới khi dung dịch trong bình chuyển từ không màu sang màu hồng và bền ít nhất trong 20 giây thì thấy hết 25,0 mL dung dịch NaOH 0,2M.
– Thí nghiệm 2: Cho 25,0 mL dung dịch NaOH 1M vào 10,0 mL dung dịch Y, sau đó thêm tiếp dung dịch BaCl2 dư thì thu được 0,011 mol kết tủa.
Phần trăm Na2CO3 đã bị chuyển hóa thành NaHCO3 là x%. Tính giá trị của x (làm tròn đến phần nguyên)?
(Xem giải) Câu 27. Một lượng lớn acetic acid được sử dụng để sản xuất vinyl acetate (dùng sản xuất keo dán, chất kết dính trong sản xuất giấy, …) và cellulose acetate (sản xuất tơ, phim ảnh, …). Acetic acid được tổng hợp từ nguồn khí than (giá thành rẻ) theo các phản ứng hoá học sau:
(1) CO + 2H2 (t°, xt) → CH3OH
(2) CH3OH + CO (t°, xt) → CH3COOH
Giả thiết hiệu suất phản ứng (1) và phản ứng (2) đều đạt 80%. Tính tổng thể tích khí CO và khí H2 ở điều kiện chuẩn (theo m³, làm tròn đến phần nguyên) cần thiết để sản xuất 1000 Lít CH3COOH (có khối lượng riêng D = 1,05 gam/mL).
(Xem giải) Câu 28. Cho sơ đồ phản ứng sau, các chất phản ứng theo đúng tỉ lệ mol:
(a) X + nH2O (enzyme) → nY
(b) 2Y + Cu(OH)2 → Z + 2H2O
(c) X + 2nHNO3 (H2SO4 đặc) → T + 2nH2O
(d) X + 3nHNO3 (H2SO4 đặc) → G + 3nH2O
(e) Y (enzyme) → 2Q
Biết rằng các chất X, Y, Z, T, Q đều chứa nhóm –OH trong phân tử, chất G dùng chế tạo thuốc súng không khói. Cho các phát biểu sau:
(1) Ở phản ứng (a) có thể thay enzyme bằng dung dịch H2SO4 70%, đun nóng.
(2) Phản ứng (b) chứng tỏ chất Y có tính chất của nhóm chức aldehyde.
(3) Chất Q là một hợp chất hữu cơ đơn chức.
(4) Chất X là polymer thiên nhiên.
(5) Chất X không tan trong nước nhưng tan trong nước Schweizer.
Hãy sắp xếp thứ tự các phát biểu đúng theo chiều tăng dần (giả sử các phát biểu đúng là (3), (5), (1) thì kết quả là 135).


Bình luận