[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Quảng Trị
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Thời gian làm bài: 180 phút
Câu 1. (4,5 điểm)
(Xem giải) 1. Nguyên tố X có tổng số electron ở trên các phân lớp p ở trạng thái cơ bản là 10. Nguyên tử nguyên tố Y có điện tích hạt nhân bằng +41,652.10^-19C.
a) Lập luận để xác định chu kỳ, nhóm của X và Y trong Bảng tuần hoàn các nguyên tố hóa học.
b) Viết cấu hình electron của ion X2- và Y2+.
2.
(Xem giải) a) Trong tự nhiên chlorine có hai đồng vị ![]() và
và ![]() . Nguyên tử khối trung bình của chlorine bằng 35,5.
. Nguyên tử khối trung bình của chlorine bằng 35,5.
Tính thành phần phần trăm số nguyên tử của mỗi đồng vị.
Tính thành phần phần trăm khối lượng của ![]() trong 16,25 gam FeCl3.
trong 16,25 gam FeCl3.
(Xem giải) b) Lập phương trình hóa học bằng phương pháp thăng bằng electron:
FeSO4 + KMnO4 + KHSO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
NH4ClO4 → N2 + Cl2 + O2 + H2O
3.
(Xem giải) a) Giải thích tại sao các chất trong bảng dưới đây có nhiệt độ sôi khác nhau.
| Chất | Nước (H2O) | Ammonia (NH3) | Methane (CH4) |
| Khối lượng mol (g/mol) | 18 | 17 | 16 |
| Nhiệt độ sôi (°C) | 100 | -33,35 | -161,58 |
(Xem giải) b) Viết công thức electron và công thức Lewis của các phân tử và ion sau: SO2, NF3, NO2, NH4+.
4.
(Xem giải) a) Cho các ion: Na+, CH3COO-, K+, Cl-, NH4+, CO32-, HSO4-, HCO3-. Ion nào là acid, base, lưỡng tính hay trung tính? Giải thích.
Các dung dịch sau đây có pH lớn hơn, nhỏ hơn hay bằng 7: Na2CO3, KCl, CH3COONa, NH4Cl, NaHSO4?
(Xem giải) b) Khí SO2 tan vào nước thu được dung dịch A có cân bằng: SO2 + H2O ⇋ HSO3- + H+
Giải thích sự chuyển dịch cân bằng trên khi:
– Thêm dung dịch HCl vào A.
– Thêm dung dịch NaOH vào A.
– Pha loãng dung dịch A bằng nước cất.
– Đun nóng dung dịch A.
(Xem giải) 5. Giả sử để đảm bảo độ dinh dưỡng cho đất, biết 10000 m² đất trồng cần được cung cấp 120 kg N, 60 kg P2O5 và 90 kg K2O. Người ta sử dụng đồng thời ba loại phân bón: phân hỗn hợp NPK có độ dinh dưỡng ghi trên bao bì là (16-16-8), phân kali (KCl) (độ dinh dưỡng 60%) và urea ((NH2)2CO) (độ dinh dưỡng 46%) trộn lẫn với nhau. Tính tổng khối lượng phân bón cần sử dụng cho 10000 m² đất trồng.
Câu 2. (5,0 điểm)
(Xem giải) 1. Cho mẩu Na vào dung dịch HCl, kết thúc phản ứng, thu được dung dịch X. Cho dung dịch X lần lượt tác dụng với NH4HCO3 và M(OH)n. Viết phương trình hoá học của các phản ứng có thể xảy ra.
2.
(Xem giải) a) Viết các phương trình hoá học xảy ra khi sản xuất sulfuric acid trong công nghiệp bằng phương pháp tiếp xúc từ quặng pyrite (chứa FeS2).
(Xem giải) b) Tính khối lượng quặng pyrite chứa 10% tạp chất trơ cần dùng để sản xuất 3,38 tấn oleum (H2SO4.3SO3). Biết hiệu suất cả quá trình sản xuất đạt 80%.
(Xem giải) 3. Nêu hiện tượng và viết phương trình hoá học xảy ra trong mỗi trường hợp sau:
a) Cho từ từ dung dịch HCl đặc đến dư vào dung dịch K2Cr2O7.
b) Cho mẩu quỳ tím ẩm vào bình đựng khí chlorine.
c) Cho NaBr vào dung dịch H2SO4 đặc, nóng, dư.
d) Sục từ từ khí chlorine đén dư vào dung dịch KI có chứa hồ tinh bột.
(Xem giải) 4. Chỉ dùng thêm dung dịch HCl, trình bày phương pháp phân biệt các dung dịch riêng biệt sau: Na2CO3, NaNO3, NH4Cl, Ba(OH)2, K2SO4, (NH4)2SO4. Viết các phương trình hoá học của các phản ứng xảy ra.
(Xem giải) 5. Hợp chất hữu cơ X gồm 3 nguyên tố C, H, O. Kết quả phân tích nguyên tố của hợp chất hữu cơ X có mC : mH : mO = 42 : 7 : 16. Phân tử khối của X gấp 4,0625 lần phân tử khối của oxygen.
a) Xác định công thức phân tử của X.
b) X có mạch không phân nhánh và phổ hồng ngoại của X như sau:
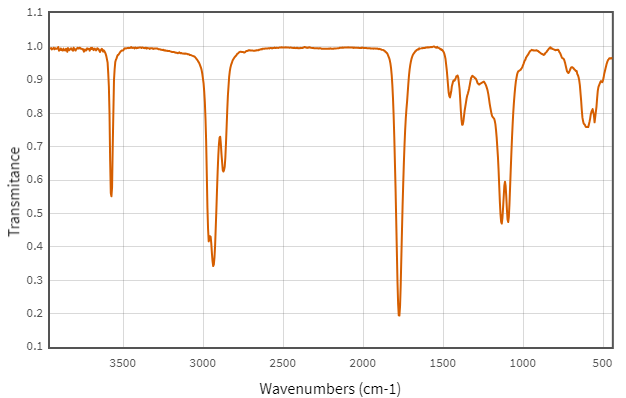
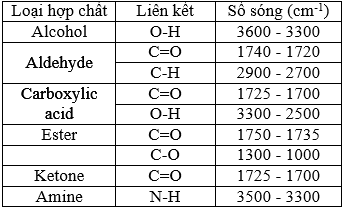
Xác định công thức cấu tạo của X. Giải thích.
Câu 3. (4,5 điểm)
(Xem giải) 1. Cho phản ứng đốt cháy:
(1) C8H18(l) + 12,5O2(g) → 8CO2(g) + 9H2O(g)
(2) C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(g)
a) Tính biến thiên enthalpy chuẩn của phản ứng (1), (2).
| C8H18(l) | C2H5OH(l) | CO2(g) | H2O(g) | |
| -249,9 | -235,1 | -393,5 | -241,8 |
b) Tính lượng nhiệt giải phóng khi đốt cháy hoàn toàn 1 lít xăng E5. Biết khối lượng riêng của ethanol nguyên chất là 0,8 g/mL, xăng truyền thống (giả sử chỉ chứa C8H18) là 0,7 g/mL.
(Xem giải) 2. Cho phản ứng phân huỷ: 2N2O5(g) → 4NO2(g) + O2(g). Nồng độ của mỗi chất trong phản ứng trên tại thời điểm t1 = 0 và t2 = 100s được cho trong bảng sau:
| Thời gian | C(N2O5) | C(NO2) | C(O2) |
| t1 = 0 | 0,0200 | ||
| t2 = 100 | 0,0169 | 0,0062 | 0,00155 |
Tính tốc độ trung bình của phản ứng theo chất tham gia và sản phẩm
(Xem giải) 3. Đốt cháy hoàn toàn 12 gam muối sulfide của kim loại R (hóa trị II) thu được chất rắn A và chất khí B. Hòa tan hết A bằng một lượng vừa đủ dung dịch H2SO4 24,5% thu được dung dịch muối B có nồng độ 33,33%. Khi làm lạnh dung dịch B thấy tách ra 15,615 gam tinh thể muối ngậm nước X. Phần dung dịch bão hoàn còn lại tại nhiệt độ đó có nồng độ 22,54%. Xác định R và công thức muối tinh thể ngậm nước.
(Xem giải) 4. Hỗn hợp X gồm các chất rắn KMnO4, KClO3 và CaOCl2 trong đó O chiếm 31,8% khối lượng. Để hòa tan m gam X cần dùng vừa đủ dung dịch chứa 2,5 mol HCl đặc, đun nóng, sau phản ứng thấy thoát ra 0,95 mol khí chlorine. Viết phương trình hóa học của các phản ứng xảy ra và tính thành phần phần trăm khối lượng KMnO4 trong hỗn họp X.
(Xem giải) 5. Nung 3,2 gam hỗn họp gồm Fe và kim loại R (hóa trị II) với 1,6 gam bột sulfur trong bình kín không có không khí, được hỗn hợp rắn X. Hòa tan hoàn toàn lượng X trong dung dịch HCl được dung dịch Y và hỗn hợp khí Z. Cho dung dịch Y tác dụng vừa đủ với NaOH để thu được kết tủa lớn nhất. Đem nung nóng kết tủa trong không khí đến khối lượng không đổi, thu được 4,8 gam hỗn hợp oxide. Để đốt cháy hoàn toàn hỗn hợp khí Z cần vừa đủ 0,09 mol O2. Viết phương trình hoa học của các phản ứng và xác định R.
Câu 4. (6,0 điểm)
(Xem giải) 1. Cho 3 chất hữu cơ bền, mạch hở X, Y, Z có cùng công thức phân từ C2H4O2. Biết X tác với dung dich Na2CO3 giải phóng CO2. Y vừa tác dụng với Na vừa có phản ứng với thuốc thứ Tollens. Z tác dụng được với dung dịch NaOH nhưng không tác dụng với Na. Có các nhận xét sau về các chất trên:
a) Z có khả năng tham gia phản ứng với thuốc thử Tollens.
b) Z có nhiệt độ sôi cao hơn X.
c) Y là hợp chất hữu cơ đơn chức.
d) X được điều chế trực tiếp từ butane.
Các nhận xét trên đúng hay sai? Giải thích ngắn gọn.
(Xem giải) 2. Viết phương trình hoá học của các phản ứng theo sơ đồ sau:
CH3OH → X → X1 → X2 → X3 → X4 → X5 → X6 → X7 → X
Biết X7 là hợp chất hữu cơ chứa 4 nguyên tố và có liên kết ion, X2, X3, X4 là hydrocarbon.
(Xem giải) 3. Đốt cháy hoàn toàn m gam hỗn hợp X chứa các triglyceride tạo bởi từ cả 3 acid béo sau: palmitic acid, oleic acid, linoleic acid, thu được 24,2 gam CO2 và 9 gam H2O. Nếu xà phòng hóa hoàn toàn 2m gam hỗn hợp X bàng dung dịch KOH vừa đủ, thu được a gam muối. Viết phương trình hoá học của các phản ứng xảy ra và tính a.
(Xem giải) 4. Cho X, Y, Z, T, P và Q là các hợp chất hữu cơ no, mạch hở có cùng công thức phân tử C3H6O2. Biết chúng có các tính chất sau:
| Phản ứng | X | Y | Z | T | P | Q |
| Na | có | không | có | không | có | không |
| NaOH | có | không | không | có | không | có |
| Thuốc thử Tollens | không | có | không | không | có | có |
Xác định công thức cấu tạo đúng của X, Y, Z, T, P, Q và viết phương trình hoá học của các phản ứng xảy ra.
(Xem giải) 5. X, Y là hai ester đều đơn chức, cùng dãy đồng đẳng; Z là ester 2 chức (X, Y, Z đều mạch hở). Đun nóng 5,7m gam hỗn họp E gồm X, Y, Z (số mol Y lớn hơn số mol của Z và MY > MX) với dịch NaOH vừa đủ được hỗn hợp F gồm 2 alcohol kế tiếp trong dãy đồng đẳng và hỗn hợp muối. Cho toàn bộ F vào bì dựng Na dư, kết thúc phản ứng, khối lượng bình tăng 8,56 gam và có 0,12 mol khí H2 thoát ra. Cho toàn G phản ứng hoàn toàn với vôi tôi xút, nung nóng chỉ thu được một hydrocarbon đơn giản nhất có khối lượng m gam. Xác định X, Y, Z và tính khối lượng của Z có trong hỗn hợp E.


Bình luận