[2024 – 2025] Thi học sinh giỏi lớp 12 TP Hồ Chí Minh
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề 063-H12C năm 2024-2025
⇒ Thời gian làm bài: 120 phút
Câu 1: (4 điểm)
(Xem giải) 1.1. Theo quy chuẩn kỹ thuật Quốc gia về nước thải công nghiệp (QCVN 40:2011/BTNMT), giá trị tối đa cho phép của các thông số ô nhiễm trong nước thải công nghiệp khi xả thải vào nguồn tiếp nhận nước thải, được tính theo công thức: Cmax = C.Kp.Kf
Trong đó:
– Cmax: giá trị nồng độ tối đa cho phép của thông số ô nhiễm trong nước thải công nghiệp xả thải vào nguồn tiếp nhận nước thải (mg/L);
– C: giá trị nồng độ qui định của thông số ô nhiễm trong nước thải công nghiệp xả thải vào nguồn tiếp nhận dùng cho các mục đích sử dụng khác nhau (mg/L);
– Kp: hệ số nguồn tiếp nhận nước thải ứng với lưu lượng dòng chảy của sông, suối, kênh,…;
– Kf: hệ số lưu lượng nguồn thải ứng với tổng lưu lượng nước thải của các cơ sở công nghiệp khi xả thải vào nguồn tiếp nhận nước thải.
Nồng độ qui định của thông số ô nhiễm tổng cyanide (CN-) trong nước thải công nghiệp theo bảng sau:
| Mục đích sử dụng của nguồn tiếp nhận | C (mg/L) |
| Nguồn nước dùng cho mục đích cấp nước sinh hoạt | 0,07 |
| Nguồn nước không dùng cho mục đích cấp nước sinh hoạt | 0,1 |
a) Tính nồng độ tối đa (Cmax) của thông số ô nhiễm tổng cyanide trong nước thải công nghiệp được phép xả thải vào nguồn tiếp nhận (bảng trên). Biết rằng, hai nguồn tiếp nhận có cùng giá trị Kp, Kf lần lượt là 0,9 và 1,1.
b) Công ty sản xuất X xả nước thải trực tiếp vào nguồn tiếp nhận (kênh, rạch,…), không qua xử lí. Giả thiết phân tích các thành phần hóa học có trong 2,0 lít mẫu nước xả thải của Công ty sản xuất X, trong đó hàm lượng cyanide được xác định bằng phương pháp hóa học theo sơ đồ các phản ứng sau:
(1) NaCN + NaClO → NaCNO + NaCl
(2) NaCNO + H2O → NaHCO3 + NH3
(3) NaCNO + NaClO + H2O → NaHCO3 + N2 + NaCl
Sau khi các phản ứng trên xảy ra hoàn toàn, dung dịch thu được cho tác dụng với lượng dư dung dịch calcium hydroxide, thu được 0,002 gam kết tủa trắng. Viết và hoàn thành phương trình hoá học các phản ứng xảy ra. Hỏi nước xả thải của Công ty sản xuất X có vượt quá nồng độ qui định thông số ô nhiễm tổng cyanide không? Giải thích.
(Xem giải) 1.2. SRS (Supplemental Restraint System) là kí hiệu hệ thống túi khí an toàn, một thiết bị thụ động được lắp đặt ẩn ở một số vị trí bên trong khoang xe và phần khung xe ô tô. Sodium azide (NaN3) là hợp chất dễ bị phân hủy, hỗn hợp gồm chất rắn gồm: NaN3, KNO3 và SiO2 được sử dụng trong thiết bị điều khiển túi khí an toàn. Khi bị va đập mạnh, hệ thống cảm biến kích hoạt hỗn hợp chất rắn trên nhanh chóng phản ứng tạo ra khí nitrogen, làm căng đầy túi khí. Phương trình hóa học các phản ứng xảy ra được biểu diễn theo các sơ đồ sau:
(1) NaN3 → Na + N2
(2) Na + KNO3 → K2O + Na2O + N2
(3) K2O + SiO2 → K2SiO3
(4) Na2O + SiO2 → Na2SiO3
Hình ảnh một túi khí an toàn được kích hoạt
Tính khối lượng (gam) hỗn hợp chất rắn cần thiết để tạo ra khí nitrogen nạp đầy một túi khí có dung tích 100 lít (ở 25°C, 1 atm). Biết rằng, chất rắn sau cùng còn lại trong túi khí chỉ là sản phẩm của phản ứng (3), (4).
(Xem giải) 1.3. Hai dạng phức chất A và B của coban (Co, cobalt) có công thức dạng Co(NH3)xBrySO4 (x, y là số nguyên dương); phân tử khối của A, B đều bằng 320 amu. Dung dịch A (màu tím đỏ) khi tác dụng với dung dịch Ba2+, tạo kết tủa trắng; dung dịch B (màu hồng đỏ) khi tác dụng với dung dịch Ag+, tạo kết tủa vàng nhạt.
a) Xác định công thức cấu tạo của A và B.
b) Viết công thức Lewis của NH3, cho biết trạng thái lại hóa của nguyên tử nitrogen trong NH3.
c) Xác định dạng hình học của phức chất (A hoặc B) và số oxi hóa của nguyên tử trung tâm.
Câu 2: (4 điểm)
2.1. Thực hiện các yêu cầu sau:
(Xem giải) a) Quá trình quang hợp xảy ra khi có điều kiện ánh sáng mặt trời, khi đó carbon dioxide và hơi nước được diệp lục hấp thụ tạo sản phẩm glucose để tổng hợp carbohydrate và giải phóng oxygen. Viết phương trình hóa học phản ứng xảy ra.
(Xem giải) b) Máy đo nồng độ cồn trong hơi thở (BrAC, Breath Alcohol Concentration) được phát triển sớm nhất dựa trên phản ứng của ethanol (nếu có) trong không khí thở ra với hỗn hợp các hóa chất: sulfuric acid, potassium dichromate, silver nitrate và nước. Silver nitrate xúc tác cho phản ứng potassium dichromate oxy hóa ethanol trong môi trường sulfuric acid thành ethanal. Lượng ethanol trong hơi thở được ước lượng thông qua tín hiệu cường độ màu. Viết phương trình hóa học phản ứng xảy ra và cho biết màu của hỗn hợp các hóa chất sẽ thay đổi như thế nào trước và sau khi phản ứng xảy ra?
(Xem giải) c) Mỗi amino acid có một pH cụ thể mà tại đó nồng độ của dạng zwitterionic (phân tử chứa cả điện tích dương và điện tích âm, tổng điện tích hình thức của nó bằng không) đạt giá trị cực đại. Độ pH này được gọi là độ pH đẳng điện hoặc điểm đẳng điện, kí hiệu là pI. Đối với amino acid không có chuỗi bên có tính acid hoặc tính base, pI chỉ đơn giản là giá trị trung bình của hai giá trị pKa. Đối với các amino acid có chuỗi bên có tính acid hoặc tính base, pl là giá trị trung bình của hai giá trị pKa tương ứng với các nhóm tương tự.
Một amino acid mang điện tích dương (dạng cation) trong dung dịch acid (pH thấp) và mang điện tích âm (dạng anion) trong dung dịch base (pH cao). Bằng cách thay đổi độ pH của dung dịch, chúng ta có thể kiểm soát điện tích trên phân tử. Khả năng kiểm soát điện tích của một amino acid này hữu ích để tách và xác định các amino acid bằng phương pháp điện di. Cho đồ thị biểu diễn đường cong chuẩn độ của glycine (hình bên).
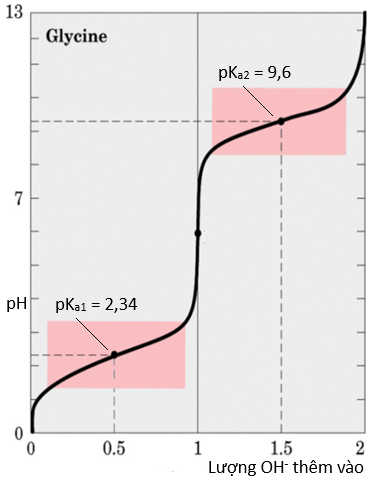
i. Tính giá trị pl của glycine.
ii. Viết công thức cấu tạo dạng tồn tại chủ yếu của glycine trong môi trường có các giá trị pH sau: pH < 2,34; 2,34 < pH < 9,6 và pH > 9,6.
(Xem giải) d) Polymer A thuộc loại poly(ester amide) được sử dụng trong dược phẩm để giải phóng thuốc có kiểm soát. Sau khi uống, các enzyme của cơ thể nhận biết các amino acid tự nhiên trong mạch polymer và phân cắt tại các vị trí này làm thuốc được giải phóng một cách từ từ. Polymer A được tổng hợp từ bốn monomer gồm: hai monomer là carboxylic acid hai chức và alcohol hai chức; hai monomer là amino acid và dẫn xuất của amino acid. Polymer A có công thức cấu tạo mỗi mắt xích như hình sau đây:

Xác định công thức cấu tạo của các monomer tạo thành polymer A.
(Xem giải) 2.2. Ethanol và propanoic acid phản ứng tạo thành ester ethyl propanoate, có mùi của chuối chín:
CH3CH2OH(l) + CH3CH2COOH(l) ⇋ CH3CH2COOCH2CH3(l) + H2O(l)
Trong phòng thí nghiệm, một học sinh thực hiện song song phản ứng ester hóa giữa ethanol và propanoic acid trong hai bình thủy tinh riêng biệt (đun nóng ở 150°C, không có mặt xúc tác). Số mol acid và số mol alcohol trong mỗi bình ban đầu đều là 0,1 mol. Sau một thời gian, lấy 50,00 mL hỗn hợp sau phản ứng của mỗi bình thuỷ tinh và cho vào 2 bình tam giác riêng biệt: bình tam giác (A) và bình tam giác (B).
– Bình tam giác (A): tiến hành chuẩn độ bằng dung dịch NaOH 6,000 M, đun nóng thì thể tích NaOH cần dùng chuẩn độ là 16,67 mL.
– Bình tam giác (B): tiến hành tách ester ra và chuẩn độ dung dịch còn lại trong bình bằng NaOH 6,000 M thì thể tích NaOH đã dùng là 4,55 mL.
Tính hằng số cân bằng của phản ứng ester hoá trên. Giả thiết trong hai bình thủy tinh, phản ứng ester hóa xảy ra cùng điều kiện: thời gian, nhiệt độ và áp suất.
Câu 3: (4 điểm)
3.1. Gói FRH (Flameless Ration Heater) được phát minh nhằm làm nóng thực phẩm trong các bữa ăn tiện lợi cho người lính trên chiến trường. Một số gói lẩu tự sôi cũng sử dụng công nghệ này.
(Xem giải) a) Hỗn hợp bột của kim loại magiê (Mg, magnesium) và sắt (Fe, iron) được nghiền bằng kỹ thuật luyện kim năng lượng cao, tạo thành hợp kim “siêu ăn mòn”. Thực hiện quá trình thiêu kết hỗn hợp gồm hợp kim “siêu ăn mòn” với bột polyethylene và sodium chloride (NaCl), tạo thành vật liệu xốp gọi là hỗn hợp FRH. Một nhóm học sinh tiến hành thí nghiệm để kiểm tra thành phần hóa học của hỗn hợp FRH theo các bước sau:
• Bước 1: Để gói FRH treo thẳng đứng và đưa nam châm lại gần.
• Bước 2: Thêm nước (dư) vào cốc thủy tinh chứa sẵn một lượng hỗn hợp FRH, thấy xảy ra phản ứng tỏa nhiệt, tạo thành kết tủa và khí không màu. Chia hỗn hợp sau phản ứng làm 2 phần; acid hóa phần 1 bằng dung dịch HNO3 loãng, dư. Thêm tiếp vài giọt dung dịch silver nitrate, thấy xuất hiện kết tủa trắng.
• Bước 3: Tiến hành lọc phần còn lại (phần 2) của hỗn hợp sau phản ứng ở bước 2, thu được dung dịch lọc và chất rắn màu trắng.
– Cho chất rắn vào cốc thủy tinh chứa nước cất, nhỏ thêm vài giọt dung dịch phenolphthalein.
– Đốt dung dịch lọc trên ngọn lửa không màu.
i. Nêu hiện tượng và giải thích cách làm trong bước 1 và bước 3; viết phương trình hóa học các phản ứng xảy ra (nếu có) ở bước 2.
ii. Tại sao magiê phản ứng chậm với nước ở nhiệt độ thường (25 °C) nhưng magiê trong FRH lại phản ứng nhanh chóng với nước?
iii. Một gói FRH sử dụng 7,5 gam bột hợp kim Mg – Fe (gồm 95% Mg và 5% Fe theo khối lượng), 0,5 gam sodium chloride, ngoài ra còn có chất độn trơ. Khi thêm 30 mL nước vào hỗn hợp FRH này để hâm nóng một gói thức ăn nặng 230 gam trong khoảng 10 phút. Biết rằng: enthalpy tạo thành chuẩn (kJ/mol) của magnesium hydroxide (rắn) và nước (lỏng) lần lượt là -928,4 và -285,8; nhiệt dung riêng của loại thức ăn trên là 3,52 kJ/kg.K; phần thức ăn được làm nóng chỉ nhận được tối đa 50% lượng nhiệt tỏa ra. Hãy cho biết, gói thực phẩm từ 25°C sẽ được tăng đến nhiệt độ (°C) bao nhiêu? Cho biết: Q = m.C.ΔT. Với Q: nhiệt lượng hấp thu (kJ); m: khối lượng (kg); C: nhiệt dung riêng (kJ/kg.K); ΔT: biến thiên nhiệt độ (K).
(Xem giải) b) Hiện nay, gói FRH chứa hỗn hợp Al và CaO được sử dụng phổ biến trên thị trường, trong các thiết bị tự gia nhiệt hóa học thương mại. Các phản ứng tỏa nhiệt chính có thể xảy khi gói FRH này tiếp xúc với nước như sau:
(1) CaO(s) + H2O(l) → X(s)
(2) Al(s) + H2O(l) → Y(s) + Z(g)
(3) Al(s) + X(s) + H2O(l) → T(s) + Z(g)
Xác định các chất X, Y, Z, T và hoàn thành phương trình hóa học các phản ứng.
(Xem giải) 3.2. Trong hóa học hữu cơ, ozone phân là phản ứng hữu cơ trong đó các liên kết không bão hòa bị phân cắt bằng ozone (O3). Liên kết carbon-carbon được thay thế bằng nhóm carbonyl (C=O). Phản ứng ozone phân alkene được mô tả bằng sơ đồ sau:
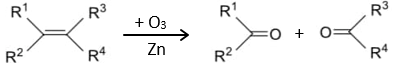
Cho sơ đồ chuyển hóa sau:
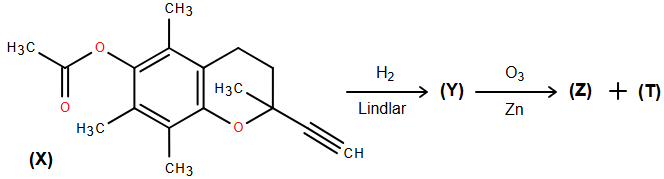
a) Xác định công thức phân tử của (X).
b) Xác định công thức cấu tạo của (Y), (Z) và (T).
Câu 4: (4 điểm)
(Xem giải) 4.1. Một nhóm học sinh tiến hành thí nghiệm điện phân 200 mL dung dịch CuSO4 0,5M, sử dụng bộ dung cụ được mô tả như hình bên. Giả thiết quá trình điện phân duy trì ở 30 – 35°C; hiệu điện thế được giữ cố định; giá trị pH của dung dịch điện phân được giữ ổn định; không xảy ra quá trình điện phân nước bỏ qua sự bay hơi của nước trong quá trình điện phân.
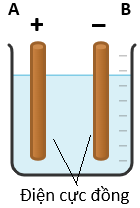
a) Cho biết vai trò (cathode và anode) của điện cực Cu (A) và điện cực Cu (B).
b) Sau một thời gian điện phân, khối lượng điện cực Cu (A) và khối lượng điện cực Cu (B) tăng, giảm hay không đổi? Giải thích.
c) Trong công nghiệp, người ta tinh luyện đồng (Cu, copper) bằng phương pháp điện phân. Đồng có độ tinh khiết cao có thể thu được từ đồng phế liệu hoặc đồng thô (có độ tinh khiết thấp). Hai tấm kim loại đồng gồm: đồng có độ tinh khiết cao và đồng phế liệu được sử dụng làm hai điện cực. Kết thúc quá trình điện phân, đồng tinh khiết được thu hồi ở điện cực cathode hay điện cực anode?
d) Trong thực tế, mạ đồng từ dung dịch copper(II) sulfate người ta thường chú ý sự ảnh hưởng của ion Cu2+ đến quá trình mạ và chất lượng lớp kim loại mạ. Ion Cu+ sinh ra do phản ứng thuận nghịch của kim loại Cu khử ion Cu2+ trong dung dịch (phản ứng 1). Khi dung dịch không có acid, Cu+ ở dạng muối sulfate sẽ bị thủy phân tạo ra copper(I) oxide (phản ứng 2) ở dạng rắn, lơ lửng trong dung dịch. Vì vậy, người ta phải thêm dung dịch sulfuric acid vào dung dịch mạ và khuấy bằng không khí nén, tạo điều kiện để oxy hóa copper(I) oxide (phản ứng 3) và oxy hóa copper(I) sulfate (phản ứng 4) thành copper(II) sulfate. Viết phương trình hóa học các phản ứng từ 1 đến 4.
(Xem giải) 4.2. Kết quả phân tích nguyên tố của hợp chất hữu cơ X: %C = 50,38%; %H = 6,87% về khối lượng, còn lại là O. Phân tử khối của hợp chất X được xác định thông qua phổ khối lượng với peak ion phân tử có giá trị m/z lớn nhất bằng 262. Cho X tác dụng với dung dịch NaOH vừa đủ thu được muối sodium của acid Y và hỗn hợp A gồm hai alcohol thuộc cùng dãy đồng đẳng. Hóa hơi hoàn toàn 1,24 gam hỗn hợp A thu được thể tích hơi đúng bằng thể tích của 0,84 gam N2 đo ở cùng điều kiện. Khi cho cùng một lượng acid Y phản ứng hết với dung dịch NaHCO3 hoặc phản ứng hết với Na, thì thể tích khí CO2 thu được gấp 1,5 lần thể tích khí H2 đo trong cùng điều kiện.
a) Xác định công thức phân tử của các alcohol trong hỗn hợp A.
b) Acid Y (2-hydroxypropane-1,2,3-tricarboxylic acid) có trong nhiều loại trái cây và rau quả, đặc biệt trong trái cây họ cam quýt. Acid Y lần đầu tiên được phân lập vào năm 1784 bởi nhà hóa học Thụy Điển Carl Wilhelm Scheele, bằng cách kết tinh nó từ nước cốt chanh. Xác định công thức cấu tạo của X và Y.
Nếu học sinh không làm được câu a) thì có thể làm câu b).
Câu 5: (4 điểm)
(Xem giải) 5.1. Hiện nay, quá trình hoạt động của nhiều lò nung vôi thủ công đã phát thải một lượng lớn SO2 vào bầu khí quyển. Ở các lò nung vôi công nghiệp, quá trình kiểm soát khí phát thải gây ô nhiễm được thực hiện chặt chẽ hơn.
a) Một lò nung với công nghiệp sản xuất vôi sống sử dụng than đá làm nhiên liệu. Giả thiết:
– Nung nóng để phân hủy 1 kg đá vôi (thành phần chính là CaCO3, chiếm 80% về khối lượng) cần cung cấp một lượng nhiệt là 1080 kJ. Hiệu suất phân hủy đạt 75%, các tạp chất trong đá vôi không tham gia phản ứng.
– Đốt cháy 1 kg than đá giải phóng ra một lượng nhiệt là 27000 kJ và có 50% lượng nhiệt này được hấp thụ cho quá trình phân hủy đá vôi.
– Công suất sản xuất của lò nung vôi công nghiệp là 420 tấn vôi sống/ngày.
Tính khối lượng (tấn) đá vôi và khối lượng (tấn) than đá mà lò nung vôi công nghiệp sử dụng mỗi ngày.
b) Một lò nung vôi thủ công sử dụng 1 tấn than đá/ngày. Loại than đá này chứa 1% lưu huỳnh (ở dạng FeS2, CaSO4, CxHySH….) về khối lượng, theo đó 80% lượng lưu huỳnh (S, sulfur) bị đốt cháy tạo thành SO2 và có 8% lượng SO2 sinh ra phát thải vào khí quyển. Trong 30 ngày toàn bộ lượng SO2 chuyển hóa hết thành sulfuric acid trong nước mưa rơi trên vùng đất rộng 2,0 km² với lượng mưa trung bình 15 mm.
i. Viết phương trình hóa học các phản ứng theo sơ đồ sau: S → SO2 → H2SO4
ii. Tính nồng độ H2SO4 trong nước mưa.
(Xem giải) 5.2. Y là hợp chất hữu cơ (chứa C, H, O) đóng vai trò rất quan trọng trong nhiều quá trình sinh hoá. Phân tử khối của hợp chất Y được xác định thông qua phổ khối lượng với peak ion phân tử có giá trị m/z lớn nhất bằng 90. Kết quả phân tích phổ hồng ngoại (IR) của Y được cho như hình bên.

a) Xác định công thức phân tử và công thức cấu tạo của Y.
b) Chất Y chiếm hàm lượng đáng kể trong sữa chua. Một thí nghiệm xác định độ pH và hàm lượng chất Y có trong một mẫu sữa chua người ta thực hiện như sau: lấy 10 mL mẫu sữa chua rồi cho vào bình tam giác, thêm 2 – 3 giọt phenolphthalein. Chuẩn độ bằng dung dịch NaOH 0,15M đến khi nào xuất hiện màu hồng bền trong 30s. Khi kết thúc chuẩn độ thì thể tích NaOH đã dùng là 25 mL.
i. Tính nồng độ của chất Y có trong mẫu sữa chua.
ii. Tính pH của dung dịch mẫu sữa chua, biết hằng số phân li acid của Y là 1,4.10-4 (ở 25°C).
c) Phô mai Emmental (Emmental Cheese) có màu vàng và nổi tiếng bởi những lỗ hỗng rất lớn bên trong khối phô mai đặc (hình bên). Quá trình hóa học xảy ra trong qui trình sản xuất để tạo ra các lỗ hỗng trong loại phô mai trên như sau: Lactose (C12H22O11, đường sữa) là một disaccharide bị thủy phân (nhờ vi khuẩn sinh lactic acid) tạo sản phẩm cuối cùng là Y (phản ứng 1). Y bị chuyển hoá (nhờ vi khuẩn Propionibacterium freudenreichii) thành propanoic acid, ethanoic acid, carbon dioxide và nước (phản ứng 2). Quá trình chuyển hóa sinh ra carbon dioxide làm xuất hiện các bong bóng, tạo thành các lỗ hỗng trong phô mai. Giả thiết quá trình lên men thực hiện ở 21°C và 1 atm; thành phần trong bong bóng là carbon dioxide tinh khiết và chiếm 80% lượng carbon dioxide sinh ra, một bong bóng hình cầu có đường kính 1,5 cm. Cho biết: V = 4πr³/3 với V: thể tích hình cầu và π = 3,14.

i. Viết phương trình hóa học các phản ứng 1 và 2.
ii. Tính khối lượng lactose đã được biến đổi để sinh ra khí carbon dioxide một bong bóng.
Nếu học sinh không làm được câu a) và câu b) thì có thể làm câu c).


thầy chưa đăng đăng hết đáp án hả thầy
Vân đang làm em ạ, nhanh nhất cũng phải mai mới có đầy đủ