[2024 – 2025] Thi học sinh giỏi lớp 12 cụm Chuyên ĐH Vinh – Chuyên Phan Bội Châu
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Thời gian làm bài: 150 phút
⇒ Bảng đáp án phần trắc nghiệm:
| Phần 1 | Phần 2 | 13 | 14 | 15 | 16 | ||
| 1C | 2B | 3C | (a) | S | Đ | Đ | S |
| 4B | 5B | 6A | (b) | S | Đ | S | Đ |
| 7D | 8A | 9B | (c) | Đ | S | Đ | S |
| 10A | 11A | 12C | (d) | S | S | Đ | Đ |
| Phần 3 | Câu 17 | 50% | Câu 18 | 59,2% |
A. Phần trắc nghiệm:
Phần 1: Câu hỏi trắc nghiệm nhiều phương án lựa chọn (3,0 điểm).
(Xem giải) Câu 1. Phát biểu nào sau đây là đúng?
A. HCl có phân tử khối cao hơn HF nên có nhiệt độ sôi cao hơn.
B. Phân tử CO2 ít tan trong nước là do hai liên kết C=O không phân cực.
C. Hợp chất Na2SO4 có cả liên kết cộng hóa trị và liên kết ion.
D. Trong phân tử C2H2 có 4 liên kết σ và 2 liên kết π
(Xem giải) Câu 2: Cho E (C3H6O3) và F (C4H6O5) là các chất hữu cơ mạch hở. Trong phân tử chất F chứa đồng thời các nhóm -OH, -COO- và -COOH. Cho các chuyển hóa sau:
(1) E + NaOH (t°) → X + Y
(2) F + NaOH (t°) → X + H2O
(3) X + HCl → Z + NaCl
Biết X, Y, Z là các hợp chất hữu cơ. Cho các phát biểu sau:
(a) Chất X có số nguyên tử oxygen bằng số nguyên tử hydrogen.
(b) Phân tử chất E chứa đồng thời nhóm -OH và nhóm -COOH.
(c) Trong công nghiệp, chất Y được điều chế trực tiếp từ ethylene.
(d) Nhiệt độ sôi của chất Y nhỏ hơn nhiệt độ sôi của ethyl alcohol.
(e) 1 mol chất Z tác dụng với Na dư thu được tối đa 1 mol khí H2.
Số phát biểu đúng là :
A. 4. B. 3. C. 5. D. 2.
(Xem giải) Câu 3: Cho biết phổ hồng ngoại (IR) của chất hữu cơ như hình dưới tương ứng chất nào sau đây:
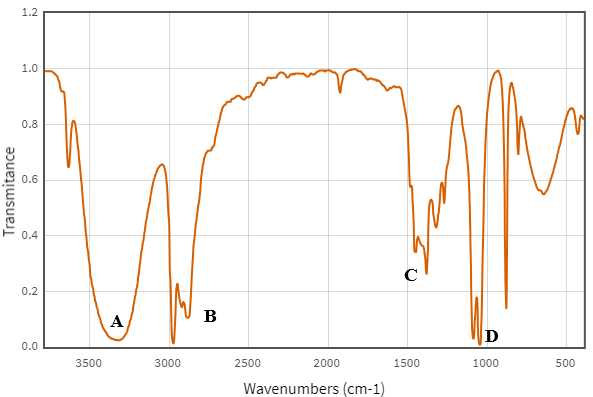
A. CH3COOH. B. CH3COCH3. C. CH3CH2OH. D. CH3CH2CHO
(Xem giải) Câu 4: Cho phản ứng hoá học tổng hợp SO3 trong công nghiệp: 2SO2 (g) + O2 (g) ⇋ 2SO3 (g) ![]() = -197,78 kJ. Cân bằng trên chuyển dịch theo chiều thuận khi
= -197,78 kJ. Cân bằng trên chuyển dịch theo chiều thuận khi
A. tăng nhiệt độ. B. tăng nồng độ O2.
C. giảm áp suất hệ phản ứng. D. thêm xúc tác V2O5.
(Xem giải) Câu 5: Trong phương pháp sắc kí, hỗn hợp lỏng hoặc khí của các chất cần tách là pha động. Pha động tiếp xúc liên tục với pha tĩnh là một chất rắn có diện tích bề mặt rất lớn, có khả năng hấp phụ …(1)… với các chất trong hỗn hợp cần tách, khiến cho các chất trong hỗn hợp di chuyển với tốc độ …(2)… và tách ra khỏi nhau. Cụm từ thích hợp điền vào chỗ trống (1) và (2) lần lượt là
A. (1) giống nhau và (2) giống nhau. B. (1) khác nhau và (2) khác nhau.
C. (1) khác nhau và (2) giống nhau. D. (1) giống nhau và (2) khác nhau.
(Xem giải) Câu 6: X, Y, Z, T là một trong số các dung dịch sau: glucose; fructose; glycerol; phenol. Thực hiện các thí nghiệm để nhận biết chúng và có kết quả như sau
| Chất | Y | Z | X | T |
| Thuốc thử Tollens | Kết tủa bạc trắng | Kết tủa bạc trắng | ||
| Nước Br2 | Nhạt màu | Kết tủa trắng |
Chú ý: Ô để trống là không có hiện tượng xảy ra. Phát biểu nào dưới đây không đúng?
A. Ở điều kiện thường, X tồn tại chủ yếu ở mạch vòng 6 cạnh có nhóm -OH hemiketal.
B. Dung dịch Y có nồng độ 5% dùng để truyền tĩnh mạch.
C. Trong quá trình thủy phân chất béo, có sinh ra chất Z.
D. Chất T ở điều kiện thường ít tan trong nước nhưng tan tốt trong dung dịch NaOH.
(Xem giải) Câu 7: Thực hiện phản ứng sau: CaCO3 + 2HCl → CaCl2 + CO2 + H2O. Theo dõi và ghi lại thể tích khí CO2 thoát ra theo thời gian, thu được đồ thị như sau (Thể tích khí đo được ở áp suất khí quyển và nhiệt độ phòng).
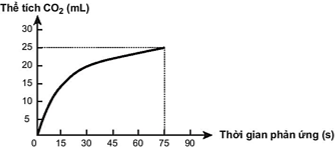
Trong các phát biểu sau, phát biểu nào không đúng?
A. Ở thời điểm 90 giây, tốc độ phản ứng bằng 0.
B. Khi phản ứng hóa học xảy ta, tốc độ phản ứng giảm dần theo thời gian.
C. Tốc độ trung bình của phản ứng trong khoảng thời gian từ thời điểm đầu đến 75 giây là 0,33 mL/s.
D. Tốc độ trung bình của phản ứng trong các khoảng thời gian 15 giây là như nhau.
(Xem giải) Câu 8: Để xác định nồng độ dung dịch NaOH người ta tiến hành như sau: cân 1,26 gam axit oxalic ngậm nước (H2C2O4.2H2O) hòa tan hoàn toàn vào nước, định mức thành 100 ml. Lấy 10 ml dung dịch này thêm vào đó vài giọt phenolphthalein, đem chuẩn độ bằng dung dịch NaOH đến xuất hiện màu hồng (ở pH = 9) (acid đã bị trung hòa hết) thì hết 17,5 ml dung dịch NaOH. Tính nồng độ dung dịch NaOH đã dùng.
A. 0,114M B. 0,26M C. 0,124M D. 0,16M
(Xem giải) Câu 9: Tiến hành thí nghiệm phản ứng xà phòng hóa theo các bước sau đây:
Bước 1: Cho vào bát sứ khoảng 1 gam mỡ (hoặc dầu thực vật) và 2 – 2,5 mL dung dịch NaOH 40%.
Bước 2: Đun hỗn hợp sôi nhẹ và liên tục khuấy đều bằng đũa thủy tinh. Thỉnh thoảng thêm vài giọt nước cất để giữ cho thể tích của hỗn hợp không đổi.
Bước 3: Sau 8 – 10 phút, rót thêm vào hỗn hợp 4 – 5 mL dung dịch NaCl bão hòa nóng, khuấy nhẹ.
Phát biểu nào sau đây sai?
A. Phần chất lỏng sau khi tách hết xà phòng hòa tan Cu(OH)2 thành dung dịch màu xanh lam.
B. Nên thay bát sứ bằng xoong nhôm hoặc chén nhôm để quá trình sản xuất xà phòng đạt hiệu suất cao hơn.
C. Ở bước 2, xảy ra phản ứng thủy phân chất béo, tạo thành glycerol và muối sodium của acid béo
D. Sau bước 3, thấy có một lớp dày đóng bánh màu trắng nổi lên trên, lớp này là muối của acid béo hay còn gọi là xà phòng.
(Xem giải) Câu 10: Cẩm tú cầu là loài hoa được trồng nhiều nhất ở Sa Pa và Đà Lạt. Màu của loài hoa này thay đổi tùy thuộc vào pH của đất, nên có thể điều chỉnh màu hoa thông qua việc điều chỉnh độ pH của đất như sau:
| pH đất trồng | < 7 | = 7 | > 7 |
| Hoa sẽ có màu | Lam | Trắng sữa | Hồng |
Khi trồng hoa trên, nếu ta bón thêm ít vôi (CaO) và chỉ tưới nước thì khi thu hoạch hoa sẽ
A. Có màu hồng. B. Có đủ cả 3 màu lam, trắng, hồng.
C. Có màu lam. D. Có màu trắng sữa.
(Xem giải) Câu 11: Xét phản ứng sau: 2Mg(s) + O2(g) → 2MgO (s) có ![]() = -1204 kJ. Nhiệt phản ứng khi đốt cháy 2,4 gam Mg theo phản ứng trên là
= -1204 kJ. Nhiệt phản ứng khi đốt cháy 2,4 gam Mg theo phản ứng trên là
A. -60,2 kJ. B. +60,2 kJ. C. +120,4 kJ. D. -120,4 kJ.
(Xem giải) Câu 12: Cho các chất có cùng công thức phân tử C7H8O sau:
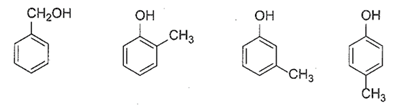
Số chất vừa phản ứng được với Na, vừa phản ứng được với dung dịch NaOH là
A. 1. B. 2. C. 3. D. 4.
Phần 2: Câu hỏi trắc nghiệm dạng Đúng/Sai (4,0 điểm).
(Xem giải) Câu 13. PETN (pentaerythritol tetranitrate, công thức hóa học: C(CH2ONO2)4) là một trong số những chất nổ mạnh nhất đã biết, nó nhạy nổ ma sát và nhạy nổ chấn động hơn TNT, không bao giờ sử dụng một mình làm thuốc dẫn nổ. PETN ban đầu được dùng làm thuốc dẫn nổ và thuốc nổ chính của đạn nhỏ, nay nó được dùng làm thuốc nổ sau trong kíp nổ, được dùng làm thuốc lõi của dây truyền nổ. PETN cũng được sử dụng y học như một thuốc giãn mạch trong điều trị bệnh tim. Những loại thuốc này hoạt động bằng cách giải phóng tín hiệu khí nitric oxide trong cơ thể. Thuốc tim Lentonitrat gần như là PETN tinh khiết. Năng lượng nổ của PETN là 5,8 MJ/kg.
a) Trong phản ứng phân hủy nổ của PETN, cứ 1 gam PETN tạo ra 0,784 L hơi (CO2, CO, N2, H2O) ở đkc.
b) Khi phân hủy nổ, 1 gam PETN tạo ra lượng nhiệt nhiều hơn lượng nhiệt tạo ra khi đốt cháy 1 gam butane (biết 30% năng lượng nổ của PETN chuyển thành nhiệt, còn lại là sóng xung kích; đốt cháy 1 mol butane tỏa ra nhiệt lượng 2875 kJ)
c) Để sản xuất 1 kg PETN từ pentaerythritol (C(CH2OH)4) và HNO3 đặc (H2SO4 đặc xúc tác), hiệu suất 80% cần 0,538 kg alcohol.
d) Thuốc tim Lentonitrat 7% chứa PETN và 7% sáp. Để sản xuất 100 gam thuốc Lentonitrat cần 7 gam PETN.
(Xem giải) Câu 14. Các dữ kiện nhiệt động học của các chất ở 298K và 1 atm được cho trong bảng sau:
| Chất | Kí hiệu | |
| Oxygen (g) | O2 | 0,0 |
| Ozone (g) | O3 | 143 |
| Than chì (s) | Ctc | 0,0 |
| Kim cương (s) | Ckc | 1,9 |
Biết phân tử ozone có dạng gấp khúc. Các nhận định sau đúng hay sai:
a) Oxygen và than chì là đơn chất bền nhiệt động nhất ở điều kiện tiêu chuẩn
b) Phản ứng tạo thành kim cương từ than chì và ozone từ oxygen đều là phản ứng thu nhiệt
c) Mỗi mol than chì cháy trong ozone tỏa nhiệt nhiều hơn 143 kJ khi cháy trong oxygen (đều tạo thành CO2)
d) Liên kết giữa 2 nguyên tử oxygen trong phân tử O3 bền hơn trong phân tử O2
(Xem giải) Câu 15. Trong công nghiệp, acid HCl được sản xuất theo mô hình dưới đây:
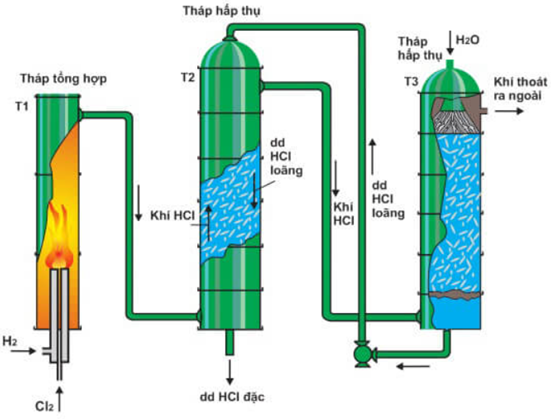
a) Để thu được 1 tấn dung dịch HCl 37% cần 0,4797 tấn khí Cl2 với hiệu suất tổng là 75%
b) Khí thoát ra tại tháp hấp thụ T3 hoàn toàn không chứa HCl
c) Thiết kế tuần hoàn dung dịch HCl và khí HCl nhằm tăng hiệu suất phản ứng tổng hợp
d) Tại tháp hấp thụ, sự di chuyển dung dịch và khí HCl ngược chiều giúp tăng khả năng hòa tan khí.
(Xem giải) Câu 16. Saccharine (hình bên) là một phụ gia tạo ngọt nhân tạo (kí hiệu E954i) có độ ngọt của saccharin cao hơn đường saccharose 300 lần nhưng ở nồng độ cao saccharine có dư vị của kim loại. Saccharine có trong các sản phẩm như đồ uống giải khát, kẹo, bánh bích quy, thuốc chữa bệnh, kem đánh răng…Saccharine không bị hấp thu bởi hệ tiêu hóa, không gây ảnh hưởng tới hàm lượng insulin trong máu, không tạo năng lượng. Nhà hóa học Fahlberg đã tạo ra saccharine phản ứng của acid o-sunfobenzoic (o-HOSO2-C6H4-COOH) với phosphor pentaclorua (PCl5) và amonia.
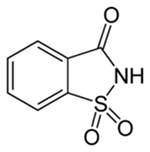
a) Saccharine thuộc loại monosaccharide, còn gọi là đường hóa học.
b) Một sản phẩm bánh cần 1 kg đường ăn (90% tinh khiết) chỉ cần 3g saccharine thay thế để tạo độ ngọt tương đương
c) Sử dụng saccharine gây nguy hiểm cho sức khỏe vì cơ thể không hấp thu được.
d) Trong phản ứng tổng hợp saccharine của Fahlberg, có thể thay thế PCl5 bằng chất hút nước khác.
Phần III: Câu hỏi trắc nghiệm trả lời ngắn
(Xem giải) Câu 17: Methyl cinnamate là một ester có công thức phân tử C10H10O2 và có mùi thơm của dâu tây (strawberry) được sử dụng trong ngành công nghiệp hương liệu và nước hoa. Để điều chế 16,2 gam ester methyl cinnmate người ta cho 29,6 gam cinnamic acid (C6H5-CH=CH-COOH) phản ứng với lượng dư methyl alcohol (CH3OH). Hiệu suất phản ứng ester hóa bằng bao nhiêu phần trăm?
(Xem giải) Câu 18: Độ tan của CuSO4 khan ở 10°C là 17,4 gam. Người tan hòa tan 100 gam một loại tinh thể CuSO4 đã để lâu ngoài không khí vào 200 mL nước (D = 1 g/mL) rồi làm lạnh dung dịch xuống 10°C thì có 30 gam tinh thể CuSO4.5H2O kết tinh. Xác định độ tinh khiết (% khối lượng tinh khết) của loại tinh thể đã dùng ở trên.
B. PHẦN TỰ LUẬN (12 ĐỂM)
Câu 1 (3,0 điểm): Cơ sở hóa học.
(Xem giải) 1. Thực hiện phản ứng hóa học sau:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Theo dõi thể tích CO2 thoát ra theo thời gian, thu được đồ thị như hình bên (thể tích khí được đo ở áp suất khí quyển và nhiệt độ phòng).

a. Nhìn đồ thị cho biết tốc độ phản ứng biến đổi như thế nào theo thời gian?
b. Tính tốc độ trung bình của phản ứng (mL/s) trong khoảng thời gian từ ban đầu đến 75 giây.
c. Thời gian cần để hoà tan hết một mẫu CaCO3 trong dung dịch HCl được biểu diễn ở bảng sau:
| Nhiệt độ (oC) | 20 | 40 | 55 |
| Thời gian (phút) | 27 | 3 | t |
Tính giá trị t.
(Xem giải) 2. Nhỏ vài giọt dung dịch phenolphthalein vào dung dịch Na2CO3 0,10M, thu được dung dịch X.
a. Dung dịch X có màu gì? Tại sao?
b. Màu của dung dịch X biến đổi như nào trong hai thí nghiệm sau:
Thí nghiệm 1: Cho từ từ đến dư dung dịch NaHSO4 0,10M vào dung dịch X.
Thí nghiệm 2: Cho vài giọt dung dịch NH3 0,10M vào dung dịch X.
(Xem giải) 3. Một loại xăng X có thành phần phần trăm về thể tích của các chất như sau: 30% heptane, 40% octane và 30% nonane. Biết khối lượng riêng và nhiệt lượng toả ra khi đốt cháy hoàn toàn 1 mol mỗi chất có trong thành phần của xăng X như trong bảng sau:
| Chất | Heptane | Octane | Nonane |
| Nhiệt lượng (kJ/mol) | 4816,5 | 5470,5 | 6170,8 |
| Khối lượng riêng (gam/mL) | 0,684 | 0,703 | 0,718 |
a. Tính nhiệt lượng toả ra khi đốt cháy hoàn toàn 10 lít xăng X.
b. Cho biết biểu thức tính hiệu suất của động cơ đốt trong (như động cơ của xe máy, ô tô, xe lửa, máy bay, tên lửa, …) là: H = A/Q. Trong đó: A là công có ích mà động cơ thực hiện (J); Q là nhiệt lượng mà nhiên liệu đốt cháy toả ra (J). Một ô tô Y sử dụng xăng X để chạy. Hiệu suất của động cơ ô tô Y là 30%. Trung bình, khi chạy được 1 km thì ô tô Y thực hiện một công có ích bằng 1400 kJ. Tính quãng đường mà ô tô Y chạy được khi tiêu thụ hết 10 lít xăng X. Giả thiết chỉ xảy ra phản ứng đốt cháy hoàn toàn xăng X bởi khí oxygen khi động cơ hoạt động.
c. Để tránh ô nhiễm môi trường khi sử dụng các loại xe chạy bằng xăng thì người ta đã nghiên cứu và sản xuất ra các loại xe chạy bằng nhiên liệu khí hydrogen. Để chạy được 100 km, thì ô tô Z cần tiêu thụ hết bao nhiêu lít khí hydrogen (ở điều kiện chuẩn)? Biết khi đốt cháy hoàn toàn 1 mol khí hydrogen thì toả ra một nhiệt lượng bằng 241,8 kJ; hiệu suất động cơ ô tô Z là 60%; trung bình, khi chạy được 1 km thì ô tô Z thực hiện một công có ích bằng 900 kJ. Giả thiết chỉ xảy ra phản ứng đốt cháy hoàn toàn khí hydrogen bởi khí oxygen khi động cơ hoạt động.
Câu 2 (3,0 điểm): Hóa học vô cơ.
(Xem giải) 1. Ở các khu vực đô thị và công nghiệp, sulfur dioxide chủ yếu được sinh ra từ quá trình đốt nhiên liệu có chứa tạp chất sulfur (than đá, dầu mỏ), đốt quặng sulfide (galen, blend) trong luyện kim, đốt sulfur và quặng pyrite trong sản xuất sulfuric acid, …Em hãy:
a. Giải thích vì sao khí sulfur dioxide là một trong những tác nhân gây mưa acid và mưa acid ăn mòn các công trình xây dựng, kiến trúc bằng đá, bằng thép?
b. Đề xuất một số biện pháp nhằm cắt giảm sự phát thải khí sulfur dioxide vào khí quyển.
c. Cho biết trong hai chất: H2SO4 đặc, CaO khan thì chất nào được dùng để làm khô khí SO2. Giải thích sự lựa chọn đó.
(Xem giải) 2. Trong phòng thí nghiệm, một khí hydrogen halide (HX) được điều chế theo phản ứng sau:
NaX (khan) + H2SO4 (đặc) → HX↑ + NaHSO4 (hoặc Na2SO4)
a. Cho biết HX là chất nào trong các chất sau: HCl, HBr, HI. Giải thích.
b. Có thể dùng dung dịch NaX và H2SO4 loãng để điều chế HX theo phản ứng trên được không. Giải thích
(Xem giải) 3. Sau mùa thu hoạch, người nông dân cần phải bón phân cung cấp dinh dưỡng cho đất gồm 60,08 kg nitrogen, 23,13 kg phosphorus và 12,48 kg potassium. Sau khi đã bón cho mảnh vườn 188 kg loại phân bón trên bao bì có ghi NPK (16-16-8) thì để cung cấp dinh dưỡng cho đất người nông dân tiếp tục bón thêm cho đất trồng đồng thời x kg phân đạm chứa 98,5% (NH2)2CO (thành phần còn lại là các tạp chất không chứa nitrogen) và y kg superphosphate kép chứa 69,62% Ca(H2PO4)2 (thành phần còn lại là các tạp chất không chứa phosphorus). Tính giá trị của (x + y)?
Câu III (3,5 điểm): Hóa học hữu cơ.
(Xem giải) 1. Cho ba chất hữu cơ mạch hở E, F, G có cùng dạng công thức là CnH2nO3. Các chất E, F, G tham gia phản ứng theo đúng tỉ lệ mol như sơ đồ dưới đây:
E + NaOH (t°) → X + Y
F + NaOH (t°) → X + Z
G + NaOH (t°) → M + Z
M + HCl → T + NaCl
Biết: X, Z, M, T là các chất hữu cơ và ME < MF < MG < 105. T là sản phẩm sinh ra khi lên men lactic của glucose.
a. Biện luận công thức các chất trong sơ đồ trên và hoàn thành các phương trình hóa học.
b. Viết phương trình hóa học của T phản ứng với Na, dung dịch NaOH theo tỉ lệ tối đa.
(Xem giải) 2. Hợp chất X có tác dụng kháng khuẩn, chống vi sinh vật kí sinh trên da (chấy, rận,…). X có công thức phân tử C7H8O và có chứa vòng benzene, phổ IR của X có peak hấp thụ rộng ở vùng 3300 cm-1. Oxi hóa X bằng CuO nung nóng, thu được hợp chất Y có peak hấp thụ đặc trưng ở khoảng 1700 cm-1.
a. Biện luận công thức cấu tạo, đọc tên X, Y.
b. Viết phương trình hóa học hoàn thành sơ đồ phản ứng sau: (mỗi mũi tên là một PTHH, ghi rõ điều kiện phản ứng (nếu có))
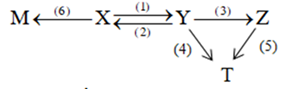
Biết Z là carboxylic acid, T là muối sodium của Z, M là ester của Z.
(Xem giải) 3. Poly(vinyl chloride) (PVC) là polymer có tính dẻo, được dùng để sản xuất giày ủng, rèm nhựa, khung cửa, sàn nhựa, ống nước, vỏ cáp dây điện, vải giả da, …Trong công nghiệp sản xuất chất dẻo, poly(vinyl chloride) được điều chế theo sơ đồ sau:
![]()
Trung bình, mỗi ống nước dài 4m có khối lượng 1 kg. Từ 3,2 tấn methane, với hiệu suất mỗi quá trình (1), (2), (3) lần lượt là 50%, 55%, 60% thì sản xuất được bao nhiêu ống nước PVC dài 4 m? Biết rằng toàn bộ lượng PVC thu được ở trên được dùng để sản xuất ống nước.
(Xem giải) Câu IV (1,0 điểm): Tổng hợp vô cơ.
Quy trình sản xuất nitricic acid theo phương pháp Ostwald gồm 3 giai đoạn. Em hãy viết các phương trình hóa học xảy ra trong 3 giai đoạn đó? Xác định chất khử trong từng phương trình hóa học.
Câu V (1,5 điểm): Tổng hợp hữu cơ.
Giấm ăn được dùng phồ biến trong chế biến thực phẩm, có chứa acetic acid với hàm lượng về thể tích.
(Xem giải) 1. Để sản xuất giấm ăn người ta dùng phương pháp lên men; nhờ vi khuẩn acetobacter (men giấm) chuyển hóa ethanol thành acetic acid bởi oxygen trong không khí. Người ta cần dùng V mL dung dịch ethanol 12° để sản xuất được 200 chai giấm ăn thể tích 500 mL có hàm lượng acetic acid là 5% về thể tích. Biết hiệu suất của phản ứng lên men giấm tính theo ethanol là x%. Tính giá trị của x và V.
(Xem giải) 2. Để xác định hàm lượng của acetic acid trong một loại giấm ăn, một học sinh pha loãng loại giấm ăn đó 10 lần rồi tiến hành chuần độ 10 mL giấm ăn sau pha loãng bằng dung dịch NaOH 0,1M, thu được kết quả như bảng sau:
| Lần | Lần 1 | Lần 2 | Lần 3 |
| Vdd NaOH (mL) | 10,5 | 10,4 | 10,6 |
Tính hàm lượng % về thể tích acetic acid có trong loại giấm đó; biết trong thành phần giấm ăn chỉ có acetic acid phản ứng với NaOH.
Biết: Khối lượng riêng của ethanol nguyên chất, nước và acetic acid lần lượt là 0,8 gam/mL; 1 g/mL và 1,05 g/mL.

Bình luận