[2025 – 2026] Thi học sinh giỏi lớp 12 – Tỉnh Phú Thọ (Đề tham khảo)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 003-H12B năm 2025-2026
⇒ Thời gian làm bài: 150 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1A | 2B | 3D | 4C | 5C | 6D | 7C | 8C |
| 9C | 10B | 11B | 12B | 13B | 14A | 15B | 16D |
| 17C | 18B | 19C | 20B | 21C | 22D | 23A | 24A |
| 25A | 26B | 27D | 28D | 29B | 30B | 31C | 32A |
| Câu 1 | Câu 2 | Câu 3 | Câu 4 | Câu 1 | Câu 2 | Câu 3 | ||
| (a) | Đ | Đ | S | Đ | 0,13 | 4 | 10 | |
| (b) | S | S | S | S | ||||
| (c) | Đ | S | Đ | S | Câu 4 | Câu 5 | Câu 6 | |
| (d) | S | Đ | Đ | Đ | 4 | 4 | 1345 | |
I. PHẦN TRẮC NGHIỆM
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn (8,0 điểm). Thí sinh trả lời từ câu 1 đến câu 32. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Cho phản ứng: 10FeSO4 + 2KMnO4 + 8H2SO4 → K2SO4 + 2MnSO4 + 5Fe2(SO4)3 + 8H2O. Phát biểu nào về phản ứng đã cho sau đây sai?
A. Iron(II) bị khử thành iron(III).
B. KMnO4 là chất oxi hóa.
C. H2SO4 đóng vai trò là môi trường acid.
D. Trong thực tế, phản ứng được dùng để xác định hàm lượng FeSO4.
(Xem giải) Câu 2. Cho phản ứng: FeS + H2SO4 → Fe2(SO4)3 + SO2 + H2O. Trong phản ứng trên, 1 phân tử FeS đã nhường bao nhiêu electron?
A. 6. B. 7. C. 8. D. 9.
(Xem giải) Câu 3. Xét hai phản ứng sau:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ![]() = -890 kJ
= -890 kJ
CH3OH(g) + O2(g) → CO2(g) + 2H2O(l) ![]() = -726 kJ
= -726 kJ
Phát biểu nào sau đây sai?
A. Hai phản ứng trên là các phản ứng tỏa nhiệt.
B. Đốt cháy hoàn toàn 16 gam methane tỏa ra lượng nhiệt là 890 kJ.
C. Đốt cháy hoàn toàn 0,5 mol methanol tỏa ra 363 kJ nhiệt lượng.
D. Đốt cháy hoàn toàn 1,0 mol methanol tỏa ra lượng nhiệt nhiều hơn đốt 1,0 mol methane.
(Xem giải) Câu 4. Cho các phản ứng sau:
(1) H2(g) + I2(g) → 2HI(g)
(2) N2(g) + 3H2(g) → 2NH3(g)
(3) CO2(g) + Ca(OH)2(aq) → CaCO3(s) + H2O(l)
(4) CaO(s) + SiO2(s) → CaSiO3(s)
(5) AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)
Áp suất có ảnh hưởng đến tốc độ của bao nhiêu phản ứng?
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 5. Quá trình hoà tan bột đồng bởi dung dịch sulfuric acid đặc sẽ sinh ra khí sulfur dioxide. Nhằm hạn chế phát tán sulfur dioxide ra môi trường, một số hoá chất có thể sử dụng để hấp thụ khí này. Trong các dung dịch sodium hydroxide, dung dịch nước vôi trong, dung dịch hydrochloric acid, dung dịch brommine, có bao nhiêu dung dịch hấp thụ hoàn toàn được sulfur dioxide?
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 6. Cho các cặp oxi hoá-khử của các kim loại và thế điện cực chuẩn tương ứng:
| Cặp oxi hoá-khử | Li+/Li | Mg2+/Mg | Zn2+/Zn | Ag+/Ag |
| Thế điện cực chuẩn (V) | -3,040 | -2,356 | -0,762 | +0,799 |
Trong các kim loại trên, kim loại có tính khử mạnh nhất là
A. Mg. B. Zn. C. Ag. D. Li.
(Xem giải) Câu 7. Nhúng thanh kẽm và thanh đồng vào dung dịch H2SO4 loãng, nối hai thanh lại với nhau bằng dây dẫn. Phát biểu nào sau đây đúng?
A. Thanh Zn bị mòn dần, đồng thời xuất hiện dòng electron di chuyển từ cathode sang anode.
B. Cực âm gọi là cathode, tại đây xảy ra quá trình nhường electron.
C. Khí thoát ra ở hai điện cực là khí hydrogen.
D. Nếu không có sợi dây dẫn nối hai điện cực với nhau thì thanh kẽm sẽ không bị ăn mòn.
(Xem giải) Câu 8. Điện phân dung dịch CuSO4 0,02 mol/L bằng các điện cực trơ ở hiệu điện thế thích hợp đến khi ở cathode bắt đầu sủi bọt khí thì dừng lại, thu được dung dịch X có nồng độ ion H+ là x mol/L. Coi thể tích dung dịch thay đổi không đáng kể. Giá trị của x là
A. 0,01. B. 0,02. C. 0,04. D. 0,08.
(Xem giải) Câu 9. Thực hiện các thí nghiệm sau:
(a) Đun sôi dung dịch Mg(HCO3)2.
(b) Cho dung dịch NaHCO3 vào dung dịch CaCl2 đun nóng.
(c) Cho dung dịch KHSO4 vào dung dịch Ba(HCO3)2.
(d) Sục khí CO2 đến dư vào dung dịch Ca(OH)2.
(e) Cho NaOH dư vào dung dịch Ca(HCO3)2.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là
A. 5. B. 2. C. 4. D. 3.
(Xem giải) Câu 10. Phản ứng nhiệt phân muối nitrate của kim loại nhóm IIA xảy ra theo phương trình: M(NO3)2(s) (t°) → MO(s) + 2NO2(g) + ½O2(g)  . Cho biến thiên enthalpy chuẩn của phản ứng nhiệt phân trong bảng sau:
. Cho biến thiên enthalpy chuẩn của phản ứng nhiệt phân trong bảng sau:
| Muối | Mg(NO3)2(s) | Ca(NO3)2(s) | Sr(NO3)2(s) | Ba(NO3)2(s) |
 (kJ) (kJ) |
255,2 | 369,5 | 452,4 | 506,2 |
Phát biểu nào sau đây sai?
A. Trong các phản ứng nhiệt phân trên, muối nitrate vừa là chất oxi hóa, vừa là chất khử.
B. Độ bền nhiệt giảm dần từ Mg(NO3)2(s) đến Ba(NO3)2(s).
C. Các muối carbonate của kim loại nhóm IIA cũng bị nhiệt phân hủy thành oxide.
D. Phản ứng nhiệt phân muối nitrate của kim loại nhóm IIA là phản ứng thu nhiệt.
(Xem giải) Câu 11. Phát biểu nào sau đây sai?
A. Điện phân dung dịch CuSO4 thu được kim loại Cu ở cathode.
B. Cho dung dịch NaOH dư vào dung dịch ZnSO4 thu được kết tủa.
C. Cho dung dịch KOH vào dung dịch Ca(HCO3)2 thu được kết tủa.
D. Cho dung dịch BaCl2 vào dung dịch KHSO4 thu được kết tủa.
(Xem giải) Câu 12. Để tìm hiểu tính chất của sulfuric acid, người ta tiến hành các thí nghiệm sau:
• Thí nghiệm 1: Cho 1 mL dung dịch sulfuric acid đậm đặc vào ống nghiệm đựng 5 mL dung dịch barium chloride 0,1M thấy có kết tủa trắng xuất hiện.
• Thí nghiệm 2: Cho một mẩu kim loại đồng vào ống nghiệm chứa 2 mL dung dịch sulfuric acid đậm đặc, đun nóng thì thấy dung dịch chuyển sang màu xanh, có khí T mùi hắc thoát ra.
• Thí nghiệm 3: Cho một ít tinh thể hợp chất Y vào cốc thuỷ tinh, sau đó nhỏ từ từ 1 đến 2 mL dung dịch sulfuric acid đậm đặc vào cốc thì thấy màu trắng của Y chuyển sang màu vàng, sau đó chuyển sang màu nâu và cuối cùng thành khối xốp màu đen bị bọt khí đẩy lên miệng cốc.
Cho các phát biểu sau:
(a) Nếu thay dung dịch sulfuric acid đậm đặc bằng dung dịch sulfuric acid loãng thì hiện tượng các thí nghiệm trên không thay đổi.
(b) Nếu toàn bộ lượng khí T thoát ra trong thí nghiệm 2 đem hấp thụ hoàn toàn vào dung dịch nước vôi trong dư, sau phản ứng thu được 1,2 gam kết tủa thì lượng đồng cần dùng tối thiểu là 0,64 gam.
(c) Kết tủa trắng trong thí nghiệm 1, không tan trong nước và không tan trong dung dịch acid thông thường.
(d) Khí (T) thoát ra trong thí nghiệm 2 có thể làm vẩn đục nước vôi trong và làm mất màu dung dịch bromine.
(e) Thí nghiệm 3 dùng để chứng minh sulfuric acid đậm đặc có tính háo nước và hiện tương trên được gọi là hiện tượng than hóa.
Số phát biểu đúng là
A. 3. B. 4. C. 5. D. 6.
(Xem giải) Câu 13. Pent-1-ene và dipentyl ether đồng thời được sinh ra khi đun nóng pentan-1-ol với dung dịch H2SO4 đặc. Biết rằng nhiệt độ sôi của pentan-1-ol, pent-1-ene và dipentyl ether lần lượt là 137,8°C; 30,0°C và 186,8°C. Từ hỗn hợp phản ứng, các chất được tách khỏi nhau bằng phương pháp chưng cất. Các phân đoạn thu được (theo thứ tự từ trước đến sau) trong quá trình chưng cất lần lượt là
A. pentan-1-ol, pent-1-ene và dipentyl ether. B. pent-1-ene, pentan-1-ol và dipentyl ether.
C. dipentyl ether, pent-1-ene và pentan-1-ol. D. pent-1-ene, dipentyl ether và pentan-1-ol.
(Xem giải) Câu 14. Có bốn đồng phân alkene X1, X2, X3, X4 tương ứng với công thức phân tử C4H8. Trong đó X1, X2 và X3 tác dụng với hydrogen (xúc tác Ni, đun nóng), thu được sản phẩm giống nhau; X1 và X2 tác dụng với bromine cho sản phẩm giống nhau. X3 và X4 lần lượt là
A. But-1-ene và 2-methylpropene. B. Trans-but-2-ene và cis-but-2-ene.
C. 2-methylpropene và but-1-ene. D. Cis-but-2-ene và trans-but-2-ene.
(Xem giải) Câu 15. Geraniol có mùi thơm của hoa hồng và thường được sử dụng trong sản xuất nước hoa. Công thức của geraniol như hình dưới đây:
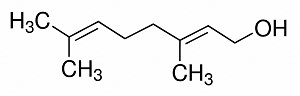
Cho các phát biểu sau về geraniol:
(a) Công thức phân tử của geraniol có dạng CnH2n-3OH.
(b) Tên gọi của geraniol là cis-3,7-dimethylocta-2,6-diene-1-ol.
(c) Geraniol là alcohol thơm, đơn chức.
(d) Oxi hóa geraniol bằng CuO, đun nóng thu được một aldehyde.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 16. Để phân biệt ba hợp chất HCHO, CH3CHO, CH3COCH3, một học sinh tiến hành thí nghiệm thu được kết quả sau:
| Chất | (1) | (2) | (3) |
| Tollens | + | – | + |
| I2/NaOH | – | + | + |
(dấu + là có phản ứng, dấu – là không phản ứng)
Ba chất (1), (2), (3) lần lượt là
A. HCHO, CH3CHO, CH3COCH3. B. CH3CHO, HCHO, CH3COCH3.
C. CH3CHO, CH3COCH3, HCHO. D. HCHO, CH3COCH3, CH3CHO.
(Xem giải) Câu 17. Cho 7,50 gam hydrocarbon không no, mạch hở X (có lẫn các tạp chất trơ khác) phản ứng với bromine thì dung dịch bị nhạt màu, thu được hợp chất Y. Thủy phân hoàn toàn Y với dung dịch NaOH thì thu được 10,4 gam glycol (hợp chất Z), chứa 30,77% oxygen về khối lượng. Glycol là các alcohol có chứa hai nhóm hydroxy. Giả sử các phản ứng diễn ra hoàn toàn.
Phát biểu nào sau đây đúng?
A. Công thức phân tử Z là C4H10O2.
B. Hàm lượng X trong mẫu hydrocarbon ban đầu là 6,67%.
C. Từ X tổng hợp được Z bằng một phản ứng hóa học.
D. Dung dịch Z không hòa tan được Cu(OH)2.
(Xem giải) Câu 18. Đun nóng ester X (C4H6O2) với dung dịch NaOH, thu được aldehyde acetic. Công thức cấu tạo của X là
A. HCOOCH=CH-CH3. B. CH3COOCH=CH2.
C. HCOOC(CH3)=CH2. D. CH2=CHCOOCH3.
(Xem giải) Câu 19. Xà phòng, chất giặt rửa được sử dụng rộng rãi trong đời sống: rửa tay, giặt quần áo, rửa chén bát, lau sàn,… Sơ đồ dưới đây mô tả cơ chế giặt rửa của xà phòng và các chất giặt rửa:
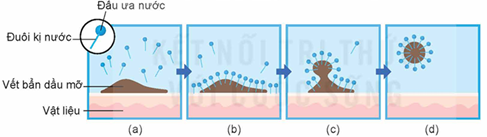
Cho các phát biểu sau:
(a) Các chất CH3[CH2]10CH2C6H4SO3Na và CH3[CH2]10CH2OSO3Na là chất giặt rửa tổng hợp.
(b) Cấu tạo của xà phòng và chất giặt rửa phổ biến thường gồm hai phần: đầu ưa nước là nhóm carboxylate (xà phòng) hoặc nhóm sulfate, sulfonate (chất giặt rửa tổng hợp) và đuôi kị nước là gốc hydrocarbon mạch dài tan nhiều trong nước.
(c) Khi xà phòng, chất giặt rửa tan vào nước sẽ tạo dung dịch có sức căng bề mặt nhỏ làm cho vật cần giặt rửa dễ thấm ướt. Đuôi kị nước trong xà phòng và chất giặt rửa thâm nhập vào vết bẩn (Hình c), phân chia vết bẩn thành những hạt rất nhỏ có đầu ưa nước quay ra ngoài (Hình b), các hạt này phân tán vào nước và bị rửa trôi (Hình d).
(d) Chất giặt rửa tổng hợp bị giảm hoặc mất tác dụng giặt rửa khi dùng với nước cứng vì tạo kết tủa với cation Ca2+, Mg2+.
(e) Xà phòng dễ bị các vi sinh vật phân hủy nên thân thiện với môi trường.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 20. Ester X có mùi thơm của dứa và được sử dụng trong tổng hợp dược phẩm. Kết quả phân tích cho thấy X có %C = 62,07%, %H = 10,35% (về khối lượng), còn lại là oxygen. Trên phổ MS của X thấy xuất hiện peak của ion phân tử (M+) có giá trị m/z = 116. Thực hiện phản ứng xà phòng hóa X thu được C2H5OH. Cho các phát biểu sau:
(a) X là ester no, hai chức.
(b) X có công thức phân tử là C5H10O2.
(c) Tên của X là ethyl propionate.
(d) Thủy phân X trong môi trường acid, hỗn hợp sau phản ứng có 3 chất hữu cơ no, đơn chức, mạch hở.
(e) X ít tan trong nước và có nhiệt sôi cao hơn ethyl acetate.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 21. Cho 2 mL dung dịch saccharose 5% vào ống nghiệm chứa Cu(OH)2 (được điều chế bằng cách cho 0,5 mL dung dịch CuSO4 5% vào 2 mL dung dịch NaOH 10%), lắc nhẹ thì thấy có hiện tượng nào sau đây?
A. Kim loại màu vàng sáng bám trên bề mặt ống nghiệm.
B. Kết tủa màu đỏ gạch xuất hiện trong ống nghiệm.
C. Dung dịch trở nên đồng nhất và có màu xanh lam.
D. Chất lỏng trong ống nghiệm tách thành hai lớp và xuất hiện kết tủa màu xanh nhạt lắng xuống đáy ống nghiệm.
(Xem giải) Câu 22. Rượu gạo là một thức uống có cồn lên men được chưng cất từ gạo theo truyển thống. Rượu gạo được làm từ quá trình lên men tinh bột gạo đã được chuyển thành đường. Vi khuẩn là nguồn gốc của các enzyme chuyển đổi tinh bột thành đường. Nhiệt độ thích hợp để lên men rượu khoảng 20 – 25°C. Phản ứng thủy phân và lên men:
(1) (C6H10O5)n + nH2O → nC6H12O6
(2) C6H12O6 → 2C2H5OH + 2CO2
Phát biểu nào sau đây sai?
A. Phản ứng (2) là phản ứng oxi hóa – khử, do có sự thay đổi số oxi hóa của nguyên tố carbon.
B. Trong phản ứng (2) thì C6H12O6 vừa là chất khử, vừa là chất oxi hóa.
C. Trong phản ứng (1) thì các nguyên tử của mỗi nguyên tố không thay đổi số oxi hóa.
D. Trong phản ứng (2) thì nguyên tử carbon đã nhận 4 electron.
(Xem giải) Câu 23. Để tráng một số lượng gương soi có diện tích bề mặt 0,35 m² với độ dày 0,1 μm người ta đun nóng dung dịch chứa 26,77 gam glucose với lượng dư dung dịch silver nitrate trong ammonia. Biết khối lượng riêng của silver là 10,49 g/cm³, hiệu suất phản ứng tráng bạc là 80% (tính theo glucose). Số lượng gương soi tối đa sản xuất được là
A. 70. B. 80. C. 85. D. 90.
(Xem giải) Câu 24. Cho các amine có công thức cấu tạo sau:
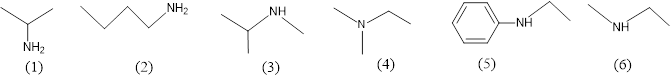
Các chất thuộc loại amine bậc II là
A. (3), (5), (6). B. (1), (3), (4). C. (2), (5), (6). D. (4), (5), (6).
(Xem giải) Câu 25. Insulin là hormone có tác dụng điều tiết lượng đường trong máu. Thủy phân một phần insulin, thu được heptapeptide X mạch hở. Khi thủy phân không hoàn toàn X, thu được hỗn hợp chứa các peptide: Phe-Phe-Tyr, Pro-Lys-Thr, Tyr-Thr-Pro, Phe-Tyr-Thr. Amino acid đầu N và amino acid đầu C của X lần lượt là
A. Phe và Thr. B. Thr và Phe. C. Phe và Lys. D. Tyr và Thr.
(Xem giải) Câu 26. Giá trị pH mà khi đó amino acid có nồng độ ion lưỡng cực là cực đại được gọi là điểm đẳng điện (kí hiệu là pI). Khi pH < pI thì amino acid đó tồn tại chủ yếu ở dạng cation, còn khi pH > pI thì amino acid đó tồn tại chủ yếu ở dạng anion. Khi đặt trong một điện trường, dạng anion sẽ di chuyến về cực dương còn dạng cation sẽ di chuyển về cực âm. Tính chất này được gọi là tính điện di và được dùng để tách, tinh chế amino acid ra khỏi hỗn hợp của chúng. Cho các giá trị pI của glycine (pI = 6,0), glutamic acid (pI = 3,2) và lysine (pI = 9,74). Cho các phát biểu sau:
(a) pH = 6 là tối ưu nhất để tách ba chất trên ra khỏi hỗn hợp.
(b) Trong dung dịch chứa ba chất, ở pH = 3,2 thì glycine di chuyển nhanh nhất về cực dương.
(c) Khi pH thay đổi từ 9,74 đến 2,0 thì dạng ion lưỡng cực của lysine có thể nhận tối đa hai proton.
(d) Ở pH = 2 thì lysine tồn tại ở dạng cation có điện tích là +1.
(e) Ở pH = 9,74, glycine và glutamic acid đều di chuyển về cực dương, trong khi lysine đứng yên. Điều này cho phép tách riêng lysine ra khỏi hỗn hợp.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 5.
(Xem giải) Câu 27. Tơ Sorona được điều chế từ poly(trimethylene terephthalate). Tơ này được sử dụng rộng rãi trong công nghiệp dệt, đặc biệt để sản xuất các loại đồ bơi. Poly(trimethylene terephthalate) được tổng hợp từ hai monomer là terephthalic acid và propane-1,3-diol. Phát biểu nào sau đây sai?
A. Một mắt xích của poly(trimethylene terephthalate) có 11 nguyên tử carbon.
B. Sorona có nhiều nhóm chức ester trong phân tử.
C. Tơ sorona không bền trong môi trường kiềm vì bị thủy phân.
D. Sorona được tổng hợp từ phản ứng trùng hợp hai monomer tương ứng.
(Xem giải) Câu 28. Một nhà máy sản xuất túi nylon, từ HDPE cần sản xuất túi đựng hình chữ nhật (chiều rộng 20 cm, chiều dài 30 cm, bề dày của lớp nylon là 0,02 cm). Biết hiệu suất phản ứng trùng hợp ethylene để điều chế HDPE là 60%, quá trình chuyển nhựa thành túi có hiệu suất là 95% và khối lượng riêng của nhựa HDPE là 0,95 g/cm³. Coi kích thước của túi không thay đổi so với chiều dài và chiều rộng của mỗi mặt nylon. Khối lượng nguyên liệu ethylene dùng để sản xuất đơn hàng 100000 túi trên bằng bao nhiêu tấn?
A. 1,23. B. 2,0. C. 2,28. D. 4,0.
(Xem giải) Câu 29. Diethyl phthalate (còn gọi là DEP) được sử dụng làm thuốc trị ghẻ ngứa, côn trùng đốt. DEP có chứa vòng benzene và hai nhóm thế ở vị trí ortho. DEP được tổng hợp từ hydrocarbon thơm X có công thức phân tử C8H10 theo sơ đồ sau đây:
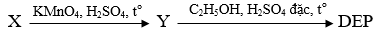
Phát biểu nào sau đây sai?
A. Phân tử khối của DEP là 222.
B. Tên thay thế của X là o-xylene.
C. DEP ít tan trong nước.
D. Trong phân tử chất Y có liên kết hydrogen liên phân tử.
(Xem giải) Câu 30. Aspirin là một hợp chất được sử dụng làm giảm đau, hạ sốt. Sau khi uống, aspirin bị thủy phân trong cơ thể sẽ tạo thành salicylic acid. Salicylic acid ức chế quá trình sinh tổng hợp prostaglandin (chất gây đau, sốt và viêm khi nồng độ trong máu cao hơn mức bình thường).
Phát biểu nào sau đây sai?
A. Công thức phân tử của aspirin là C9H8O4.
B. Thủy phân aspirin trong môi trường base thu được dung dịch chứa một muối.
C. 1 mol salicylic acid tác dụng tối đa với 2 mol NaOH trong dung dịch.
D. Trong phân tử salicylic acid có chứa 4 liên kết π.
(Xem giải) Câu 31. Để tạo ra nhiều loại thuốc nhuộm màu, người ta tìm cách điều chế các chất màu hữu cơ bằng con đường nhân tạo. Khi thay thế nguyên tử hydrogen trong nhóm -OH của thuốc nhuộm quinazarin có màu đỏ bằng nguyên tử kim loại như sodium thì chuyển thành chất nhuộm màu tím quinazarate theo sơ đồ sau:
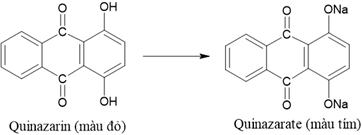
Cho các phát biểu sau:
(a) Sục khí CO2 tới dư vào dung dịch quinazarate thì màu tím chuyển sang màu đỏ.
(b) Quinazarin và quinazarate đều có số nhóm carbonyl bằng nhau.
(c) Trong thực tế, để sản xuất thuốc nhuộm màu tím quinazarate người ta cho quinazarin tác dụng với Na vừa đủ.
(d) Dung dịch quinazarate có pH > 7.
(e) Nhiệt độ sôi của quinazarin lớn hơn nhiệt độ sôi của quinazarate.
Những phát biểu đúng là
A. (b), (c), (d). B. (a), (b), (e). C. (a), (b), (d). D. (b), (c), (e).
(Xem giải) Câu 32. Hợp chất hữu cơ X và Z đều mạch hở, có cùng công thức phân tử là C4H8O2. Cho X tác dụng vừa đủ với dung dịch NaOH, thu được dung dịch Y chứa hai chất hữu cơ Y1 và Y2. Acid hóa Y1 bằng dung dịch H2SO4 loãng, thu được chất hữu cơ Y3, biết Y2 bị oxi hóa bởi oxygen ở điều kiện thích hợp, thu được Y3. Oxi hóa Z bởi CuO đun nóng, thu được chất hữu cơ Z1. Cho 1 mol Z1 phản ứng với lượng dư dung dịch AgNO3 trong NH3 đun nóng, thu được 4 mol Ag. Mặt khác, khử hoàn toàn Z bằng H2 (xúc tác Ni, đun nóng), thu được chất hữu cơ no sau đó đem tách nước hoàn toàn, thu được chất hữu cơ T. Thực hiện phản ứng trùng hợp T, thu được polymer E1 có tính đàn hồi và polymer E2 không có tính đàn hồi. Cho các phát biểu sau:
(a) Các chất Y1 và Y2 có số nguyên tử carbon bằng nhau.
(b) Z1 là hợp chất hữu cơ tạp chức.
(c) Trong mỗi mắt xích của E1 và E2 đều có một liên kết π.
(d) Chất T tác dụng với dung dịch KMnO4 dư ở nhiệt độ thường, thu được chất hữu cơ có khối lượng mol là 122.
(e) Có ba đồng phân thỏa mãn công thức của Z.
Tất cả các phát biểu đúng trong các phát biểu trên là
A. (a), (c), (d), (e). B. (b), (c), (d), (e).
C. (a), (b), (c), (d). D. (a), (c), (d).
PHẦN II. Câu trắc nghiệm đúng sai (4,0 điểm). Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 1. Một học sinh thực hiện thí nghiệm chuẩn độ để xác định nồng độ dung dịch hydrochloric acid (HCl) bằng dung dịch chuẩn sodium hydroxide (NaOH) 0,100 M với chất chỉ thị methyl orange (MO). Biết rằng MO sẽ có màu đỏ trong môi trường có pH < 3,2, màu vàng trong môi trường có pH > 4,4, và màu cam trong khoảng pH từ 3,2 đến 4,4. Để thực hiện chuẩn độ, học sinh này đã cho dung dịch NaOH 0,100 M (trên burette) nhỏ từ từ vào bình tam giác chứa sẵn 10,00 mL dung dịch HCl và 3 giọt dung dịch MO, đến khi dung dịch vừa chuyển sang màu cam thì dừng chuẩn độ. Biết rằng nếu dung dịch chỉ chứa sodium chloride (NaCl) thì có pH bằng 7.
a) Nồng độ thực tế của dung dịch HCl sẽ lớn hơn nồng độ tính được từ kết quả thí nghiệm trên.
b) Có thể cho chất chỉ thị MO vào dung dịch NaOH trong burette thay vì cho vào bình tam giác.
c) Trước khi cho dung dịch NaOH vào burette, cần tráng burette bằng chính dung dịch này.
d) Nếu thể tích dung dịch NaOH 0,100 M đã dùng trong 3 lần chuẩn độ lần lượt là 12,90 mL, 13,00 mL, 13,00 mL thì nồng độ dung dịch HCl xác định được trong thí nghiệm này là 0,389 M.
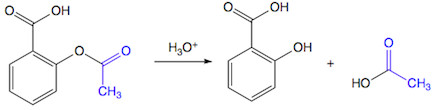
(Xem giải) Câu 2. Từ một loại tinh dầu, người ta tách được chất X chứa 76,92% C; 12,82% H và 10,26% O về khối lượng và MX = 156 g/mol. Biết X được điều chế bằng cách hydrogen hóa xúc tác chất Y là 2-isopropyl-5-methylphenol. Đun nóng X với H2SO4 đặc, thu được hai chất có cùng công thức phân tử là Z và T.
a) X có công thức phân tử là C10H20O.
b) Tính acid của X mạnh hơn của Y.
c) Các chất Z, T đều có đồng phân hình học.
d) X, Y đều phản ứng được với sodium.
(Xem giải) Câu 3. Trong công nghiệp, phenol và acetone được sản xuất từ cumene, khoảng 20% lượng cumene toàn cầu được sản xuất từ benzene. Các phản ứng xảy ra theo sơ đồ sau:
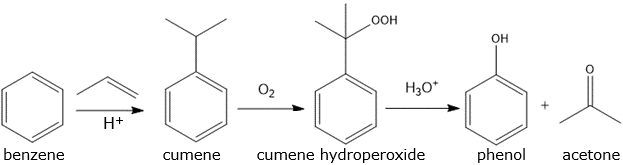
Một nhà máy sản xuất phenol theo sơ đồ trên, từ 1000 m³ benzene (khối lượng riêng bằng 0,879 g. mL⁻¹) thu được 900 tấn phenol. Biết propylene, O2 và dung dịch H2SO4 được lấy dư. Hiệu suất của quá trình sản xuất là h%.
a) Phản ứng tổng hợp cumene từ benzene là phản ứng cộng.
b) Trong quá trình tổng hợp phenol từ cumene, H2SO4 đóng vai trò là chất oxi hóa.
c) Phenol còn được điều chế từ nhựa than đá.
d) Giá trị của h là 85,0 (Kết quả các phép tính trung gian không được làm tròn, chỉ kết quả cuối cùng được làm tròn đến 1 chữ số sau dấu phẩy thập phân).
(Xem giải) Câu 4. EpiGalloCatechin Gallate (EGCG) nổi bật với khả năng chống oxi hóa, có vai trò quan trọng trong việc phòng ngừa và hỗ trợ điều trị nhiều bệnh lý nghiêm trọng (một số loại ung thư, tim mạch, loãng xương, …). Nhờ các đặc tính sinh học quý giá này, EGCG được ứng dụng rộng rãi trong sản xuất thực phẩm chức năng và dược phẩm. EGCG có công thức như hình vẽ bên.
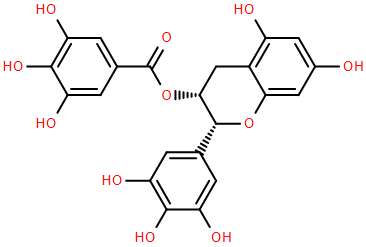
Trong đời sống, việc pha trà xanh (có hàm lượng cao EGCG) bằng nước nóng để sử dụng là một phương pháp đơn giản để hấp thụ EGCG. Tuy nhiên, dịch chiết từ lá trà xanh có tính kém ổn định vì EGCG nhạy cảm với ánh sáng và dễ bị oxi hóa bởi các tác nhân trong môi trường, dẫn đến sự biến chất và làm giảm hiệu quả sinh học của hợp chất. Cho EGCG tác dụng với dung dịch NaOH (dư, đun nóng), sau khi kết thúc phản ứng thu được thu được dung dịch X.
a) Pha trà bằng nước nóng là một ứng dụng của kỹ thuật chiết lỏng – rắn.
b) Phân tử EGCG có 4 loại nhóm chức.
c) EGCG tác dụng tối đa với NaOH trong dung dịch theo tỉ lệ mol tương ứng là 1 : 8.
d) Trong dung dịch X có ba chất tan.
PHẦN III. Câu trắc nghiệm trả lời ngắn (3,0 điểm). Thí sinh trả lời từ câu 1 đến câu 6.
(Xem giải) Câu 1. HCl là một chất được phát hiện trong dịch vị dạ dày có nồng độ 0,0001 – 0,001 mol/l và độ pH duy trì ở mức 3 – 4 đối với người bình thường. Nếu thiếu HCl trong dạ dày thì thức ăn không chuyển hóa được, lâu dần gây suy nhược cơ thể, nếu dư lâu ngày HCl sẽ phá hủy đường ruột gây viêm loét dạ dày. Khi cơ thể dư HCl, có thể uống thuốc muối (thành phần chính là NaHCO3). Giả sử dịch vị dạ dày người bệnh chứa 1,5 lít dung dịch hỗn hợp thức ăn lỏng, trong đó chứa 0,09125 gam HCl. Nếu khả năng tiêu thụ baking soda của cơ thể người bệnh là 65% thì khối lượng baking soda người đó cần đưa vào cơ thể để duy trì độ pH trong dạ dày ở mức 3 là bao nhiêu (Kết quả được làm tròn đến 2 chữ số sau dấu phẩy thập phân)?
(Xem giải) Câu 2. Thực hiện các thí nghiệm sau:
(a) Cho CuS vào dung dịch H2SO4 loãng.
(b) Đun nóng tinh thể NaCl với dung dịch H2SO4 đặc.
(c) Cho CaOCl2 vào dung dịch HCl đặc.
(d) Cho (NH4)2CO3 vào dung dịch Ca(OH)2 dư.
(e) Cho K2S vào dung dịch AlCl3.
Có bao nhiêu thí nghiệm tạo ra chất khí sau phản ứng?
(Xem giải) Câu 3. Soda (Na2CO3) khi để lâu ngày bị chuyển hóa một phần thành NaHCO3 và hút ẩm tạo thành hỗn hợp X gồm Na2CO3, NaHCO3 và H2O. Hòa tan hoàn toàn 12,3 gam X trong nước, thu được 100 mL dung dịch Y. Tiến hành các thí nghiệm sau:
• Thí nghiệm 1: Cho 25 mL dung dịch HCl 1M vào 10 mL dung dịch Y sau đó đun nhẹ. Chuẩn độ dung dịch thu được với chỉ thị phenolphtalein đến khi xuất hiện màu hồng nhạt thì thấy hết 25 mL dung dịch NaOH 0,2M.
• Thí nghiệm 2: Cho 10 mL dung dịch NaOH 1M vào 10 mL Y sau đó thêm tiếp dung dịch BaCl2 đến dư vào, lọc bỏ kết tủa. Chuẩn độ nước lọc với chỉ thị phenolphtalein đến khi màu hồng vừa mất thì hết 40 mL dung dịch HCl 0,2M.
Phần trăm Na2CO3 đã bị chuyển hóa thành NaHCO3 là a%. Tính a.
(Xem giải) Câu 4. Cho các phát biểu sau:
(a) Acid béo omega-3 và omega-6 là các acid béo không no với liên kết đôi đầu tiên ở vị trí số 3 và số 6 khi đánh số từ nhóm carboxyl.
(b) Số nguyên tử oxygen có trong một phân tử glucose là 6.
(c) Dung dịch acetic acid có thể làm quỳ tím hóa đỏ.
(d) Acetaldehyde phản ứng với thuốc thử Tollens tạo kết tủa Ag.
(e) Trong phân tử xà phòng có đầu ưa nước và đuôi dài kị nước.
Có bao nhiêu phát biểu đúng?
(Xem giải) Câu 5. Adrenaline là hormone dẫn truyền thần kinh chủ yếu được tiết ra bởi tuyến thượng thận. Nó đóng vai trò quan trọng trong phản ứng “chiến hoặc chạy” của cơ thể, nhanh chóng chuẩn bị cho cơ thể đối mặt với các tình huống căng thẳng hoặc nguy hiểm. Dopamine là chất dẫn truyền thần kinh có vai trò quan trọng trong việc điều khiển hệ thần kinh trung ương, đặc biệt ảnh hưởng đến việc tạo cảm giác hứng thú, động lực trong học tập, kiểm soát hành vi tư duy, trí nhớ và ngôn ngữ,… Cấu tạo của adrenaline (bên trái) và dopamine (bên phải) được mô tả dưới đây:
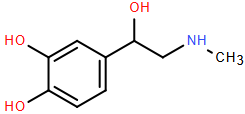
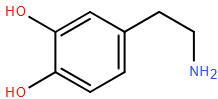
Cho các phát biểu sau
(a) Adrenaline có chứa một nhóm amine bậc hai.
(b) Adrenaline có thể tác dụng với dung dịch NaOH.
(c) Ba nhóm -OH trong adrenaline có tính chất hóa học giống nhau.
(d) Dopamine chứa hai nhóm OH mang tính chất phenol.
(e) Dopamine tác dụng với dung dịch NaOH và dung dịch HCl.
Có bao nhiêu phát biểu đúng?
(Xem giải) Câu 6. Có 6 hợp chất hữu cơ mạch hở A, B, C, D, E, F chỉ chứa các nguyên tố carbon, hydrogen, oxygen, đều không làm nhạt màu dung dịch bromine (Br2/CCl4), khối lượng mol đều bằng 74. Cho 6 chất lần lượt vào Na, dung dịch NaOH và dung dịch AgNO3 trong NH3 (đun nóng) thu được kết quả như sau:
| A | B | C | D | E | F | |
| Na | + | – | + | – | + | + |
| NaOH | – | – | + | + | – | + |
| AgNO3/NH3 | – | – | – | – | + | + |
(dấu + là có phản ứng, dấu – là không phản ứng)
Cho các phát biểu sau:
(1) Các chất A, C, E và F đều có liên kết hydrogen.
(2) Các chất B và F đều ít tan trong nước.
(3) Chất E và F đều bị khử bởi LiAlH4 thu được alcohol đa chức.
(4) Tổng số đồng phân của B và E là 5.
(5) Các chất C, D, E đều có một liên kết π trong phân tử.
Liệt kê các phát biểu đúng theo thứ tự từ nhỏ đến lớn (1234, …)
II. PHẦN TỰ LUẬN
(Xem giải) Câu 1 (2,0 điểm). Sulfuric acid là một trong những hóa chất quan trọng nhất được sử dụng trong công nghiệp, được sản xuất hàng trăm triệu tấn mỗi năm, chiếm nhiều nhất trong ngành công nghiệp hóa chất. Phương pháp sản xuất sulfuric acid phổ biến nhất là phương pháp tiếp xúc, theo đó acid có thể được sản xuất từ quặng pyrite qua các giai đoạn theo sơ đồ sau:
(1) FeS2(s) + O2(g) → Fe2O3(s) + SO2(g)
(2) SO2(g) + O2(s) ⇋ SO3(g)  = -196 kJ
= -196 kJ
(3) H2SO4(aq) + SO3(g) → H2SO4.nSO3(l)
(4) H2SO4.nSO3(l) + H2O(l) → H2SO4(aq)
Dùng sulfuric acid 98% hấp thụ SO3(g) trong giai đoạn (3), quá trình này được thực hiện trong tháp tiếp xúc.
1. Em hãy đề nghị 3 yếu tố để tăng hiệu suất điều chế SO3.
2. Giải thích tại sao trong quá trình sản xuất ở giai đoạn (3) H2SO4 (aq) được phun vào từ phía trên tháp, SO3(g) được bơm từ dưới lên.
3. Để xác định công thức của một loại oleum, người ta pha loãng 8,36 gam oleum vào nước thành 1,0 lít dung dịch Z, sau đó tiến hành chuẩn độ 10,0 mL dung dịch Z này bằng dung dịch NaOH 0,10 M. Thể tích NaOH trung bình cần sử dụng để chuẩn độ là 20,0 mL. Xác định công thức của oleum trên.
Câu 2 (2,0 điểm).
(Xem giải) 1. Thủy phân hoàn toàn một hexapeptide M thu được Ala, Arg, Glu, Ile, Phe và Tyr. Các peptide E (chứa Tyr, Arg) và G (chứa Arg, Glu, Tyr) được tạo thành trong số các sản phẩm thủy phân không hoàn toàn M. Dùng 2,4-dinitrofluorobenzene xác định được amino acid đầu N là Ala. Thủy phân M nhờ tripsin thu được tripeptide A (chứa Phe, Ala, Arg) và một chất B.
Xác định thứ tự liên kết của các amino acid trong E, G, A và M. Biết tripsin là enzyme đặc hiệu xúc tác cho phản ứng thủy phân liên kết peptide bằng cách tác động lên đầu các nhóm carboxyl của các amino acid cơ bản như Lys và Arg.
(Xem giải) 2. Diesel sinh học là nhiên liệu thân thiện với môi trường. Thành phần chính của diesel sinh học là các methyl ester của acid béo, được chiết xuất từ dầu và chất béo thực vật. Nhiều thí nghiệm chỉ ra rằng, khi tiếp xúc với nước hoặc đốt thì diesel sinh học không gây hại cho thực vật hay động vật. Bên cạnh đó, loại nhiên liệu này còn bị phân hủy sinh hóa gần như hoàn toàn trong đất hoặc nước, các vi sinh vật sẽ làm phân hủy 99% diesel sinh học trong khoảng 28 ngày. Điểm chớp cháy của diesel sinh học vượt quá 100°C nghĩa là nó ít có khả năng bắt lửa ở nhiệt độ thường, giúp an toàn hơn trong việc xử lý và lưu trữ.
a. Tính nhiệt lượng được giải phóng khi đốt cháy 1L mỗi loại nhiên liệu: xăng, diesel sinh học (khối lượng riêng lần lượt là 0,703 g/cm³ và 0,879 g/cm³). Giả thiết xăng chỉ có C8H18, diesel sinh học chỉ có C19H36O2. Nhiệt tạo thành của các chất ở điều kiện chuẩn được cho trong bảng sau:
| Chất | C8H18(l) | C19H36O2 (l) | H2O(g) | CO2(g) |
| -208 | -1304 | -241,8 | -285,8 |
b. Biodiesel được sản xuất thông qua phản ứng giữa chất béo và các alcohol mạch ngắn (thường là methanol) với xúc tác kiềm (thường dùng NaOH), thu được biodiesel (dạng methyl ester) và glycerol.
Phản ứng tổng quát như sau: (RCOO)3C3H5 + 3CH3OH (xác tác OH-) → 3RCOOCH3 + C3H5(OH)3
Một loại dầu ăn phế thải đã qua xử lý có chứa 60,2% chất béo (M = 860 amu). Nếu từ 500 kg dầu đó có khả năng chuyển hóa tối đa thành bao nhiêu kg biodiesel dạng methyl ester với hiệu suất đạt 90%?
(Xem giải) Câu 3 (1,0 điểm). Một nhóm học sinh thực hiện các thí nghiệm điều chế và thử tính chất của ammonia như hình vẽ:
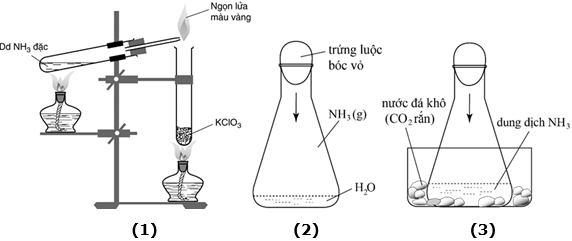
1. Viết các phương trình hóa học của phản ứng xảy ra ở thí nghiệm (1).
2. Thu khí ammonia thoát ra ở thí nghiệm (1) vào bình tam giác, nhỏ một ít nước vào bình sau đó đặt quả trứng luộc đã bóc vỏ lên miệng bình như hình (2). Một lúc sau quả trứng chui vào bình.
a. Trong quá trình thu khí, đề xuất cách nhận biết khí ammonia đã đầy hay chưa bình bằng phương pháp hóa học.
b. Giải thích vì sao quả trứng chui vào bình?
3. Một học sinh đề xuất thí nghiệm “trứng chui vào bình” tương tự thí nghiệm (2) bằng cách cho khoảng 200 mL dung dịch ammonia đặc vào bình tam giác, rồi tiến hành như hình (3). Đổ một ít nước nóng vào chậu thì nước đá khô thăng hoa nhanh, một lúc sau trứng cũng chui vào bình.
a. Vì sao nước đá khô thăng hoa thì trứng chui vào bình?
b. Trong nhà hàng đông người, vào mùa hè nếu cho nước đá vào bồn đi tiểu có thể làm giảm mùi khai ở nhà vệ sinh hay không?


Bình luận