[2025] Thi thử TN trường Tây Thạnh – TP Hồ Chí Minh (Đề 1)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 124
⇒ Đề thi, đáp án và giải chi tiết:
| 1A | 2C | 3A | 4C | 5A | 6C | 7B | 8B | 9B |
| 10A | 11D | 12B | 13D | 14C | 15C | 16B | 17C | 18C |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | Đ | S | S | S | 23 | 4 | 0,72 |
| (b) | S | Đ | Đ | Đ | 26 | 27 | 28 |
| (c) | S | Đ | Đ | Đ | 584 | 31,8 | 13 |
| (d) | Đ | Đ | S | S |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Urea là một loại phân bón quan trọng và phổ biến trong nông nghiệp, có công thức hóa học là (NH2)2CO. Urea thuộc loại
A. phân đạm. B. phân lân. C. phân kali. D. phân NPK.
(Xem giải) Câu 2. Cho các dung dịch: C6H5NH2, CH3NH2, H2NCH2COOH và H2N-[CH2]4-CH(NH2)-COOH (trong đó -C6H5 là gốc phenyl). Trong các dung dịch trên, có bao nhiêu dung dịch làm đổi màu quỳ tím?
A. 3. B. 1. C. 2. D. 4.
(Xem giải) Câu 3. Chất nào sau đây là amine bậc ba?
A. (CH3)3N. B. (C6H3)2NH. C. C2H5NHCH3. D. CH3NH2.
(Xem giải) Câu 4. Cho các quá trình sau:
(a) Vỏ tàu bằng thép có gắn các khối kẽm, neo đậu tại một cảng biển.
(b) Đưa dây sắt (vừa bị đốt nóng) vào bình đựng khi clorine.
(c) Tấm tôn trầy xước trên mái nhà tiếp xúc với nước mưa lâu ngày.
(d) Một cổ vật làm bằng đồng thau (hợp kim Cu – Zn) chìm trong nước biển.
Có bao nhiêu trường hợp xảy ra ăn mòn điện hoá trong các quá trình trên?
A. 4. B. 2. C. 3. D. 1.
(Xem giải) Câu 5. Hình vẽ sau do một học sinh vẽ để mô tả lại thí nghiệm pin điện hóa học khi cắm hai lá Cu và Zn (được nối với nhau bằng một dây dẫn) vào dung dịch H2SO4 loãng.
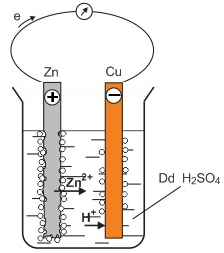
Trong hình vẽ, chi tiết nào chưa đúng?
A. Kí hiệu các điện cực.
B. Bọt khí thoát ra trên các bề mặt điện cực.
C. Bề mặt hai thanh Cu và Zn.
D. Chiều chuyển dịch của các electron trong dây dẫn.
(Xem giải) Câu 6. Kim loại cơ bản trong gang là
A. Zn. B. Cu. C. Fe. D. Mg.
(Xem giải) Câu 7. Isopropyl formate là một ester có trong cà phê Arabica (còn gọi là cà phê chè). Công thức của isopropyl formate là
A. HCOOCH2CH3. B. HCOOCH(CH3)2.
C. HCOOCH3. D. HCOOCH2CH2CH3.
(Xem giải) Câu 8. Đem giã nát củ nghệ rồi ngâm với ethanol nóng, sau đó lọc bỏ phần bã, lấy dung dịch nước lọc cô để làm bay hơi bớt dung môi, phần dung dịch còn lại được làm lạnh, để yên một thời gian rồi lọc lấy kết tủa màu vàng là curcumin. Hãy cho biết trong các quá trình trên người ta đã sử dụng kĩ thuật tinh chế nào để lấy được curcumin từ củ nghệ tươi?
A. Chiết, chưng cất và sắc kí. B. Chiết và kết tinh.
C. Chiết và chưng cất. D. Chiết, chưng cất và kết tinh.
(Xem giải) Câu 9. Potassium alum là một loại muối kép của potassium và aluminium, công thức là KAl(SO4)2.12H2O. Potassium alum được dùng để làm trong nước phèn và sử dụng trong công nghiệp thuộc da. Hàm lượng của aluminium trong potassium alum vào khoảng
A. 7,0%. B. 5,7%. C. 5,2%. D. 8,2%.
(Xem giải) Câu 10. Polymer nào sau đây không được sử dụng làm chất dẻo?
A. Nylon-6,6. B. Polyethylene. C. Poly(phenolformaldehyde). D. Poly(vinyl chloride).
(Xem giải) Câu 11. Alanine, ký hiệu là Ala là một amino acid được sử dụng trong quá trình sinh tổng hợp protein. Trong dung dịch ở pH khác nhau, alanine sẽ tồn tại ở các dạng như dưới đây:
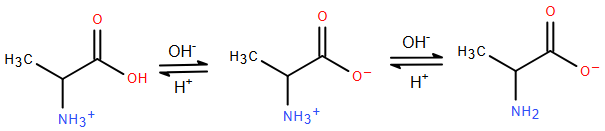
Ở pH = 6 alanine tồn tại chủ yếu ở dạng ion lưỡng cực có tổng điện tích bằng không. Khi đặt trong điện trường, alanine hầu như không di chuyển. Nhận định nào sau đây về alanine là không đúng?
A. Alanine là một α-amino acid.
B. Trong môi trường kiềm, dạng tồn tại của alanine là dạng anion.
C. Alanine có tính lưỡng tính.
D. Ở pH < 6, alanine nhận proton trở thành anion, khi đặt trong điện trường di chuyển về cực dương.
(Xem giải) Câu 12. Phát biểu nào sau đây không đúng?
A. Trong vụ nổ vật lí không xảy ra phản ứng hóa học.
B. Nổ bom mìn, thuốc nổ là một dạng nổ vật lí.
C. Nổ vật lí xảy ra thường do áp suất cao.
D. Nổ hóa học bắt nguồn từ các phản ứng hóa học.
(Xem giải) Câu 13. Phát biểu nào sau đây sai khi nói về xà phòng?
A. Xà phòng là hỗn hợp các muối sodium hoặc potassium của acid béo.
B. Xà phòng có thể được dùng để rửa tay.
C. Cấu tạo của xà phòng gồm hai phần: đầu ưa nước và đuôi kị nước.
D. Xà phòng được sản xuất bằng phản ứng thủy phân chất béo trong môi trường acid.
(Xem giải) Câu 14. Số nguyên tử carbon có trong 1 phân tử glucose là
A. 5. B. 12. C. 6. D. 10.
(Xem giải) Câu 15. Xét phản ứng: Cu(s) + Fe2(SO4)3(aq) → 2FeSO4(aq) + CuSO4(aq). Kí hiệu cặp oxi hoá – khử của iron trong phản ứng trên là
A. Fe2+/Fe. B. Fe3+/Fe. C. Fe3+/Fe2+. D. Fe/Fe2+.
(Xem giải) Câu 16. K2[PtCl4] là một phức chất của platinum, một chất khởi đầu phổ biến để tổng hợp cisplatin (dùng trong điều trị ung thư). Cho các phát biểu về K2[PtCl4] như sau:
(1) Các cation K+ là cầu ngoại, [PtCl4]2- là cầu nội.
(2) Phối tử trong phức chất là Cl-, có dung lượng phối trí là 1.
(3) Dựa vào thực nghiệm, [PtCl4]2- có dạng hình học bát diện.
(4) Số oxi hóa của nguyên tử trung tâm là +4.
(5) Mỗi phối tử Cl- có ba cặp electron hóa trị chưa liên kết.
Số phát biểu đúng là
A. 5. B. 2. C. 3. D. 4.
(Xem giải) Câu 17. Phát biểu nào sau đây đúng?
A. Trong hợp chất, magnesium thể hiện nhiều số oxi hóa khác nhau.
B. Thủy luyện dung dịch muối ăn bằng potassium thu được sodium.
C. Nước có tính cứng vĩnh cửu không thể được làm mềm bằng phương pháp đun sôi.
D. Phương pháp chlorine – kiềm dùng để điều chế sodium chloride trong công nghiệp.
(Xem giải) Câu 18. Cho các dung dịch: (1) fructose, (2) saccharose, (3) glucose, (4) ethanol. Số dung dịch có khả năng hòa tan Cu(OH)2 là
A. 1. B. 2. C. 3. D. 4.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. Để lên men ethyl alcohol từ glucose, người ta sử dụng nấm men làm chất xúc tác. Thực hiện quá trình lên men ethyl alcohol trong phòng thí nghiệm từ 250 gam glucose. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:

Kết quả nghiên cứu cho thấy:
• Tốc độ phản ứng tăng lên, dung dịch trở nên ấm hơn.
• Sau một thời gian, từ ngày thứ 10 phản ứng hầu như dừng lại dù trong dung dịch vẫn còn glucose.
a) Trong quá trình lên men ngoại trừ ethyl alcohol thì còn có thể tạo thành một số sản phẩm như CH3CHO, CH3COOH.
b) Dung dịch trở nên đặc hơn là do khí CO2 bay ra làm khối lượng dung dịch tăng nên nồng độ dung dịch tăng lên.
c) Hiệu suất lên men của ngày thứ 10 là 74%.
d) Phương trình lên men glucose là : C6H12O6 (enzyme) → 2C2H5OH + 2CO2.
(Xem giải) Câu 20. Trong công nghiệp, xút (sodium hydroxide) được sản xuất bằng phương pháp điện phân dung dịch sodium chloride có màng ngăn xốp. Bằng phương pháp này, người ta cũng thu được khí chlorine. Chất khí này được làm khô (loại hơi nước) rồi hoá lỏng để làm nguyên liệu quan trọng cho nhiều ngành công nghiệp chế biến và sản xuất hoá chất.
(a) Trong thí nghiệm điện phân thì Cl2 sẽ thoát ra tại cực cathode.
(b) Từ quá trình điện phân nêu trên, một lượng chlorine và hydrogen sinh ra được tận dụng để sản xuất hydrochloric acid đặc thương phẩm (32%, D = 1,153 g/mL ở 30°C). Một nhà máy với quy mô sản xuất 200 tấn xút mỗi ngày thì đồng thời sản xuất được 237 m³ acid thương phẩm trên. Biết rằng, tại nhà máy này, 60% khối lượng chlorine sinh ra được dùng tổng hợp hydrochloric acid và hiệu suất của toàn bộ quá trình từ chlorine đến acid thương phẩm đạt 80% về khối lượng. (Làm tròn kết quả đến hàng đơn vị)
c) Có thể dùng sulfuric acid đặc làm khô khí chlorine thoát ra.
d) Phương trình điện phân dung dịch NaCl là 2NaCl + 2H2O → 2NaOH + H2 + Cl2 (điện phân dung dịch có màng ngăn).
(Xem giải) Câu 21. Giải Nobel Hóa học năm 2022 được trao cho các nhà khoa học nghiên cứu về hoá học “click”. Hợp chất DBCO-Acid dưới đây là phân tử được sử dụng trong nghiên cứu này.
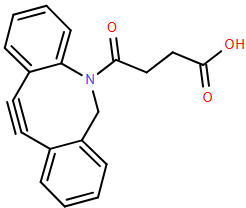
Mỗi phát biểu bên dưới đây là đúng hay sai?
a) DBCO-Acid không thể tham gia phản ứng cộng.
b) DBCO-Acid có thể làm mất màu dung dịch KMnO4 trong môi trường acid.
c) DBCO-Acid có thể phản ứng với amino acid và nhóm amine trong protein ở điều kiện thích hợp.
d) DBCO-Acid có thể phản ứng với NaOH với tỷ lệ tối đa là 1 : 1.
(Xem giải) Câu 22. Hiện nay, trữ lượng các mỏ quặng kim loại ngày càng cạn kiệt, trong khi nhu cầu sử dụng kim loại không ngừng tăng và lượng phế thải kim loại ngày càng nhiều. Do đó, tái chế kim loại trở thành một giải pháp quan trọng. Trong quá trình tái chế đồng bằng phương pháp điện phân, lượng đồng thu hồi được phụ thuộc vào thời gian điện phân, cường độ dòng điện và hiệu suất điện phân theo công thức: mCu = (H.M.I.t)/(n.F) (gam)
Cho biết: M = 64, F = 96500, I là cường độ dòng điện (ampe), t là thời gian điện phân (giây), n là số electron mà ion Cu2+ nhận trong quá trình điện phân, H là hiệu suất điện phân.
a) Một xưởng sản xuất tái chế Cu bằng phương pháp điện phân với cường độ dòng điện 10000 ampe, thời gian điện phân mỗi ngày 22 giờ. Với hiệu suất điện phân H = 95% thì mỗi ngày thu được 262,6 kg Cu tinh khiết (Kết quả làm tròn đến hàng phần mười).
b) Để tái chế đồng bằng phương pháp điện phân, phế liệu đồng (chứa tạp chất) được dùng làm anode, tấm đồng nguyên chất đóng vai trò cathode.
c) Tái chế kim loại giúp đảm bảo nguồn cung, gia tăng giá trị kinh tế, bảo vệ môi trường và hướng đến mục tiêu phát triển bền vững.
d) Quy trình tái chế kim loại thường gồm các giai đoạn theo trình tự: thu gom, phân loại, tinh chế, gia công, xử lí sơ bộ, nấu chảy.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Người ta tách kim loại Ag bằng phương pháp cyanide qua các giai đoạn sau:
• Giai đoạn 1: Nghiền nhỏ quặng silver sulfide (Ag2S), hoà tan bằng dung dịch sodium cyanide (NaCN), rồi lọc để thu được dung dịch chứa phức chất tan của bạc:
Ag2S + 4NaCN → 2Na[Ag(CN)2] + Na2S
• Giai đoạn 2: Khi có mặt oxygen, bạc trong quặng tan được trong dung dịch NaCN:
4Ag + O2 + 8NaCN + 2H2O → 4Na[Ag(CN)2] + 4NaOH
• Giai đoạn 3: Sau đó ion Ag+ trong phức được khử bằng kim loại kẽm:
2Na[Ag(CN)2] + Zn → Na2[Zn(CN)4] + 2Ag
(1) Giai đoạn 1 và giai đoạn 2 quặng được xử lí bằng cả quá trình vật lí và quá trình hoá học.
(2) Bản chất của giai đoạn 3 là sử dụng phương pháp thủy luyện để tách kim loại bạc.
(3) Trong công nghiệp, phương pháp trên thường được dùng để điều chế các kim loại quý như Au, Ag.
(4) Sau giai đoạn 3, người ta dùng dung dịch HCl, H2SO4 đặc để loại bỏ kẽm dư.
Gắn số thé tự theo chiều tăng dần các phát biểu đúng (ví dụ: 123; 134; 234;…).
(Xem giải) Câu 24. Khi cho phức chất [Cu(OH2)6]2+ tác dụng với dung dịch NH3 đặc, thu được phức chất bát diện T. Trong phức chất T, tỉ lệ phối tử NH3 : H2O là 2 : 1. Có bao nhiêu phối tử H2O đã được thay thế bởi phối tử NH3?
(Xem giải) Câu 25. Để sản xuất 1 tấn xà phòng (có chứa 75% khối lượng là muối sodium của acid béo, còn lại là chất độn), người ta xà phòng hóa hoàn toàn m tấn chất béo trung tính bằng dung dịch chứa 120 kg NaOH vừa đủ. Xác định giá trị m. (Kết quả làm tròn đến hàng phần trăm).
(Xem giải) Câu 26. Glucose (C6H2O6) là một loại monosaccharide được tạo ra bởi thực vật và các loại tảo từ quá trình quang hợp. Dung dịch glucose 5% (100 mL dung dịch chứa 5 gam glucose) là dung dịch đường tiêm tĩnh mạch, dùng để cung cấp nước và năng lượng cho cơ thể, đặc biệt là khi cơ thể ốm yếu, mệt mỏi… trong cơ thể, khi 1 mol glucose bị oxi hóa sẽ giải phóng một năng lượng có giá trị 2803 kJ. Tính năng lượng tối đa (kJ) thu được từ glucose khi một người bệnh được truyền dịch trong 3 ngày, mỗi ngày 1 chai 250 mL dung dịch glucose 5%. (Kết quả làm tròn đến hàng đơn vị).
(Xem giải) Câu 27. Ion NH4+ trong nước uống có thể ảnh hưởng đến hệ thần kinh và quá trình vận chuyển oxygen trong máu. Trong xử lí nước sinh hoạt, người ta sử dụng quá trình nitrate hóa để chuyển hóa NH4+ thành NO3−, sau đó áp dụng quá trình khử nitrate để chuyển NO3- thành khí N2, giúp loại bỏ hoàn toàn nitrogen ra khỏi nước. Phương trình xử lí như sau:
Quá trình nitrate hóa (hiệu suất 95%): NH4+ + 2O2 → NO3- + 2H+ + H2O
Khử nitrate thành khí N2 (hiệu suất 90%): 2NO3- + 10e + 12H+ → N2 + 6H2O
Một nhà máy xử lí nước có bể chứa 1000 m³ nước bị nhiễm ammonium với nồng độ 54 mg/L theo qui trình hai bước như trên. Thể tích khí N2 tạo thành có giá trị là V (m³) ở điều kiện chuẩn. Tính giá trị của V. (Kết quả làm tròn đến hàng phần chục)
(Xem giải) Câu 28. Một hexapeptide X có công thức thu gọn như sau: Gly-Ala-Val-Gly-Ala-Gly. Trong X có a nguyên tử oxygen và b nguyên tử nitrogen. Tính giá trị của (a + b).


Bình luận