[2026] Thi thử TN sở GDĐT Hà Tĩnh (Số 04)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 028
⇒ Đề thi, đáp án và giải chi tiết:
| 1D | 2B | 3A | 4A | 5C | 6A | 7B | 8C | 9A |
| 10D | 11A | 12D | 13C | 14A | 15D | 16A | 17B | 18A |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | Đ | Đ | S | S | 3 | 1 | 77,4 |
| (b) | S | S | Đ | Đ | 26 | 27 | 28 |
| (c) | Đ | Đ | S | S | 1235 | 122 | 4 |
| (d) | Đ | Đ | Đ | S |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Ở điều kiện thường, kim loại nào sau đây có màu đỏ?
A. Ag. B. Hg. C. Al. D. Cu.
(Xem giải) Câu 2. Trong phức chất [Co(H2O)6]2+, 2 phối tử H2O có thể bị thế bởi 2 phối tử OH-. Phát biểu nào sau đây không đúng?
A. Phức chất tạo thành có 4 phối tử nước và 2 phối tử OH-.
B. Phức chất tạo thành có điện tích +2.
C. Phức chất tạo thành có nguyên tử trung tâm là Co2+.
D. Phức chất tạo thành là [Co(OH)2(H2O)4].
(Xem giải) Câu 3. Trong một giai đoạn của quá trình Solvay có tồn tại cân bằng giữa các muối trong dung dịch: NaCl + NH4HCO3 ⇌ NaHCO3 + NH4Cl. Dựa trên tính chất nào của NaHCO3 để kết tinh muối này từ dung dịch hỗn hợp?
A. Độ tan thấp. B. Tính lưỡng tính. C. Độ bền nhiệt thấp. D. Tính base Bronsted.
(Xem giải) Câu 4. Phản ứng điều ethene chế từ ethanol theo phương trình hóa học: C2H5OH (H2SO4 đặc, 170°C) → CH2=CH2 + H2O là phản ứng:
A. Dehydrate hoá. B. Trùng ngưng. C. Ester hoá. D. Hydrate hoá.
(Xem giải) Câu 5. Ester X được tạo bởi methyl alcohol và acetic acid. Công thức của X là
A. HCOOC2H5. B. CH3COOC2H5. C. CH3COOCH3. D. HCOOCH3.
(Xem giải) Câu 6. Tên gọi theo danh pháp thay thế của chất có công thức cấu tạo (CH3)2NH là
A. N-methylmethanamine. B. Ethylamine.
C. Dimethylamine. D. Ethanamine.
(Xem giải) Câu 7. Tiến hành điện phân dung dịch CuSO4 dư bằng dòng điện một chiều, điện cực trơ. Khi phản ứng điện phân xảy ra, nhận xét nào sau đây đúng?
A. nồng độ mol của Cu2+ trong dung dịch không đổi.
B. ở anode xảy ra sự oxi hóa nước.
C. độ pH của dung dịch tăng dần.
D. xuất hiện khí thoát ra ở cathode.
(Xem giải) Câu 8. Cho các phát biểu sau về tính chất của phenylamine:
(a) Phenylamine làm giấy quỳ tím ẩm hóa xanh.
(b) Phenylamine phản ứng được với HCl trong dung dịch.
(c) Dung dịch phenylamine phản ứng được với nước bromine ở điều kiện thường.
(d) Dung dịch methylamine phản ứng được với dung dịch NaOH.
Số phát biểu đúng là
A. 4. B. 3. C. 2. D. 1.
(Xem giải) Câu 9. Cho thế điện cực chuẩn của Cu2+/Cu và Zn2+/Zn lần lượt là E°1 = +0,340V và E°2 = –0,763V. Sức điện động chuẩn của pin Galvani (E°pin) tạo bởi hai cặp oxi hóa – khử Cu2+/Cu và Zn2+/Zn được tính theo công thức nào sau đây?
A. E°pin = E°1 – E°2. B. E°pin = E°1 + E°2
C. E°pin = -E°2 – E°1. D. E°pin = E°2 – E°1
(Xem giải) Câu 10. Phát biểu nào sau đây về maltose không đúng?
A. Maltose có công thức phân tử C12H22O11.
B. Maltose phản ứng được với Cu(OH)2 trong môi trường kiềm ở điều kiện thường.
C. Maltose thuộc loại disaccharide.
D. Maltose thủy phân thu được glucose và fructose.
(Xem giải) Câu 11. Cho phản ứng thuận nghịch sau: Cl2(aq) + H2O(l) ⇌ HClO(aq) + HCl(aq). Ở trạng thái cân bằng, nồng độ (mol/L) của Cl2(aq), HClO(aq) và HCl(aq) được kí hiệu lần lượt là [Cl2], [HClO] và [HCl]. Biểu thức hằng số cân bằng Kc của phản ứng là
A. [HClO][HCl] / [Cl2]. B. [HClO][HCl] / [Cl2][H2O].
C. [H2O][Cl2] / [HClO]. D. [HCl] / [Cl2].
(Xem giải) Câu 12. Xét phức chất [PtCl2(NH3)4]2+ và [FeF6]3-. Phát biểu nào sau đây đúng?
A. Số lượng phối tử có trong mỗi phức chất lần lượt là 4 và 6.
B. Điện tích của mỗi phức chất lần lượt là 4+ và 3+.
C. Cả 2 phức chất đều ít tan trong nước.
D. Nguyên tử trung tâm mỗi phức chất lần lượt là Pt4+ và Fe3+.
(Xem giải) Câu 13. Trong các phản ứng hữu cơ thường có sự tạo thành các tiểu phân trung gian hoạt động như gốc tự do, carbanion, carbocation. Carbocation là ion mang điện tích dương trên nguyên tử carbon. Có bao nhiêu carboanion trong số các tiểu phân (CH3)3C⁺, (CH3)2C⁻H, •CH3 và (CH3)2C⁺H?
A. 3. B. 2. C. 1. D. 4.
(Xem giải) Câu 14. Lactic acid là một chất có một trong nhiều thực phẩm, lactic acid cũng được tạo ra tự nhiên trong cơ thể con người, chủ yếu trong quá trình chuyển bia glucose kỵ khí. Công thức cấu tạo của lactic acid như hình dưới.
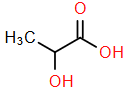
Nhóm chức nào trong các nhóm chức sau có trong phân tử lactic acid? (1) alcohol; (2) carboxylic acid; (3) ester; (4). Ketone.
A. (1) và (2). B. (1) và (4) C. (2). D. (1), (2) và (3).
(Xem giải) Câu 15. Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn: 4FeS(s) + 7O2(g) → 2Fe2O3(s) + 4SO2(g). Biết nhiệt tạo thành của các chất FeS (s), Fe2O3(s) và SO2(g) lần lượt là –100,0 kJ/mol, –825,5 kJ/mol và –296,8 kJ/mol.
A. +3105,6 kJ. B. –3105,6 kJ. C. +2438,2 kJ. D. –2438,2 kJ.
(Xem giải) Câu 16. Sulfur (S) là chất quan trọng, được sử dụng rộng rãi trong sản xuất sulfuric acid và lưu hóa cao su. Ở trạng thái cơ bản, cấu hình electron của nguyên tử S (số hiệu nguyên tử bằng 16) là
A. 1s2 2s2 2p6 3s2 3p4. B. 1s2 2s2 2p6 3s2 3d4. C. 1s2 2s2 2p6 3p4 3s2. D. 1s2 2s2 2p6 3s2 3p6.
(Xem giải) Sử dụng thông tin cho dưới đây để trả lời các câu 17 – 18:
Một nhóm học sinh làm thí nghiệm chế tạo pin điện hóa bằng quả chanh với điện cực bằng Zn và Cu để làm một bóng led sáng rõ được như hình ảnh sau:

Giả thiết để bóng led sáng rõ cần hiệu điện thế tối thiểu là 1,5V, sức điện động đo được của mỗi đơn vị pin trên (tính cho 1 nửa quả chanh) trong điều kiện thí nghiệm là 0,45V.
Câu 17. Cho các phát biểu sau về pin điện hóa và thí nghiệm về pin điện hóa nêu trên:
(a) Các lá kim loại Zn đóng vai trò anode còn lá Cu là cathode.
(b) Tại cực âm xảy ra sự oxi hóa Zn còn tại cực dương xảy ra sự khử ion Cu2+.
(c) Cần tối thiểu 4 đơn vị pin ghép nối tiếp để bóng led sáng rõ.
(d) Các cặp oxi hóa – khử chủ yếu tham gia phản ứng xảy ra trong pin trên là Zn2+/Zn và Cu2+/Cu.
Số phát biểu đúng là
A. 3. B. 2. C. 1. D. 4.
Câu 18. Cho nước cốt chanh ta có pH ≈ 2,3 còn nước cam có pH ≈ 3,4. Làm thí nghiệm về pin điện hóa như trên lần lượt với quả chanh và quả cam trong cùng điều kiện. Sức điện động của pin tỷ lệ thuận với nồng độ ion H+. Cho các nhận định sau:
(1) Sức điện động làm từ quả chanh lớn hơn làm từ quả cam.
(2) Để pin hoạt động hiệu quả hơn nên bóp quả chanh để các các tép chanh vỡ ra thuận lợi cho sự dẫn điện.
(3) Quá trình chủ yếu xảy ra tại cực dương của pin là 2H+ + 2e → H2.
(4) Nếu giữ nguyên các lá Zn, thay các lá Cu bằng Sn thì bóng led sẽ sáng rõ hơn.
Nhận định sai là
A. Nhận định (4). B. Nhận định (3). C. Nhận định (2). D. Nhận định (1).
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. Poly(vinyl alcohol) (hay PVA) có các tính chất ưu việt như độ bền kéo tốt, khả năng tạo màng, không độc hại, khả năng bị phân hủy sinh học nên được dùng trong nhiều lĩnh vực đời sồng và công nghiệp. PVA có trong thành phần lớp bọc phía ngoài của các loại thuốc viên dạng con nhộng, khi vào cơ thể lớp màng này tan dần giúp quá trình giải phóng thuốc kéo dài, ngoài ra PVA còn được dùng để tạo màng bọc thực phẩm có thể ăn được. PVA được điều chế bằng phản ứng thủy phân poly(vinyl acetate) (hay PVAc) trong môi trường kiềm:

a) Phản ứng trên là phản ứng thủy phân các nhóm chức ester.
b) Phản ứng trên là phản ứng cắt mạch polymer.
c) Do có nhiều nhóm hydroxy nên PVA có khả năng tan được trong nước.
d) PVA là polyme tổng hợp thân thiện với môi trường.
(Xem giải) Câu 20: Ion Cu2+ có cấu hình electron là [Ar] 3d9 có thể tạo phức được với nhiều phối tử bằng liên kết cho nhận giữa phối tử với các orbital trống của ion Cu2+. Một thí nghiệm về sự tạo thành hợp chất phức được thực hiện như sau: Hoà tan hoàn toàn một lượng muối CuSO4 khan (màu trắng) vào nước, thu được dung dịch X có màu xanh. Thêm tiếp dung dịch NaoH vào dung dịch X, thu được kết tủa màu xanh nhạt. Tiếp tục thêm dung dịch NH3 đặc đến dư vào đến khi kết tủa bị hoà tan, thu được dung dịch Y có màu xanh lam. Chuỗi thí nghiệm trên được biểu diễn qua sơ đồ sau:
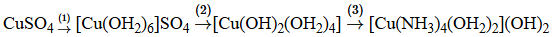
Màu xanh của kết tủa và dung dịch được lí giải là do sự hình thành các ion phức trong hợp chất phức gây ra.
a) Các phản ứng (2), (3) đều có sự thay thế một phần phối tử trong phức chất.
b) Màu của dung dịch X và Y là do các anion trong hợp chất phức gây ra.
c) Trong hợp chất phức [Cu(NH3)4(OH2)2](OH)2, phối tử tạo phức là NH3 và H2O.
d) Số electron liên kết giữa Cu(II) với các phối tử trong các hợp chất phức là 12.
(Xem giải) Câu 21. Để sử dụng nước sinh hoạt ở vùng nước nhiểm sắt ở một số vùng, người ta sử dụng hệ thống lọc nước kiểu giàn mưa như hình 2. Một nhóm học sinh tìm hiểu ảnh hưởng của giàn mưa ảnh hưởng đến nồng độ ion Fe2+ trong nước giếng khoan nhiễm sắt. Giả thuyết của nhóm học sinh là: “nước giếng khoan sau khi đi qua hệ thống lọc nước kiểu giàn mưa, nồng độ Fe2+ giảm”. Nhóm học sinh chuẩn bị:
+ 100,0 mL nước giếng khoan vừa bơm lên đựng trong cốc thủy tinh lớn (dán nhãn cốc là Y)
+ 100,0 mL nước giếng khoan sau khi đi qua hệ thống lọc trong cốc thủy tinh (dán nhãn cốc là Z)
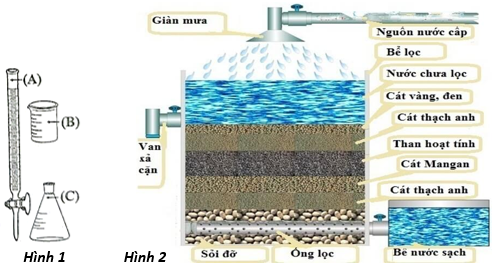
Nhóm tiến hành các thí nghiệm như sau:
– Chuẩn độ Fe2+ trong nước vừa lấy từ giếng khoan (cốc Y):
• Bước 1: Lấy 10,00 mL dung dịch trong bình Y cho vào bình tam giác rồi thêm tiếp 5 mL dung dịch H2SO4 2 M.
• Bước 2: Chuẩn độ dung dịch trong bình tam giác bằng dung dịch KMnO4 2,20×10⁻² M đến khi xuất hiện màu hồng nhạt (bền trong khoảng 20 giây) thì dừng. Ghi lại thể tích dung dịch KMnO4 đã dùng.
Lặp lại thí nghiệm chuẩn độ thêm 2 lần. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 10,40 mL. Nồng độ của Fe(II) xác định được là C1 M.
– Chuẩn độ Fe2+ trong nước sau khi lọc (cốc Z):
Xác định hàm lượng Fe(II) của dung dịch chứa trong bình Z theo các bước tương tự như lần thứ nhất. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 2,43 mL. Nồng độ của Fe(II) xác định được là C2 M.
Nồng độ dung dịch KMnO4 như nhau trong các thí nghiệm chuẩn độ. Sự thay đổi nồng độ của Fe(II) (q%) được tính theo công thức: q = (C1 – C2)/C1. Giả thiết các ion khác trong nước không ảnh hưởng đến phản ứng của Fe2+ với KMnO4/H2SO4.
a) Khi chuẩn độ, dung dịch KMnO4 được nhỏ trực tiếp vào bình tam giác từ dụng cụ kí hiệu là (B) được minh họa ở Hình 1.
b) Giá trị của q là 76,6. (Kết quả các phép tính trung gian không được làm tròn, chỉ kết quả cuối cùng được làm tròn đến hàng phần mười).
c) Giá trị của C2 là 0,003. (Kết quả các phép tính trung gian không được làm tròn, chỉ kết quả cuối cùng được làm tròn đến hàng phần nghìn).
d) Kết quả thu được từ các thí nghiệm phù hợp với giả thuyết ban đầu của nhóm học sinh.
(Xem giải) Câu 22: Enzyme là một thành phần thiết yếu của các chất giặt rửa cao cấp và việc sử dụng chúng mang lại cho người tiêu dùng những lợi ích rõ rệt. Những lợi ích này bao gồm khả năng làm việc ở nhiệt độ thấp, tiết kiệm nước, đồng thời loại bỏ nhu cầu sử dụng các hoá chất khắc nghiệt, gây tác động tiêu cực đến môi trường. Ngoài ra, enzyme có thể phân huỷ sinh học nên không để lại dư lượng độc hại. Protease là loại enzyme không thể thiếu trong tất cả các loại hoá chất giặt rửa, nhất là trong bột giặt, do protease thích hợp để dễ loại bỏ các vết bẩn do thức ăn, máu và các dịch do cơ thể con người tiết ra. Để khảo sát độ hoạt động của protease theo nhiệt độ, người ta tiến hành thí nghiệm nghiên cứu tốc độ phân huỷ chất bẩn bởi protease. Kết quả cho bởi biểu đồ bên.
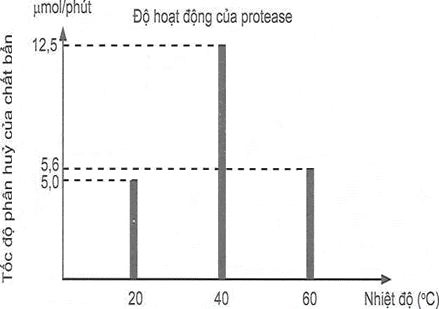
a) Chất giặt rửa chứa enzyme protease phân hủy chất bẩn tốt hơn nhưng gây ô nhiểm môi trường, để lại dư lượng chất độc hại.
b) Chất giặt rửa chứa enzyme protease hoạt động tối ưu ở nhiệt độ 40°C.
c) Khi tăng nhiệt độ, tốc độ phân hủy của các vết bẩn trên trong quần, áo sẽ nhanh hơn vì hoạt động của enzyme protease tăng dần.
d) Do có tính chọn lọc cao, phải sử dụng ở một nhiệt độ nghiêm ngặt nên người ta đang dần thay thế chất giặt rửa chứa enzyme bằng chất giặt có chứa các chất tẩy rửa mạnh.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Có bao nhiêu công thức cấu tạo của ketone ứng với công thức phân tử C5H10O?
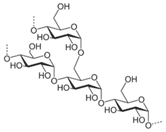
(Xem giải) Câu 24. Trong cấu tạo của một đoạn mạch amylopectine sau có bao nhiêu liên kết α-1,6-glycoside?
(Xem giải) Câu 25. Phần trăm khối lượng carbon trong aniline là a%. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến hàng phần mười).
(Xem giải) Câu 26. Chanh là một loài thực vật cho quả nhỏ, thuộc chi cam chanh (citrus), khi chín có màu xanh hoặc vàng, thịt quả có vị chua. Quả chanh được sử dụng làm thực phẩm – chủ yếu dùng nước ép của nó, phần múi và vỏ quả chanh cũng có thể dùng trong nấu ăn và nướng bánh. Nước ép chanh chứa khoảng 5% citric acid (X) nên chanh có vị chua và độ pH khoảng 2 – 3. Công thức (X) được cho ở hình bên.
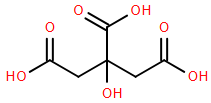
Cho các phát biểu:
(1) Công thức phân tử của (X) là C6H8O7.
(2) (X) thuộc loại hợp chất tạp chức.
(3) 1mol (X) tác dụng với lượng dư Na tạo ra 2 mol H2
(4) (X) tác dụng với NaOH theo tỉ lệ mol 1 : 4.
(5) Có thể dùng (X) để khử mùi tanh của cá do một số amine gây ra.
Liệt kê các phát biểu đúng theo số thứ tự tăng dần.
(Xem giải) Câu 27. Theo QCVN 01-1:2018/BYT, hàm lượng sắt tối đa cho phép trong nước sinh hoạt là 0,30 mg/L. Một mẫu nước có hàm lượng sắt cao gấp 28 lần ngưỡng cho phép, giả thiết sắt trong mẫu nước tồn tại ở dạng Fe2(SO4)3 và FeSO4 với tỉ lệ mol tương ứng là 1 : 8. Quá trình tách loại sắt trong 10 m³ mẫu nước trên được thực hiện bằng cách sử dụng m gam vôi tôi (vừa đủ) để tăng pH, sau đó sục không khí:
Fe2(SO4)3 + Ca(OH)2 → Fe(OH)3 + CaSO4
FeSO4 + Ca(OH)2 + O2 + H2O → Fe(OH)3 + CaSO4
Giả thiết vôi tôi chỉ chứa Ca(OH)2. Giá trị của a là bao nhiêu? (Kết quả làm tròn đến hàng đơn vị)
(Xem giải) Câu 28: Muối Epsom có công thức hóa học MgSO4.7H2O. Muối này có nhiều tác dụng tốt cho sức khỏe nên thường được dùng làm thuốc y học. Tên gọi Epsom lấy từ tên của con suối nước muối đắng chứa nhiều muối MgSO4 ở thị trấn Epsom nước Anh. Khi nung nóng, MgSO4.7H2O mất dần khối lượng do mất nước. Đồ thị sau đây biểu diễn độ giảm khối lượng của MgSO4.7H2O khi tăng nhiệt độ nung:
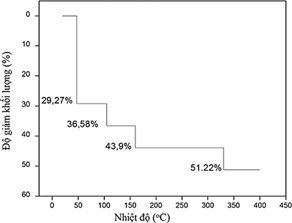
Khi nung nóng đến 400°C, muối thu được chứa bao nhiêu nguyên tử O trong phân tử?


Bình luận