[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Phú Thọ
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 053-H12B năm 2024-2025
⇒ Thời gian làm bài: 180 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1B | 2B | 3B | 4B | 5A | 6C | 7D | 8A |
| 9C | 10D | 11B | 12A | 13C | 14C | 15D | 16D |
| 17D | 18D | 19C | 20B | 21D | 22C | 23A | 24C |
| 25C | 26D | 27A | 28B | 29A | 30B | 31C | 32D |
| (a) | (b) | (c) | (d) | |
| Câu 1 | Đ | S | Đ | S |
| Câu 2 | Đ | S | Đ | S |
PHẦN 1. TỰ LUẬN (10 điểm)
Câu I (2,0 điểm).
(Xem giải) 1. Trong một phòng thí nghiệm, có 5 lọ chứa hoá chất bị mất nhãn được đánh số từ 1 đến 5, mỗi lọ chứa một trong các dung dịch sau: (NH4)2SO4, K2SO4, Ba(OH)2, Na2CO3, HCl. Tiến hành thí nghiệm với các dung dịch trên cho kết quả như sau:
– Dung dịch ở lọ (2) tác dụng với dung dịch ở lọ (3) có kết tủa và khí thoát ra.
– Dung dịch ở lọ (2) tác dụng với dung dịch ở lọ (1) hoặc dung dịch ở lọ (4) đều có kết tủa.
– Dung dịch ở lọ (4) tác dụng với dung dịch ở lọ (5) có khí thoát ra.
Hãy xác định dung dịch có trong mỗi lọ, viết các phương trình hoá học xảy ra.
(Xem giải) 2. Hợp chất vô cơ A chứa 46,67% iron, còn lại là sulfur. Hoàn thành các phản ứng sau:
A + O2 → B + C (1)
B + O2 (V2O5, t°) ⇋ D (2)
D + E → F (3)
Mg + F → G + H + E (4)
H + O2 → I + E (5)
I + O2 → B (6)
B + Br2 + E → F + M (7)
Cho biết A, B, C, D, E, F, G, H, I, M là các chất vô cơ khác nhau.
Câu II (2,0 điểm).
(Xem giải) 1. Các chất hữu cơ X, Y, Z, T đều có công thức dạng CnH2nOn (MX < MY < MZ = MT < 100). Biết:
– Chất X tan tốt trong nước và có phản ứng với thuốc thử Tollens.
– Chất Y có phản ứng với Na và thuốc thử Tollens.
– Chất Z phản ứng được với Na, dung dịch NaOH (đun nóng, sản phẩm tạo thành chỉ gồm các hợp chất hữu cơ) nhưng không tác dụng với NaHCO3.
– Dung dịch chất T làm đổi màu quỳ tím thành đỏ; khi T phản ứng với Na thì số mol H2 thu được bằng số mol T đã tham gia phản ứng.
Xác định công thức cấu tạo của X, Y, Z, T.
(Xem giải) 2. X là hợp chất hữu cơ đơn chức, mạch không phân nhánh, công thức phân tử có dạng CnH2nO2. Phổ khối lượng và phổ hồng ngoại của X như sau:
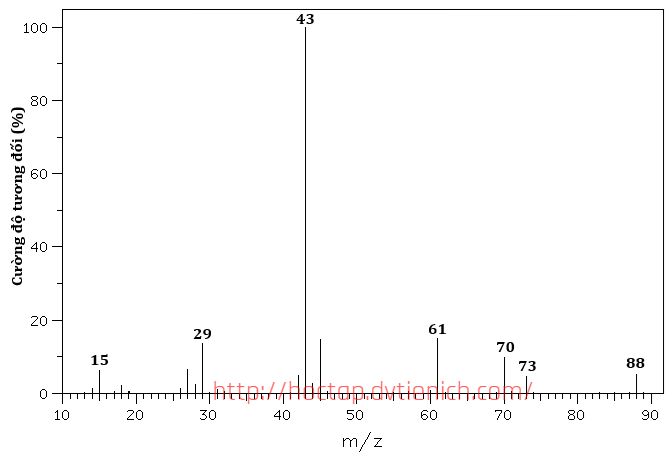

a) Xác định công thức phân tử của X.
b) Viết công thức cấu tạo của X. Giải thích ngắn gọn.
Câu III (2,0 điểm).
(Xem giải) 1. Nung 25 gam một mẫu quặng malachite có thành phần chính là Cu(OH)2.CuCO3 (còn lại là tạp chất trơ) trong không khí đến khối lượng không đổi. Cho toàn bộ lượng chất rắn thu được (gồm CuO và tạp chất trơ) vào cốc thủy tinh, sau đó cho từ từ dung dịch H2SO4 19,6% vào cốc cho đến khi chất rắn không tan thêm được nữa thì dừng lại, lọc bỏ tạp chất trơ thu được dung dịch X. Làm lạnh toàn bộ dung dịch X xuống 10°C thu được dung dịch Y có nồng độ 14,16% và tách ra 25 gam tinh thể CuSO4.5H2O.
a) Viết các phương trình hoá học xảy ra.
b) Tính phần trăm theo khối lượng của Cu trong 25 gam mẫu quặng malachite trên.
(Xem giải) 2. Hòa tan hoàn toàn m gam hỗn hợp X gồm magnesium và iron trong dung dịch H2SO4 loãng, thu được dung dịch Y và 4,958 lít khí H2. Thêm tiếp a gam bột một oxide của iron vào dung dịch Y thu được dung dịch Z. Cho dung dịch KMnO4 0,3 M vào Z, đến khi phản ứng xảy ra hoàn toàn thì hết 200 mL, thu được dung dịch có chứa H2SO4 và 145,48 gam hỗn hợp muối trung hòa. Xác định m và a.
Câu IV (2,0 điểm).
(Xem giải) 1. Bột ngọt (muối monosodium của glutamic acid) là một loại gia vị, được sản xuất từ dung dịch NaOH 40% và tinh thể glutamic acid (chứa 80% acid). Bột ngọt thu được có độ tinh khiết 99%. Giả thiết hiệu suất của cả quá trình tính theo glutamic acid là 90%. Để thu được 1200 gói bột ngọt (mỗi gói nặng 1 kg) cần m tấn tinh thể glutamic acid.
a) Tính m.
b) Đặt glutamic acid ở pH = 8,0 vào trong một điện trường. Hãy nêu và giải thích sự dịch chuyển của glutamic acid về các điện cực.
(Xem giải) 2. Một nhà máy sản xuất xà phòng từ mỡ lợn chứa các chất béo, có tỉ lệ số mol như sau: n(C17H35COO)3C3H5 : n(C15H31COO)3C3H5 : n(C17H33COO)3C3H5 = 1 : 2 : 2. Sau khi tính toán lượng mỡ cần thiết, hòa trộn nguyên liệu với phụ gia, chất độn và dung dịch xút ở 32°C đến 35°C để thu được một hỗn hợp đồng nhất. Rót hỗn hợp vào khuôn sắt để phản ứng xà phòng hóa xảy ra. Giữ khuôn ở 30°C trong suốt quá trình phản ứng. Phản ứng sẽ kết thúc sau vài giờ, nhưng cần giữ xà phòng ở trong khuôn vài ngày cho sản phẩm đạt độ cứng cần thiết. Cuối cùng, cắt xà phòng thành từng bánh có khối lượng 100 gam/1 bánh, đóng nhãn và bao gói.
Dưới đây là bảng giá nguyên liệu và các chi phí:
| STT | Nội dung | Đơn giá |
| 1 | Mỡ lợn | 80.000/1 kg |
| 2 | Dung dịch NaOH 40% | 20.000/1 kg |
| 3 | Phụ gia + chất độn | 100.000/1 kg |
| 4 | Nhân công, máy móc, chi phí khác | 4.000/1 bánh xà phòng |
a) Viết các phương trình hoá học xảy ra.
b) Hãy tính giá tiền của 1 bánh xà phòng mà nhà máy trên sản xuất (theo đơn giá đồng). Giả sử hiệu suất phản ứng đạt 90% (đối với cả 3 loại triester) và khối lượng muối của acid béo trong xà phòng thành phẩm chiếm 75,5% về khối lượng, còn lại là chất phụ gia và chất độn.
Câu V (2,0 điểm).
(Xem giải) 1. Tiến hành 4 thí nghiệm sau:
a) Thí nghiệm 1: Nghiền nhỏ 1 gam CH3COONa khan cùng với 2 gam vôi tôi xút (CaO + NaOH) rồi cho vào đáy ống nghiệm có lắp ống dẫn khí. Đun nóng từ từ, sau đó đun nóng mạnh phần ống nghiệm có chứa hỗn hợp phản ứng đồng thời đưa đầu ống dẫn khí sục vào dung dịch KMnO4 1%. Nêu hiện tượng và giải thích, viết các phương trình hóa học xảy ra.
b) Thí nghiệm 2: Cho 2 mL cồn 96° vào ống nghiệm khô có sẵn vài viên đá bọt, sau đó cho thêm từng giọt dung dịch H2SO4 đặc (4 mL), đồng thời lắc đều. Đun nóng hỗn hợp phản ứng (ở nhiệt độ khoảng 180°C) sao cho hỗn hợp không trào lên ống dẫn khí. Dẫn khí vào dung dịch bromine. Nêu hiện tượng và giải thích, viết các phương trình hóa học xảy ra.
c) Thí nghiệm 3: Cho một vài mẩu đất đèn bằng hạt ngô vào một ống nghiệm chứa sẵn 2 mL H2O. Đậy nhanh nút có ống dẫn khí gấp khúc sục vào ống nghiệm khác chứa 2 mL dung dịch AgNO3 trong NH3. Nêu hiện tượng và giải thích, viết các phương trình hóa học xảy ra.
d) Thí nghiệm 4: Cho vào cùng một ống nghiệm 3 chất lỏng (2 mL dung dịch HNO3 đặc, 4 mL dung dịch H2SO4 đặc và 2 mL benzene), lắc đều, ngâm trong cốc nước 60°C trong 5 phút, rót sản phẩm vào cốc nước lạnh. Nêu hiện tượng và giải thích, viết các phương trình hóa học xảy ra.
(Xem giải) 2. Nêu nguồn gốc phát sinh NOx trong không khí? Đề xuất các biện pháp nhằm cắt giảm các nguồn phát thải đó.
PHẦN 2. TRẮC NGHIỆM (10 điểm)
1. Câu trắc nghiệm nhiều phương án lựa chọn (8 điểm). Thí sinh trả lời từ câu 1 đến câu 32. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Cấu hình electron hóa trị của nguyên tử các nguyên tố nhóm IIA trong bảng tuần hoàn là
A. np2. B. ns2. C. ns2np2. D. ns2np4.
(Xem giải) Câu 2. Phát biểu nào sau đây sai?
A. Hầu hết các nguyên tử được cấu thành từ các hạt cơ bản là proton, neutron và electron.
B. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
C. Hạt nhân của tất cả các nguyên tử đều chứa proton.
D. Vỏ nguyên tử cấu thành từ các hạt electron.
(Xem giải) Câu 3. Không sử dụng chai, lọ thuỷ tinh mà thường dùng chai nhựa để chứa, đựng, bảo quản hydrohalic acid nào sau đây?
A. HCl. B. HF. C. HBr. D. HI.
(Xem giải) Câu 4. Linamarin là một glucoside có mặt trong lá và rễ của cây sắn, là nguyên nhân gây ra say sắn hay ngộ độc sắn. Linamarin có cấu tạo phân tử như sau:
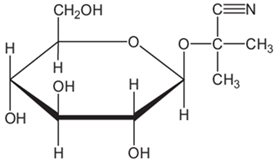
Số nhóm chức alcohol trong phân tử linamarin là
A. 6. B. 4. C. 3. D. 5.
(Xem giải) Câu 5. Polymer nào sau đây được dùng làm chất dẻo?
A. Poly(vinyl chloride). B. Polybuta-1,3-diene.
C. Polyacrylonitrile. D. Poly(hexamethylene adipamide).
(Xem giải) Câu 6. Một học sinh tiến hành làm các thí nghiệm sau:
(a) Cho 1,6 mol carbon dioxide vào dung dịch chứa 1 mol barium hydroxide.
(b) Cho dung dịch chứa 5 mol silver nitrate vào dung dịch chứa 1 mol iron(II) chloride.
(c) Cho dung dịch chứa 1 mol calcium hydrogencarbonate vào dung dịch chứa 1 mol sodium hydroxide.
(d) Cho 2 mol barium vào dung dịch chứa 1 mol aluminium sulfate.
Sau khi kết thúc các phản ứng, số thí nghiệm sản phẩm thu được hai kết tủa là
A. 3. B. 1. C. 2. D. 4.
(Xem giải) Câu 7. Cho các chất sau: ClH3NCH2COOH; H2NCH(CH3)CONHCH2COOH; (CH3NH3)2SO4; H2NCH2CONHCH2COOH; (CH3COO)2C2H4. Số chất khi tác dụng với dung dịch NaOH dư, đun nóng, thu được dung dịch chứa một muối là
A. 2. B. 1. C. 4. D. 3.
(Xem giải) Câu 8. Cho biết biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
CO (g) + O2 (g) → CO2 (g) ![]() = -283,0 kJ
= -283,0 kJ
Biết ![]() (CO2 (g)) = -393,5 kJ. Nhiệt tạo thành chuẩn của CO là
(CO2 (g)) = -393,5 kJ. Nhiệt tạo thành chuẩn của CO là
A. -110,5 kJ. B. +110,5 kJ. C. + 221,0 kJ. D. -221,0 kJ.
(Xem giải) Câu 9. Nguyên tử X có tổng số electron thuộc phân lớp p là 6, nguyên tử Y có 4 lớp electron và có 2 electron ở lớp ngoài cùng, electron cuối cùng điền vào phân lớp s. Biết rằng X và Y thuộc hai nhóm liên tiếp trong bảng tuần hoàn các nguyên tố hoá học. Phát biểu nào sau đây sai?
A. Liên kết trong phân tử oxide cao nhất của X là liên kết ion.
B. Hydroxide của X khi tan trong nước tạo dung dịch có tính base mạnh.
C. Ở trạng thái cơ bản, nguyên tử X có 3 lớp electron và có 2 electron độc thân.
D. X, Y là kim loại có tính khử mạnh.
(Xem giải) Câu 10. Có 4 dung dịch: HCl, NH4Cl, Na2CO3 và CH3COOH cùng nồng độ được kí hiệu ngẫu nhiên là X, Y, Z, T. Giá trị pH của các dung dịch trên được cho trong bảng sau:
| Dung dịch | X | Y | Z | T |
| pH | 5,25 | 11,53 | 3,01 | 1,25 |
Các dung dịch X, Y, Z, T lần lượt là
A. CH3COOH, NH4Cl, HCl, Na2CO3. B. NH4Cl, CH3COOH, HCl, Na2CO3.
C. Na2CO3, HCl, NH4Cl, CH3COOH. D. NH4Cl, Na2CO3, CH3COOH, HCl.
(Xem giải) Câu 11. Trong nước mưa acid thường có pH = 4 đến pH = 5. pH trong nước mưa acid thấp chủ yếu là do có chứa các acid như HNO3, H2SO4. Trong tự nhiên, HNO3 còn được tạo ra từ N2 theo sơ đồ chuyển hóa: N2 → NO → NO2 → HNO3. Phát biểu nào sau đây đúng?
A. Các phản ứng trong sơ đồ trên đều xảy ra ở điều kiện thường.
B. HNO3 sinh ra từ quá trình trên sẽ cung cấp một lượng phân đạm cho cây trồng ở dạng NO3-.
C. Acid HNO3 có tính khử mạnh.
D. Một cơn mưa acid, nước mưa có pH = 4 thì nồng độ HNO3 có trong nước mưa đó là 10^-4 M.
(Xem giải) Câu 12. Geranial (chứa 78,94% carbon, 10,53% hydrogen, 10,53% oxygen về khối lượng) có trong tinh dầu sả có tác dụng sát trùng, chống căng thẳng, giảm mệt mỏi,… Người ta đã tiến hành phân tích nguyên tố và đo phổ khối lượng của geranial, thu được giá trị m/z của peak ion phân tử [M+] bằng 152. Cho biết geranial có cấu tạo mạch hở. Tổng số liên kết xích ma (σ) trong một phân tử geranial là
A. 26. B. 27. C. 25. D. 29.
(Xem giải) Câu 13. Hợp chất X có tác dụng kháng khuẩn, chống vi sinh vật kí sinh trên da. Biết X có công thức phân tử C7H8O và chứa vòng benzene, phổ IR của X có peak hấp thụ rộng ở vùng 3300 cm-1. Oxi hóa X bằng CuO nung nóng, thu được hợp chất Y có peak hấp thụ đặc trưng ở khoảng 1700 cm-1. Phát biểu nào sau đây đúng?
A. Phổ IR của X có peak hấp thụ rộng ở vùng 3300 cm-1 nên X có nhóm C=O .
B. Phổ IR của Y có peak hấp thụ rộng ở vùng 1700 cm-1 nên Y có nhóm -OH.
C. X là benzyl alcohol, Y là aldehyde benzoic.
D. Y tan nhiều trong nước hơn X.
(Xem giải) Câu 14. Methadone là một loại thuốc dùng trong cai nghiện ma túy, nó thực chất cũng là một loại chất gây nghiện nhưng nhẹ hơn các loại ma túy thông thường và dễ kiểm soát hơn. Công thức cấu tạo của nó như hình bên:
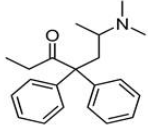
Phát biểu nào sau đây đúng?
A. Methadone bị khử bởi LiAlH4 tạo alcohol bậc 1.
B. Công thức phân tử của methadone là C21H25NO.
C. Methadone không phản ứng với thuốc thử Tollens.
D. Methadone làm mất màu nước bromine.
(Xem giải) Câu 15. Methyl salicylate dùng làm chất giảm đau (có trong miếng dán giảm đau khi vận động hoặc chơi thể thao) được điều chế từ salicylic acid (hay 2–hydroxylbenzoic acid) và methanol. Phát biểu nào sau đây đúng?
A. Công thức phân tử của salicylic acid là C7H8O3.
B. 1 mol methyl salicylate phản ứng tối đa với 2 mol Ba(OH)2 trong dung dịch.
C. Methyl salicylate thuộc loại hợp chất hữu cơ đa chức.
D. Phân tử khối của methyl salicylate là 152.
(Xem giải) Câu 16. Một disaccharide X không tác dụng với dung dịch AgNO3/NH3. Thuỷ phân X (xúc tác acid) thu được dung dịch Y chứa monosaccharide Z. Z làm mất màu dung dịch bromine, tạo kết tủa Ag với thuốc thử Tollens. Phát biểu nào sau đây sai?
A. Dung dịch Y chứa 2 monosaccharide là đồng phân cấu tạo của nhau.
B. Z ở dạng mạch hở có 5 nhóm hydroxyl và 1 nhóm aldehyde.
C. Sự hình thành cấu tạo vòng của Z là do phản ứng thuận nghịch giữa nhóm -OH trên carbon số 5 với nhóm –CH=O.
D. X chỉ tồn tại ở dạng mạch vòng, giữa 2 đơn vị monosaccharide có liên kết α-1,1-glycoside.
(Xem giải) Câu 17. Mỗi enzyme có một khoảng pH tối ưu. Môi trường pH cao quá hoặc thấp quá sẽ ảnh hưởng đến hoạt tính của enzyme. Giá trị pH mà tại đó enzyme hoạt động mạnh nhất được gọi là giá trị pH tối ưu. Biểu đồ hoạt động của một số enzyme tiêu hóa trong cơ thể người (A là pepsin, B là amylase, C là trypsin).
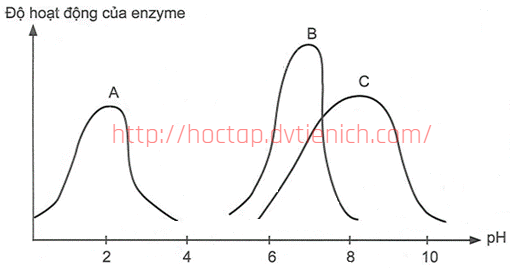
Cho các phát biểu sau:
(a) Giá trị pH tối ưu của pepsin là 2.
(b) Trong cơ thể người enzyme amylase tạo ra ở tuyến nước bọt và tuyến tuỵ.
(c) Trypsin là enzyme có trong thành phần của dịch vị dạ dày.
(d) Xác định pH tối ưu của các enzyme có thể giúp cải thiện hiệu suất các phản ứng hóa học hoặc sinh hóa.
Số phát biểu đúng là
A. 4. B. 2. C. 1. D. 3.
(Xem giải) Câu 18. Pin Galvani được coi là nguồn điện hoá học đầu tiên mà con người phát minh ra. Pin Galvani Zn-Cu được biểu diễn ở hình sau:
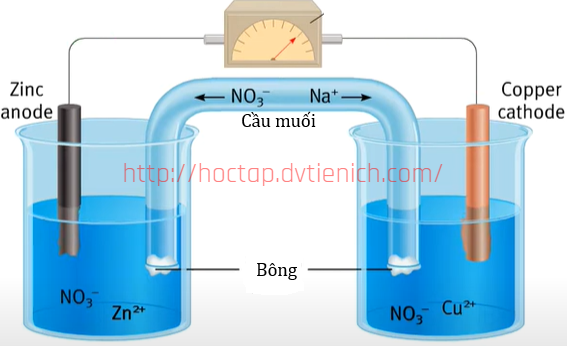
Phát biểu nào sau đây sai?
A. Khi pin hoạt động, khối lượng thanh Zn giảm dần.
B. Electron chuyển từ thanh Zn qua dây dẫn đến thanh Cu. Cầu muối đóng vai trò khép kín mạch và trung hoà điện tích của dung dịch ở hai điện cực.
C. Biết thế điện cực chuẩn của cặp oxi hoá – khử Zn2+/Zn là -0,76 V và Cu2+/Cu là +0,340 V. Sức điện động của pin Galvani Zn-Cu có giá trị bằng 1,10V.
D. Điện cực âm xảy ra quá trình khử Zn, điện cực dương xảy ra quá trình oxi hóa ion Cu2+.
(Xem giải) Câu 19. Trong công nghiệp, đồng phế liệu hoặc đồng thô (chứa đồng và các tạp chất trơ) được tinh chế bằng phương pháp điện phân. Bình điện phân tinh chế đồng chứa dung dịch muối CuSO4 trong dung dịch H2SO4, anode bằng đồng thô và cathode là đồng tinh khiết.
(a) Tại anode, xảy ra quá trình: 2H+ + 2e → H2.
(b) Tại cathode, xảy ra quá trình: Cu → Cu2+ + 2e.
(c) Trong quá trình điện phân, pH dung dịch giảm dần.
(d) Nồng độ Cu2+ không thay đổi trong quá trình điện phân.
Số phát biểu đúng là
A. 3. B. 4. C. 1. D. 2.
(Xem giải) Câu 20. Cho cân bằng hoá học sau: N2(k) + 3H2(k) ⇋ 2NH3(k). Biết khi nhiệt độ tăng, tỉ khối của hỗn hợp sau phản ứng giảm. Cho 0,3 mol khí hydrogen và 0,1 mol khí nitrogen vào một bình kín dung tích 1 lít, có bột iron xúc tác, giữ bình ở 450°C. Ở trạng thái cân bằng có 20% nitrogen chuyển hoá thành sản phẩm. Cho các phát biểu sau:
(a) Phản ứng thuận là phản ứng thu nhiệt.
(b) Hằng số cân bằng của phản ứng ở nhiệt độ trên là 2,4468.
(c) Khi tăng áp suất của hệ, cân bằng chuyển dịch theo chiều thuận.
(d) Giữ nguyên nồng độ của N2, tăng nồng độ của H2 lên 3 lần, thì tốc độ phản ứng tăng lên 9 lần.
Số phát biểu đúng là
A. 4. B. 1. C. 2. D. 3.
(Xem giải) Câu 21. Trong nông nghiệp, ammonium sulfate được sử dụng làm phân bón gọi là đạm một lá. Nó thích hợp bón cho các loại đất có tính kiềm. Để sản xuất ammonium sulfate trong công nghiệp người ta tiến hành quy trình từ nguyên liệu NH3, CO2 và CaSO4.2H2O theo 2 giai đoạn như sau:
• Giai đoạn 1: Hấp thụ khí NH3 vào bể chứa nước và sục khí CO2 ở áp suất cao, thu được dung dịch (NH4)2CO3 theo phương trình sau:
2NH3 + CO2 + H2O → (NH4)2CO3
• Giai đoạn 2: Cho thạch cao CaSO4.2H2O vào dung dịch (NH4)2CO3 để thực hiện phản ứng hóa học:
(NH4)2CO3 + CaSO4.2H2O → (NH4)2SO4 + CaCO3 + 2H2O
Tách lấy phần dung dịch, làm bay hơi nước thu được tinh thể (NH4)2SO4. Biết hiệu suất của giai đoạn 1 và giai đoạn 2 lần lượt là 80% và 80%. Muốn điều chế được 10,56 tấn (NH4)2SO4 thì cần dùng ít nhất x m³ khí NH3 và y tấn CaSO4.2H2O. Giá trị của x và y lần lượt là
A. 9,29625 và 17,2. B. 9,29625 và 34,4. C. 6,1975 và 13,76. D. 6,1975 và 17,2.
(Xem giải) Câu 22. Thực hiện phản ứng reforming heptane, thu được hỗn hợp sản phẩm có chứa ba hydrocarbon X1, X2, X3. Trong phân tử X1 có chứa vòng benzene, X2 là hợp chất no mạch hở có chứa một nguyên tử carbon bậc III và một nguyên tử carbon bậc IV. Hydrogen hoá hoàn toàn X1 thu được X3. Hợp chất X1 phản ứng với bromine trong điều kiện chiếu sáng thu được dẫn xuất monobromo X4, còn trong điều kiện đun nóng với xúc tác iron(III) bromide thì thu được dẫn xuất monobromo X5, X6. Khi đun nóng X1 với dung dịch potassium permanganate thu được hợp chất hữu cơ X7. X1 phản ứng với hỗn hợp nitric acid và sulfuric acid thu được hợp chất X8, là thành phần chính của một loại thuốc nổ. Phát biểu nào sau đây sai?
A. Tên thay thế của X2 là 2,2,3-trimethylbutane.
B. Công thức phân tử của X8 là C7H5N3O6.
C. Tổng phân tử khối của X5 và X7 là 333.
D. X4 tác dụng được với dung dịch NaOH khi đun nóng.
(Xem giải) Câu 23. Lactic acid (C3H6O3) là hợp chất hóa học đóng vai trò quan trọng trong nhiều quá trình sinh hóa. Khi vận động mạnh, không được cung cấp đủ oxygen, cơ thể sẽ chuyển từ hô hấp hiếu khí sang hô hấp kị khí tạo lactic acid (gây hiện tượng mỏi cơ) và năng lượng theo phương trình sau:
C6H12O6(aq) → 2C3H6O3(aq)  = -150 kJ.
= -150 kJ.
Một người chạy bộ cần tiêu tốn 500 kcal (1 cal = 4,184 J) nhưng chỉ 98% năng lượng cho cơ thể được cung cấp nhờ oxygen qua hô hấp, phần còn lại nhờ vào sự chuyển hóa glucose thành lactic acid. Khối lượng lactic acid (gam) tạo ra từ glucose bằng cách hô hấp kị khí theo phương trình hóa học trên là a gam. Giá trị của a là (kết quả làm tròn đến hàng phần mười)
A. 50,2. B. 30,1. C. 30,2. D. 50,1.
(Xem giải) Câu 24. Hợp chất hữu cơ X (mạch carbon không phân nhánh) chứa 3 nguyên tố C, H, O. Kết quả phân tích nguyên tố của hợp chất hữu cơ X có chứa 64,61% carbon, 10,77% hydrogen, 24,62% oxygen về khối lượng. Người ta đã tiến hành phân tích nguyên tố và đo phổ khối lượng của X, thu được giá trị m/z của peak ion phân tử [M+] bằng 130. Cho biết phổ hồng ngoại của X như hình bên:

Cho các phát biểu sau:
(a) X có công thức phân tử là C7H14O2.
(b) Tổng số liên kết xích ma (σ) và liên kết pi (π) trong một phân tử X là 23.
(c) X hòa tan trong nước tốt hơn acetic acid.
(d) X vừa tác dụng được với dung dịch KOH, vừa tác dụng được với CaCO3.
Số phát biểu đúng là
A. 4. B. 2. C. 3. D. 1.
(Xem giải) Câu 25. X, Y là hai ester đều đơn chức, cùng dãy đồng đẳng; Z là ester 2 chức (X, Y, Z đều mạch hở). Đun nóng 5,7m gam hỗn hợp E gồm X, Y, Z (số mol Y lớn hơn số mol của Z và MY > MX) với dung dịch NaOH vừa đủ được hỗn hợp F gồm 2 alcohol kế tiếp trong dãy đồng đẳng và hỗn hợp muối G. Cho toàn bộ F vào bình đựng Na dư, kết thúc phản ứng, khối lượng bình tăng 8,56 gam và có 0,12 mol khí H2 thoát ra. Cho toàn bộ G phản ứng hoàn toàn với vôi tôi xút, nung nóng chỉ thu được một hydrocarbon đơn giản nhất có khối lượng m gam. Cho các phát biểu sau:
(a) G chứa 2 muối.
(b) Hydrocarbon đơn giản nhất là C2H4.
(c) Giá trị của m là 3,2.
(d) Công thức cấu tạo của Y là CH3COOC2H5.
Số phát biểu đúng là
A. 4. B. 2. C. 3 D. 1.
(Xem giải) Câu 26. Một quả cầu làm bằng sắt (iron) có bán kính 5 cm cần được mạ đồng (copper) để tăng khả năng chống ăn mòn và nâng cao thẩm mỹ. Lớp mạ phải đồng nhất và có độ dày là 2.10^-4 cm. Người ta dùng phương pháp điện phân dung dịch CuSO4 dư với cathode là quả cầu sắt và anode làm bằng đồng, cường độ dòng điện I = 5A, hiệu suất của cả quá trình mạ là 80%. Biết khối lượng riêng của Cu là 8,96 g/cm³, công thức tính thể tích hình cầu V = 4πr³/3, π = 3,14, hằng số Faraday F = 96500 C/mol (kết quả cuối cùng làm tròn đến hàng phần trăm). Cho các phát biểu sau:
(a) Tại anode, xảy ra quá trình: Cu2+ + 2e → Cu.
(b) Thể tích quả cầu sau khi mạ đồng bằng 523,33 cm³.
(c) Kết thúc quá trình điện phân, khối lượng cathode tăng 0,56 gam.
(d) Thời gian cần thiết để mạ xong quả cầu trên là 7,77 phút.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 1.
(Xem giải) Câu 27. Hỗn hợp X có khối lượng 12,25 gam gồm kim loại M (hoá trị II không đổi) và muối halide của một kim loại kiềm. Cho X vào 200 mL dung dịch H2SO4 đặc, nóng, dư. Sau khi phản ứng xảy ra thu được dung dịch Y và 7,437 lít hỗn hợp khí Z gồm hai khí có tỉ khối đối với H2 bằng 27,42. Tỉ khối giữa hai khí trong hỗn hợp Z là 1,7534. Để phản ứng hết với các chất trong dung dịch Y cần 200 mL dung dịch Ba(OH)2 nồng độ 2M và thu được 104,8 gam kết tủa. Lọc kết tủa và nung đến khối lượng không đổi được chất rắn T có khối lượng nhỏ hơn khối lượng kết tủa thu được. Dẫn khí Z qua nước, khí còn lại có thể tích 4,958 lít.
Cho các phát biểu sau:
(a) Z làm mất màu dung dịch nước bromine.
(b) Muối halide của kim loại kiềm là KCl.
(c) Nồng độ dung dịch H2SO4 ban đầu là 3 M.
(d) Trong nông nghiệp, muối MSO4 pha chế thuốc Bordeaux dùng để diệt nấm mốc cho cây trồng.
Số phát biểu đúng là
A. 3. B. 1. C. 2. D. 4.
(Xem giải) Câu 28. Sulfuric acid (H2SO4) là hợp chất quan trọng trong công nghiệp hoá chất, được sử dụng nhiều trong sản xuất phân bón, khai khoáng, chế biến dầu mỏ,…Trong công nghiệp, sulfuric acid 98% được sản xuất từ sulfur theo quy trình tiếp xúc, sử dụng thiết bị phản ứng dòng liên tục, mô tả trong hình dưới đây:
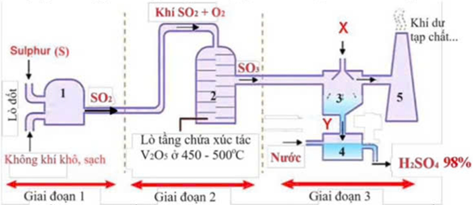
Cho các phát biểu sau:
(a) Số oxi hoá của sulfur thay đổi qua các giai đoạn: giai đoạn 1 từ 0 lên +4, giai đoạn 2 từ +4 lên +6.
(b) Trong giai đoạn 3, hoá chất X được thêm vào thiết bị phản ứng số 3 và thu được sản phẩm Y. X và Y lần lượt là oleum, H2SO4 đặc.
(c) Trong giai đoạn 2: 2SO2(g) + O2(g) ⇋ 2SO3(g); chất xúc tác V2O5, nhiệt độ khoảng 450°C, để tăng hiệu suất của phản ứng tạo thành SO3 thì cần giảm áp suất của phản ứng.
(d) Khí thải có chứa SO2 nếu không được xử lý thải ra môi trường sẽ góp phần gây ra hiện tượng phú dưỡng.
(đ) Để xác định công thức của Y, người ta pha loãng 8,36 gam Y vào nước thành 1,0 lít dung dịch Z, sau đó tiến hành chuẩn độ mỗi 10,0 mL dung dịch Z này bằng dung dịch NaOH 0,10M. Thể tích NaOH trung bình cần sử dụng để chuẩn độ là 20,0 mL, người ta đã xác định được trong phân tử Y có tổng 23 nguyên tử.
Số phát biểu đúng là
A. 4. B. 2. C. 1. D. 3.
(Xem giải) Câu 29. Hỗn hợp X gồm Mg và Fe; dung dịch Y chứa AgNO3 và Cu(NO3)2. Cho 10,8 gam X vào 200 mL Y, sau phản ứng thu được chất rắn Z (gồm 3 kim loại) và dung dịch T (thể tích dung dịch T thay đổi không đáng kể sau phản ứng). Hoà tan hết Z bằng dung dịch H2SO4 (đặc, nóng, dư), thu được 0,275 mol khí SO2 (sản phẩm khử duy nhất của S+6). Cho dung dịch KOH dư vào T, thu được kết tủa Q. Nung Q trong không khí đến khối lượng không đổi, thu được 12 gam chất rắn R. Biết các phản ứng xảy ra hoàn toàn. (Kết quả cuối cùng làm tròn đến hàng phần mười). Cho các nhận định sau:
(a) Dung dịch T có chứa 2 muối.
(b) Phần trăm khối lượng oxygen trong Q là 42,3%.
(c) Thành phần phần trăm theo khối lượng của Mg trong hỗn hợp X là 77,8%.
(d) Nồng độ mol/l của Fe(NO3)2 trong dung dịch T là 0,5M.
Số nhận định đúng là
A. 2. B. 1. C. 3. D. 4.
(Xem giải) Câu 30. Hợp chất X có công thức phân tử là C8H14O4. Từ X thực hiện các phản ứng (theo đúng tỉ lệ mol):
(1) X + NaOH (t°) → X1 + X2
(2) 2X1 + H2SO4 → 2X3 + Na2SO4
(3) X3 + C2H4(OH)2 (H2SO4 đặc, t°) ⇋ X4 + H2O
(4) X2 + 3C17H35COOH (H2SO4 đặc, t°) ⇋ X5 + 3H2O
Biết X3 có đồng phân hình học, X2 mạch không phân nhánh và có 1 nhóm CH3. Cho các phát biểu sau:
(a) Phân tử khối X5 là 904.
(b) X4 tác dụng được với cả Na và CaCO3.
(c) X1 có đồng phân hình học.
(d) Có 3 công thức cấu tạo thỏa mãn với X.
(đ) X2 được sinh ra khi thủy phân tristearin.
Số phát biểu đúng là
A. 4. B. 3. C. 2. D. 5.
(Xem giải) Câu 31. Cho hỗn hợp E gồm hai chất hữu cơ X (C3H11N3O5) và Y (C4H9NO4, tạo bởi carboxylic acid đa chức) đều mạch hở. Lấy 22,63 gam E tác dụng vừa đủ với dung dịch NaOH, cô cạn dung dịch thu được 23,46 gam hỗn hợp muối Z; một alcohol T và một amine G đều đơn chức. Biết các phản ứng xảy ra hoàn toàn. (Kết quả cuối cùng làm tròn đến hàng phần trăm). Cho các phát biểu sau đây:
(a) Dung dịch G làm quỳ tím chuyển sang màu xanh.
(b) T được dùng để sản xuất nước rửa tay khô.
(c) 0,6 mol E tác dụng với dung dịch KOH (dùng dư 15% so với lượng phản ứng), cô cạn dung dịch thu được 123,12 gam chất rắn khan.
(d) Phần trăm về số mol của X trong E là 53,33%.
Số phát biểu đúng là
A. 4. B. 1. C. 2. D. 3.
(Xem giải) Câu 32. Thủy phân hoàn toàn hỗn hợp A gồm hai ester hai chức X và Y (có tỉ lệ số mol nC(X) : nC(Y) = 25 : 156) cần dùng 92 gam dung dịch sodium hydroxide 20%, thu được hỗn hợp Z gồm ba muối (có tỉ lệ số mol nNa : nC = 23 : 59) và hỗn hợp T gồm hai alcohol no, mạch hở. Cho T tác dụng hoàn toàn với sodium dư, thu được 0,11 mol khí hydrogen. Biết rằng: MX < MY < 240, X có mạch hở. Trong hỗn hợp Z có một muối F (MF < 150) và phần trăm khối lượng của nguyên tố oxygen trong F là 12,307%. Công thức phân tử của X là
A. C13H16O4. B. C12H14O4. C. C6H10O4. D. C5H8O4.
2. Câu trắc nghiệm đúng sai (2 điểm). Thí sinh trả lời từ câu 1 đến câu 2. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 1. Trong công nghiệp, một nhà máy sản xuất nhôm bằng phương pháp điện phân nóng chảy Al2O3 như mô hình sau:
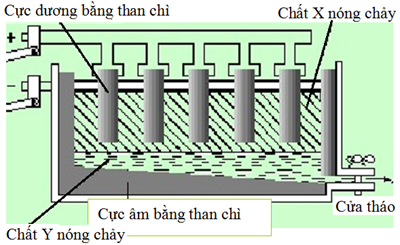
a) Nguyên liệu quan trọng trong quá trình sản xuất nhôm là quặng bauxite.
b) Chất X, Y lần lượt là nhôm, cryolite.
c) Trung bình để sản xuất được 900 kg nhôm, lượng điện cực than chì bị tiêu hao là 375 kg (giả thiết thành phần khí bay ra ở cực dương gồm 40% CO và 60% CO2 về thể tích).
d) Một cuộn giấy được tráng nhôm lên 2 bề mặt của giấy có chiều rộng 25 cm, chiều dài 5 m, độ dày 10^-3 mm. Để sản xuất được 10000 cuộn giấy bọc nhôm như trên thì khối lượng quặng bauxite (chứa 63,75% Al2O3) cần dùng là 0,26 tấn. Biết hiệu suất toàn bộ quá trình là 80%, khối lượng riêng của nhôm là 2,7 g/cm³.
(Xem giải) Câu 2. Thành phần chính của cao su thiên nhiên là polyisoprene. Công thức của một đoạn mạch cao su thiên nhiên là
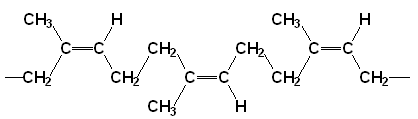
a) Các liên kết đôi trong mạch cao su đều ở dạng cis.
b) Cao su thiên nhiên không dẫn điện, không tan trong nước nhưng tan được trong một số dung môi hữu cơ như ethanol,…
c) Cao su thiên nhiên có khả năng phản ứng với sulfur tạo cao su lưu hóa có tính đàn hồi, chịu nhiệt, lâu mòn, khó tan.
d) Một loại cao su lưu hóa có 2,5 % sulfur về khối lượng. Trung bình 48 mắt xích isoprene có một cầu disulfide (-S-S-). Giả thiết rằng nguyên tử S đã thay thế cho các nguyên tử H ở cầu methylene (-CH2-) trong mạch cao su.


Bình luận