[2025] Thi thử TN sở GDĐT Long An (Lần 1 – Đề 2)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 085
⇒ Đề thi, đáp án và giải chi tiết:
| 1B | 2D | 3A | 4A | 5B | 6A | 7D | 8C | 9C |
| 10A | 11C | 12A | 13B | 14D | 15B | 16D | 17D | 18A |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | Đ | Đ | S | Đ | 0,53 | 330 | 2314 |
| (b) | S | S | Đ | S | 26 | 27 | 28 |
| (c) | S | Đ | Đ | S | 3 | 231 | 38,8 |
| (d) | Đ | S | S | Đ |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Tên gọi của ester CH3COOCH3 là
A. ethyl acetate. B. methyl acetate. C. methyl propionate. D. ethyl formate.
(Xem giải) Câu 2. Chất nào dưới đây là chất béo?
A. (CH3COO)3C3H5. B. (C15H31COO)2C3H6.
C. C17H33COOH. D. (C17H35COO)3C3H5.
(Xem giải) Câu 3. Một loại carbohydrate X không bị thủy phân trong môi trường acid và không làm mất màu nước bromine. X là chất nào dưới đây?
A. fructose. B. tinh bột. C. glucose. D. saccharose.
(Xem giải) Câu 4. Công thức cấu tạo thu gọn của methylamine là
A. CH3NH2. B. CH3NHCH3. C. CH3NHCH2CH3. D. CH3CH2NH2.
(Xem giải) Câu 5. Cho các phát biểu sau:
(1) Trong dung dịch, C2H5NH2 phản ứng với nước tạo ra ion C2H5NH3+ và ion OH-.
(2) Khi cho ethylamine phản ứng với dung dịch FeCl3 sẽ cho kết tủa nâu đỏ.
(3) Aniline có tính base và làm xanh quỳ tím ẩm.
(4) Tính base của aniline mạnh hơn ethylamine.
Các phát biểu đúng là
A. (1), (4). B. (1), (2). C. (1), (2), (3). D. (2), (3), (4).
(Xem giải) Câu 6. Lysine là một trong những amino acid thiết yếu đối với cơ thể con người. Với mỗi môi trường có giá trị pH bằng 5,6; 9,7; 12,0, coi lysine chỉ tồn tại ở dạng cho dưới đây:
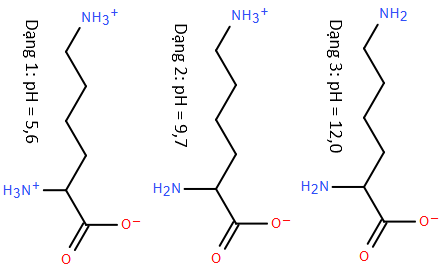
Trong quá trình điện di, ion sẽ di chuyển về phía điện cực trái dấu với ion. Cho các nhận định sau về quá trình điện di của lysine:
(a) Với môi trường pH = 9,7 thì dạng (2) hầu như không dịch chuyển về các điện cực.
(b) Với môi trường pH = 5,6 thì dạng (1) di chuyển về phía cực âm.
(c) Với môi trường pH = 12,0 thì dạng (3) di chuyển về phía cực dương.
(d) Với môi trường pH = 9,7 thì dạng (2) di chuyển về phía cực âm.
Số nhận định đúng là
A. 3. B. 2. C. 1. D. 4.
(Xem giải) Câu 7. Polyethylene được trùng hợp từ monomer nào?
A. CH2=CH-CN. B. C6H5-CH=CH2. C. CH2=CHCl. D. CH2=CH2.
(Xem giải) Câu 8. Trong số các kim loại gồm Li, Mg, Zn và Ag, ở điều kiện chuẩn kim loại nào có tính khử mạnh nhất?
A. Ag. B. Zn. C. Li. D. Mg.
(Xem giải) Câu 9. Ở điều kiện chuẩn, kim loại Fe khử được ion kim loại nào sau đây?
A. Li+. B. Mg2+. C. Ag+. D. Zn2+.
(Xem giải) Câu 10. “Trong tinh thể kim loại, liên kết kim loại được tạo nên do lực hút tĩnh điện giữa các …(1)… và các ion …(2)… kim loại ở nút mạng”. Nội dung phù hợp trong các ô trống (1), (2) lần lượt là
A. electron hoá trị chuyển động tự do, dương.
B. electron hóa trị chuyển động tự do, âm.
C. electron ở lớp ngoài cùng, âm.
D. electron ở lớp ngoài cùng, dương.
(Xem giải) Câu 11. Trong các kim loại sau, kim loại nào có tính dẻo cao, có thể kéo sợi, dát mỏng để tạo ra các đồ vật với nhiều hình dáng và mẫu mã đẹp?
A. Fe. B. Cr. C. Au. D. Hg.
(Xem giải) Câu 12. Ở trạng thái cơ bản, cấu hình electron nguyên tử của nguyên tố Mg (Z = 12) là
A. 1s2 2s2 2p6 3s2. B. 1s2 2s2 2p6 3s1. C. 1s2 2s2 2p6 3s2 3p1. D. 1s2 2s2 2p6.
(Xem giải) Câu 13. Thành phần chính của soda là sodium carbonate. Công thức của hợp chất này là
A. K2CO3. B. Na2CO3. C. KHCO3. D. NaHCO3.
(Xem giải) Câu 14. Phân tích một mẫu nước tự nhiên thấy chứa nhiều các ion: Na+, Ca2+, HCO3–, Cl– và SO42–. Chất nào sau đây không sử dụng để làm mềm mẫu nước trên?
A. Na2CO3. B. K2CO3. C. Na3PO4. D. KCl.
(Xem giải) Câu 15. Trong các chất: CH2=CH-CH2-CH=CH2, CH2=CH-CH=CH-CH3, (CH3)2C=CH-CH3, CH2=CH-CH3, số chất có đồng phân hình học là
A. 3. B. 1. C. 2. D. 4.
(Xem giải) Câu 16. Phản ứng hóa học của ethylene với nước Br2 được cho bởi phương trình: CH2 = CH2 + Br2 → CH2Br – CH2Br. Cơ chế của phản ứng trên xảy ra theo 2 giai đoạn như sau:
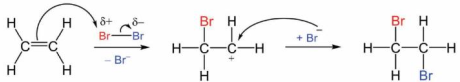
Cho các phát biểu sau:
(a) Giai đoạn 1, liên kết đôi phản ứng với tác nhân Brσ+ tạo thành phần tử mang điện dương.
(b) Giai đoạn 2, phần tử mang điện dương kết hợp với anion Br– tạo thành sản phẩm.
(c) Hiện tượng của phản ứng là nước bromine bị nhạt màu.
(d) Phản ứng trên thuộc loại phản ứng thế.
Số phát biểu đúng là
A. 3. B. 1. C. 4. D. 2.
(Xem giải) Câu 17. Điểm chớp cháy là nhiệt độ thấp nhất ở áp suất của khí quyển mà một chất lỏng hoặc vật liệu dễ bay hơi tạo thành lượng hơi đủ để bốc cháy trong không khí khi tiếp xúc nguồn lửa. Chất lỏng có điểm chớp cháy nhỏ hơn 37,8°C là chất lỏng dễ cháy. Trong khi chất lỏng có điểm chớp cháy lớn hơn 37,8°C là chất lỏng có thể gây cháy. Cho điểm chớp cháy của một số nhiên liệu lỏng như sau:
| Nhiên lệu | Xăng | Dầu hỏa | Acetone | Ethanol | Biodiesel |
| Điểm chớp cháy (°C) | -43 | 38 đến 72 | -20 | 13 | 130 |
Cho các phát biểu sau:
(a) Nguy cơ gây hỏa hoạn của ethanol cao hơn acetone và xăng.
(b) Xăng dễ bắt cháy hơn dầu hỏa.
(c) Biodiesel là nhiên liệu có nguy cơ gây hỏa hoạn thấp hơn xăng.
(d) Xăng, ethanol và dầu hỏa là chất lỏng dễ cháy, trong khi biodiesel là chất lỏng có thể gây cháy.
Số phát biểu đúng là
A. 1. B. 3. C. 4. D. 2.
(Xem giải) Câu 18. Trong tự nhiên, phản ứng giữa nitrogen và oxygen (trong cơn mưa dông kèm sấm sét) là khởi đầu cho quá trình tạo và cung cấp loại phân bón nào cho cây?
A. Phân đạm nitrate. B. Phân đạm ammonium.
C. Phân lân. D. Phân kali.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. Một học sinh tiến hành tổng hợp isoamyl acetate (thành phần chính của dầu chuối, khối lượng riêng 0,88 gam/mL) từ acetic acid và isoamyl alcohol với xúc tác H2SO4 đặc, ở nhiệt độ khoảng 145°C. Trước tiên, cho vào bình cầu 5 mL isoamyl alcohol 90%, 6 mL acetic acid 99% và vài giọt H2SO4 đặc làm xúc tác. Sau đó, lắp ống sinh hàn và đun hỗn hợp ở khoảng 145°C trong vòng 30–45 phút để phản ứng diễn ra. Khi phản ứng kết thúc, để nguội hỗn hợp rồi rót vào phễu chiết có chứa khoảng 20 mL nước cất. Tiến hành chiết để thu lấy isoamyl acetate theo mô hình thí nghiệm sau:
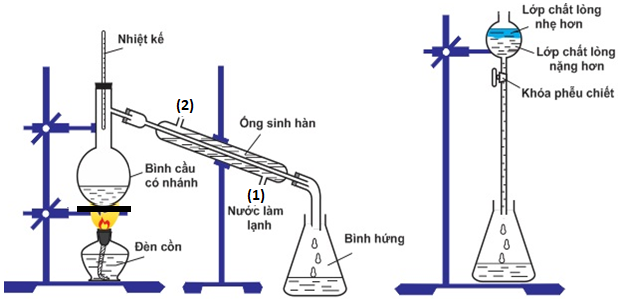
Cho biết nhiệt độ sôi của các chất như sau:
| Chất | acetic acid | isoamyl alcohol | isoamyl acetate |
| Nhiệt độ sôi (°C) | 117,9 | 131,1 | 142,0 |
a) Phản ứng tổng hợp trong thí nghiệm trên là phản ứng ester hóa.
b) Không dùng được phương pháp chưng cất phân đoạn để tách các chất lỏng trong hỗn hợp sau phản ứng.
c) Chất lỏng sinh ra có mùi dầu chuối nên trong bình hứng chỉ có isoamyl acetate.
d) Bộ dụng cụ chiết (được mô tả ở hình trên) dùng để tách các chất lỏng không tan vào nhau.Trong trường hợp này, isoamyl acetate là lớp chất lỏng nhẹ hơn và được thu sau cùng.
(Xem giải) Câu 20. Rỉ đường là sản phẩm phụ trong quá trình sản xuất và tinh luyện đường mía. Việc tận dụng rỉ đường làm môi trường nuôi cấy lactic acid có tiềm năng giảm thiểu ô nhiễm môi trường và góp phần phát triển bền vững. Một nhóm học sinh đã nghiên cứu quá trình sử dụng vi khuẩn Lactobacillus để lên men rỉ đường tạo lactic acid ở nhiệt độ 37°C, trong môi trường có pH = 6,0. Giả thuyết được đưa ra là: “với tỉ lệ rỉ đường càng cao (hàm lượng glucose càng lớn), lượng lactic acid thu được càng nhiều.”
Thí nghiệm được tiến hành như sau:
– Chuẩn bị dung dịch rỉ đường với các nồng độ: 5%, 10%, 15% và 20%. Mỗi mẫu được bổ sung 10% vi khuẩn Lactobacillus, sau đó thêm nước cất đến đủ 200 mL.
– Dùng hóa chất thích hợp để điều chỉnh pH môi trường đạt 6,0.
– Ủ các mẫu ở nhiệt độ 37°C trong vòng 30 giờ. Trong đó: mẫu 1: rỉ đường 5%, mẫu 2: rỉ đường 10%, mẫu 3: rỉ đường 15%, mẫu 4: rỉ đường 20%, mẫu trắng: rỉ đường 5% không bổ sung vi khuẩn Lactobacillus.
– Sau thời gian ủ, thể tích dung dịch các mẫu gần như không đổi. Mỗi mẫu được lấy 5 mL, pha loãng đến 100 mL, sau đó tiến hành chuẩn độ bằng dung dịch NaOH 0,1 M với chỉ thị phenolphthalein. Kết quả thu được như bảng sau:
| Mẫu | Mẫu trắng | Mẫu 1 | Mẫu 2 | Mẫu 3 | Mẫu 4 |
| Thể tích NaOH 0,1 M (mL) | 0,0 | 2,92 | 5,8 | 8,7 | 7,2 |
a) Dựa trên kết quả thí nghiệm, giả thuyết ban đầu của nhóm học sinh là sai.
b) Trong mẫu trắng, lượng lactic acid tạo thành rất nhiều nên không xác định bằng phương pháp chuẩn độ với NaOH.
c) Quá trình lên men tạo lactic acid đạt cao nhất ở tỷ lệ rỉ đường 15%.
d) Phương pháp thí nghiệm này được ứng dụng để sản xuất lactic acid từ rỉ đường mà không cần sử dụng vi khuẩn Lactobacillus.
(Xem giải) Câu 21. Một nhóm học sinh nhận thấy rằng thép (hợp kim của sắt và carbon với một số nguyên tố khác) dễ bị gỉ khi tiếp xúc với không khí ẩm, trong khi thiếc (Sn) lại có khả năng chống ăn mòn hiệu quả. Từ quan sát đó, nhóm đưa ra giả thuyết: “có thể mạ thiếc lên bề mặt thép bằng phương pháp điện phân để tạo thành lớp phủ bảo vệ”. Để kiểm tra giả thuyết này, nhóm học sinh đã thực hiện thí nghiệm như sau:
– Nối vật bằng thép với một điện cực và thanh thiếc với điện cực còn lại của nguồn điện một chiều.
– Nhúng cả hai điện cực vào dung dịch SnCl2.
– Tiến hành điện phân với hiệu điện thế phù hợp trong thời gian 20 phút.
– Sau khi điện phân, lấy vật thép ra và quan sát bề mặt thép thấy có lớp thiết mỏng, sáng bóng.
a) Trong thí nghiệm trên, vật bằng thép được nối với cực dương, thanh Sn được nối với cực âm của nguồn điện.
b) Ở anode, Sn bị oxi hóa thành Sn2+ và ở cathode, Sn2+ bị khử thành Sn.
c) Kết quả thí nghiệm chứng minh giả thuyết ban đầu của nhóm học sinh là đúng.
d) Phương pháp mạ thiếc này được ứng dụng rộng rãi trong sản xuất vỏ hộp đựng thực phẩm, giúp thép không bị gỉ vì thiếc có tính khử mạnh hơn sắt nên bị ăn mòn trước.
(Xem giải) Câu 22. Muối CuSO4 có màu trắng. Hòa tan CuSO4 vào nước thu được dung dịch X có màu xanh. Khi cho thêm vài giọt dung dịch NH3 vào X, sẽ tạo thành kết tủa màu xanh nhạt Cu(OH)2. Tiếp tục nhỏ đến dư NH3, kết tủa tan tạo thành dung dịch màu xanh lam chứa ion phức [Cu(NH3)4(H2O)2]2+.
a) Màu xanh của dung dịch X gây ra do phức chất [Cu(H2O)6]2+.
b) Trong ion phức [Cu(NH3)4(H2O)2]2+ thì Cu2+ là phối tử.
c) Liên kết hoá học trong ion phức [Cu(NH3)4(H2O)2]2+ là liên kết ion.
d) CuSO4 là hợp chất của kim loại chuyển tiếp.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Paracetamol còn được gọi là acetaminophen, là một loại thuốc có tác dụng hạ sốt và giảm đau. Paracetamol có thể tổng hợp trực tiếp từ 4-aminophenol và acetic anhydride theo phương trình như sau:

Để sản xuất 10000 hộp paracetamol (quy cách 10 vỉ × 10 viên mỗi hộp, mỗi viên hàm lượng 500 mg) với hiệu suất cả quá trình đạt 70% cần sử dụng m tấn 4-aminophenol (độ tinh khiết 98%). Tính giá trị của m. (làm tròn đến hàng phần trăm)
(Xem giải) Câu 24. Cho aniline tác dụng với nước bromine, sản phẩm thu được có chứa 2,4,6-tribromoaniline. Khối lượng mol (g/mol) của 2,4,6-tribromoaniline là bao nhiêu?
(Xem giải) Câu 25. Cho phương trình hóa học của các phản ứng được đánh số thứ tự từ 1 đến 4 dưới đây:
(1) nCH2=CH2 (t°, p, xt) → (-CH2-CH2-)n
(2) [-CH2-CH(C6H5)-]n (t°) → nCH2=CH-C6H5
(3) (-CH2-CH=CH-CH2-)n + nBr2 → (-CH2-CHBr-CHBr-CH2-)n
(4) nH2N(CH2)5COOH (t°) → [-HN(CH2)5CO-]n + nH2O
Gán số thứ tự phương trình hóa học của các phản ứng theo tên gọi: phản ứng cắt mạch polymer, phản ứng giữ nguyên mạch polymer, phản ứng trùng hợp, phản ứng trùng ngưng và sắp xếp theo trình tự thành dãy bốn số (ví dụ: 1234,4321,…).
(Xem giải) Câu 26. Có tổng số bao nhiêu đồng phân cấu tạo alcohol bậc 1 và bậc 2 ứng với công thức phân tử là C4H10O?
(Xem giải) Câu 27. Calcium oxide (CaO) còn được gọi là vôi sống, phần lớn được dùng làm vật liệu xây dựng. Ở một lò nung vôi, vôi sống được sản xuất bằng cách đun đá vôi (CaCO3) theo phương trình hóa học (1) như sau:
CaCO3(s) → CaO(s) + CO2(g) (1)
Phản ứng (1) là phản ứng thu nhiệt. Lượng nhiệt này được cung cấp từ quá trình đốt cháy nhiên liệu than đá theo phương trình hóa học (2):
C(s) + O2(g) → CO2(g) (2)
Xét các phản ứng ở điều kiện tiêu chuẩn, biết rằng:
– Than đá chứa 84% carbon về khối lượng, còn lại là các tạp chất trơ.
– Có 50% lượng nhiệt tỏa ra từ nhiên liệu được hấp thụ để phân huỷ đá vôi.
– Nhiệt tạo thành chuẩn của các chất được cho trong bảng sau:
| Chất | CaCO3(s) | CaO(s) | CO2(g) | C(s) |
| -1206,9 | -635,1 | -393,5 | 0,0 |
Tính khối lượng than đá làm nhiên liệu (theo kg, làm tròn đến hàng đơn vị) cần thiết để sản xuất được 1000 kg vôi sống trong giai đoạn trên.
(Xem giải) Câu 28. Sự gia tăng hàm lượng nitrate trong nước là một trong những nguyên nhân của hiện tượng phú dưỡng. Một trong những quy trình xác định hàm lượng nitrate trong nước được thực hiện như sau:
– Thí nghiệm 1: Lấy 10,0 mL dung dịch muối Mohr (FeSO4.(NH4)2SO4.6H2O), chuẩn độ bằng dung dịch KMnO4 (trong môi trường sulfuric acid loãng, dư).
– Thí nghiệm 2: Lấy 10,0 mL dung dịch muối Mohr cho vào 100 mL nước chứa ion nitrate, sau đó thêm NaOH(s) vào để đạt 28%, khi đó muối Mohr khử nitrate thành ammonia theo các phản ứng:
NO3-(aq) + 2Fe(OH)2 + H2O → NO2- + 2Fe(OH)3 (1)
NO2-(aq) + 6Fe(OH)2 + 5H2O → NH3 + 6Fe(OH)3 + OH- (2)
Sau khi các phản ứng (1) và (2) xảy ra hoàn toàn, lọc bỏ kết tủa, acid hoá dung dịch bằng dung dịch H2SO4 1 M và chuẩn độ lượng Fe2+ dư bằng dung dịch KMnO4 (các chất và ion khác trong dung dịch không phản ứng với KMnO4). Hãy cho biết mỗi mmol KMnO4 chênh lệch giữa thí nghiệm 1 với thí nghiệm 2 sẽ tương ứng với bao nhiêu mg NO3- trong nước. (Làm tròn đến hàng phần mười)


Bình luận