[2025] Thi thử TN cụm liên trường Quảng Nam
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 115
⇒ Đề thi, đáp án và giải chi tiết:
| 1A | 2A | 3D | 4B | 5A | 6C | 7B | 8C | 9C |
| 10D | 11A | 12A | 13C | 14D | 15B | 16C | 17A | 18A |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | S | Đ | S | Đ | 20 | 858 | 34,32 |
| (b) | Đ | S | Đ | Đ | 26 | 27 | 28 |
| (c) | Đ | Đ | S | S | 708 | 2 | 23,8 |
| (d) | Đ | Đ | Đ | S |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Biogas là một loại khí sinh học, được sản xuất bằng cách ủ kín các chất thải hữu cơ trong chăn nuôi, sinh hoạt. Biogas được dùng để đun nấu, chạy máy phát điện sinh hoạt gia đình. Thành phần chính của biogas là
A. CH4. B. CO2. C. N2. D. NH3.
(Xem giải) Câu 2. Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau:
| Chất | Thuốc thử | Hiện tượng |
| X, Y | Cu(OH)2 | Dung dịch xanh lam |
| Y | Thuốc thử Tollens | Kết tủa Ag trắng sáng |
| Z | Nước bromine | Kết tủa trắng |
| T | Quỳ tím | Quỳ tím chuyển màu xanh |
X, Y, Z, T lần lượt là
A. saccharose, glucose, aniline, ethylamine.
B. aniline, ethylamine, saccharose, glucose.
C. saccharose, aniline, glucose, ethylamine.
D. glucose, saccharose, aniline, ethylamine.
(Xem giải) Câu 3. Cho cân bằng hóa học: H2(g) + I2(g) ⇌ 2HI(g)
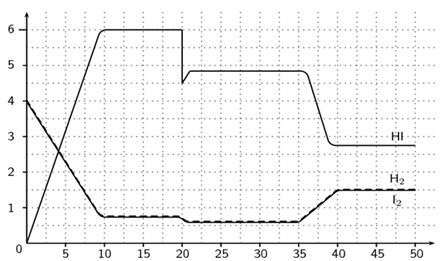
Quan sát đồ thị và cho biết sau bao nhiêu giây thì hệ đạt trạng thái cân bằng lần đầu tiên.
A. 20. B. 35. C. 40. D. 10.
(Xem giải) Câu 4. Xét phân tử xà phòng có cấu tạo như dưới đây:
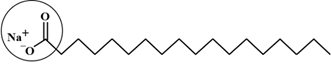
Nhóm được khoanh tròn trong công thức trên là
A. nhóm đồng thể. B. nhóm ưa nước.
C. nhóm dị thể. D. nhóm kị nước.
(Xem giải) Câu 5. Ethylene là một trong những hóa chất quan trọng, có nhiều ứng dụng trong sản xuất và đời sống như sản xuất polyethylene (PE), tổng hợp ethylic alcohol, sản xuất dung môi, kích thích quả mau chín,… Phản ứng hóa học của ethylene với dung dịch Br2 như sau: CH2=CH2 + Br2 → CH2Br – CH2Br. Cơ chế của phản ứng trên xảy ra theo 2 giai đoạn:
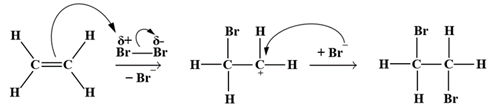
Phát biểu nào sau đây không đúng?
A. Ở giai đoạn 1, liên kết đôi tương tác với tác nhân Brδ- tạo thành phần tử mang điện dương.
B. Phản ứng trên thuộc loại phản ứng cộng.
C. Giai đoạn 1 xảy ra chậm hơn giai đoạn 2 nên giai đoạn 1 quyết định tốc độ của phản ứng.
D. Ở giai đoạn 2, phần tử mang điện dương kết hợp với anion tạo thành sản phẩm.
(Xem giải) Câu 6. Dung dịch nào sau đây có khả năng ăn mòn thủy tinh vô cơ?
A. HBr. B. HCl. C. HF. D. HI.
(Xem giải) Câu 7. Hợp chất hữu cơ X có công thức phân tử trùng với công thức đơn giản nhất. Trong X, tỉ lệ khối lượng các nguyên tố là mC : mH : mO = 21 : 2 : 8. Tổng số nguyên tử trong công thức phân tử hợp chất X là
A. 32. B. 17. C. 31. D. 16.
(Xem giải) Câu 8. Silicon là nguyên tố được sử dụng để chế tạo vật liệu bán dẫn, có vai trò quan trọng trong sản xuất công nghiệp,… Nguyên tử silicon có phân lớp electron ngoài cùng là 3p2. Phát biểu nào sau đây không đúng?
A. Hạt nhân nguyên tử silicon có 14 hạt proton.
B. Trong bảng tuần hoàn, silicon nằm ở chu kì 3.
C. Số electron độc thân trong nguyên tử silicon bằng 0.
D. Silicon thuộc khối nguyên tố p.
(Xem giải) Câu 9. Tơ nylon-6,6 thuộc loại tơ nào sau đây?
A. Tơ bán tổng hợp. B. Tơ thiên nhiên. C. Tơ tổng hợp. D. Tơ polyester.
(Xem giải) Câu 10. Cation Co3+ kết hợp với anion C2O42- và phân tử H2O tạo phức có công thức như sau: [Co(C2O4)2(OH2)2]-. Phát biểu nào sau đây không đúng?
A. Cation Co3+ tạo được 6 liên kết sigma (σ) kiểu cho – nhận với các phối tử.
B. Phối tử ở trong phức trên là anion C2O42- và phân tử H2O.
C. Mỗi anion C2O42- sử dụng 2 cặp electron hoá trị riêng để tạo liên kết cho – nhận với cation kim loại.
D. Mỗi phân tử H2O sử dụng 2 cặp electron hoá trị riêng để tạo liên kết cho – nhận với cation kim loại.
(Xem giải) Câu 11. Dạng mạch vòng của α-glucose có cấu tạo như hình dưới đây.
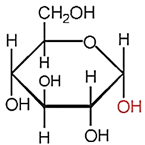
Nhóm −OH hemiacetal ở vị trí của carbon số
A. 1. B. 4. C. 6. D. 2.
(Xem giải) Câu 12. Cho các phát biểu sau:
(a) Thả một dây đồng vào dung dịch silver nitrate, phản ứng kết thúc thấy có kim loại màu trắng xám bám trên dây đồng.
(b) Tất cả các ion kim loại chỉ bị khử.
(c) Ở điều kiện thường, tất cả kim loại đều ở thể rắn, có tính dẻo, dẫn điện, dẫn nhiệt, có ánh kim.
(d) Các kim loại có tính khử mạnh đều khử được copper (II) ion trong dung dịch thành copper.
Số phát biểu không đúng là
A. 3. B. 1. C. 4. D. 2.
(Xem giải) Câu 13. Glutamic acid có các dạng tồn tại và giá trị pH mà dạng tồn tại đó là chủ yếu (≈ 100%) như sau:
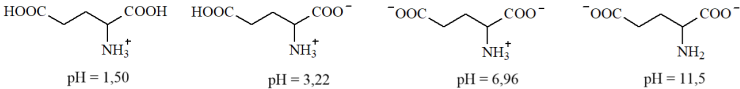
Giá trị pH của dung dịch bằng bao nhiêu thì glutamic acid không bị điện di?
A. 1,50. B. 11,50. C. 3,22. D. 6,96.
(Xem giải) Câu 14. Dẫn khí chlorine vào dung dịch KI dư, thu được dung dịch X. Nhỏ vài giọt hồ tinh bột vào dung dịch X thì dung dịch chuyển sang màu gì?
A. Đỏ nâu. B. Vàng lục. C. Tím đen. D. Xanh tím.
(Xem giải) Câu 15. Acquy chì là một loại acquy đơn giản, gồm bản cực dương bằng PbO2, bản cực âm bằng Pb, cả hai điện cực được đặt vào dung dịch H2SO4 loãng. Loại acquy này có thể sạc lại nhiều lần. Đây cũng là loại acquy được sử dụng phổ biến trên các dòng xe máy hiện nay với nhiều ưu điểm vượt trội. Tuy nhiên, nhược điểm của acquy chì là
A. hoạt động ổn định.
B. gây ô nhiễm môi trường.
C. có khả năng trữ một lượng điện lớn trong bình acquy.
D. dễ sản xuất, giá thành thấp.
(Xem giải) Câu 16. Kim loại nào sau đây tan hoàn toàn trong nước ở điều kiện thường?
A. Mg. B. Cu. C. Na. D. Al.
(Xem giải) Câu 17. Cho các phát biểu sau:
(a) Hoà tan hết CaCO3 bằng một lượng dư HCl thu được dung dịch X. Cô cạn dung dịch X thu được chất rắn Y. Đốt nóng Y trên ngọn lửa đèn cồn thấy ngọn lửa có màu đỏ cam.
(b) Cho một mẫu nhỏ Ca vào dung dịch Na2CO3. Hiện tượng xảy ra là mẫu Ca tan dần, sủi bọt khí và xuất hiện kết tủa trắng.
(c) Ca, Ba, Sr đều tác dụng được với nước tạo dung dịch làm quỳ tím hóa đỏ.
(d) Một mẫu nước cứng có chứa: 0,01 mol Ca2+; 0,03 mol HCO3- và x mol Mg2+. Nếu đun nóng mẫu nước cứng này thì sẽ loại bỏ được khối lượng cặn là 14,2 gam.
Số phát biểu đúng là
A. 2. B. 4. C. 3. D. 1.
(Xem giải) Câu 18. Điện phân dung dịch CuSO4 với anode bằng đồng (anode tan) và điện phân dung dịch CuSO4 với anode bằng graphite (điện cực trơ) đều có đặc điểm chung là
A. ở cathode xảy ra sự khử: Cu2+ + 2e → Cu.
B. ở anode xảy ra sự khử: 2H2O → 4H+ + O2 + 4e.
C. ở cathode xảy ra sự oxi hóa: 2H2O + 2e → H2 + 2OH−.
D. ở anode xảy ra sự oxi hóa: Cu → Cu2+ + 2e.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. Melamine là hợp chất hữu cơ tan ít trong nước, kết dính tốt được dùng trong chế tạo keo dính, nội thất. Một số cơ sở sản xuất sữa thường thêm melamine vào sản phẩm để tạo hàm lượng đạm giả trong sữa, gây nguy hại đến sức khỏe. Melamine có công thức cấu tạo như sau:

a) Melamine thuộc loại arylamine có tính base.
b) Melamine được sử dụng như một loại keo để sản xuất giấy trang trí phủ melamine (một loại vật liệu quan trọng trong ngành gỗ công nghiệp với ưu điểm màu sắc phong phú, bền màu, chống thấm nước,…).
c) Muốn tăng 1 độ đạm (1 gam nitrogen) cho sữa tươi thì phải thêm vào 1 lít sữa khoảng 1500 mg melamine.
d) Phân tử melamine có công thức đơn giản nhất là CH2N2.
(Xem giải) Câu 20. Trong công nghiệp, nhôm được điều chế bằng cách điện phân nóng chảy hỗn hợp alumina (Al2O3) và cryolite (Na3AlF6) còn gọi là quy trình Hall-Héroul như hình dưới đây:
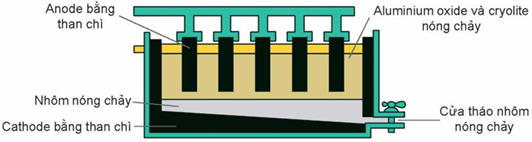
Nhiệt độ nóng chảy của hỗn hợp alumina và cryolite khoảng 950°C, thấp hơn nhiều so với nhiệt độ nóng chảy của alumina (> 2000°C); ngoài ra cryolite còn làm tăng độ dẫn điện của hỗn hợp nóng chảy. Trong quá trình điện phân, cực dương làm bằng graphite bị ăn mòn và liên tục bị nhúng xuống bể điện phân. Sau một thời gian, các thanh graphite này sẽ được thay mới.
a) Nhôm kim loại được tách ra tại cathode.
b) Vì anode và cathode đều làm bằng graphite, nên nếu đổi chiều dòng điện (anode trở thành cathode và ngược lại) thì quy trình điện phân vẫn xảy ra bình thường.
c) Cho biết phương trình nhiệt hóa học: 2Al2O3(s) → 4Al(s) + 3O2(g), ![]() = 1676,00 kJ. Để thu được 1 tấn Al với hiệu suất sử dụng năng lượng đạt 75% thì cần tiêu tốn 5747,6 kWh (1 kWh = 3,6.10^6 J).
= 1676,00 kJ. Để thu được 1 tấn Al với hiệu suất sử dụng năng lượng đạt 75% thì cần tiêu tốn 5747,6 kWh (1 kWh = 3,6.10^6 J).
d) Cryolite được thêm vào bể điện phân giúp tiết kiệm được năng lượng, giảm chi phí sản xuất.
(Xem giải) Câu 21. Các muối carbonate của kim loại nhóm IIA đều bị phân hủy bởi nhiệt: MCO3(s) —> MO(s) + CO2(g) ![]()
Biến thiên enthalpy chuẩn của quá trình trên được cho trong bảng sau:
| Muối | MgCO3(s) | CaCO3(s) | SrCO3(s) | BaCO3(s) |
| |
100,70 | 179,20 | 234,60 | 271,50 |
a) Phản ứng phân hủy muối carbonate của các kim loại nhóm IIA đều là phản ứng toả nhiệt.
b) Vôi sống CaO tác dụng với nước tỏa nhiệt mạnh, tạo thành vôi tôi Ca(OH)2.
c) Năng lượng tối thiểu để sản xuất 1,2 tấn vôi sống theo phương pháp nung đá vôi (có hàm lượng CaCO3 là 72%, còn lại là tạp chất trơ) với than đá là 3480000 kJ.
d) Độ bền với nhiệt: MgCO3 < CaCO3 < SrCO3 < BaCO3.
(Xem giải) Câu 22. Geraniol là một alcohol không no có trong tinh dầu hoa hồng, tinh dầu sả và nhiều loại tinh dầu thảo mộc khác. Từ geraniol có thể điều chế được geranyl acetate theo sơ đồ phản ứng sau:
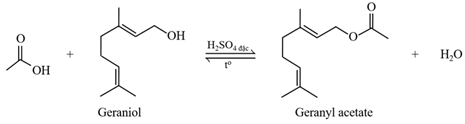
a) Oxi hóa geraniol bằng CuO, đun nóng thu được một aldehyde Y. Với 15,2 gam Y có thể tác dụng tối đa 7,437 lít H2 (đkc).
b) Mỗi một chai nước hoa cỡ nhỏ (size S) với kích cỡ 50,0 mL có chứa 80% về thể tích geranyl acetate. Biết khối lượng riêng của geranyl acetate là 0,916 g/mL. Để điều chế 3 triệu chai nước hoa size S cần 56,08 tấn acetic acid (hiệu suất phản ứng là 60%).
c) Geraniol có công thức phân tử là C10H16O.
d) Geranyl acetate là ester thơm, đơn chức.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Trong phòng thí nghiệm, KOH để lâu ngày bị chuyển hoá một phần thành K2CO3, làm khô thu được mẫu X. Đem cân lấy 1,3792 gam mẫu X và hòa tan hoàn toàn trong 100 mL dung dịch HCl 0,5M đun nóng để đuổi hết CO2 đi, thu được 100 mL dung dịch Y. Chuẩn độ 10 mL dung dịch Y với chỉ thị phenolphtalein đến khi xuất hiện màu hồng nhạt thì hết 26,3 mL dung dịch NaOH 0,1M. Tính hàm lượng phần trăm (%) K2CO3 trong mẫu X (kết quả làm tròn đến phần nguyên).
(Xem giải) Câu 24. Xà phòng hóa hoàn toàn triglyceride X trong dung dịch NaOH dư, thu được glycerol, sodium linoleate, sodium stearate và sodium palmitate. Phân tử khối của X bằng bao nhiêu amu?
(Xem giải) Câu 25. Độ tan của natri hiđrocacbonat (NaHCO3) ở 20°C là 9,6 gam trên 100 gam nước. Sục khí CO2 dư vào 100 kg dung dịch NaOH 20% ở 20°C. Sau khi phản ứng xảy ra hoàn toàn, thu được bao nhiêu kilogam NaHCO3 kết tinh? (Bỏ qua lượng CO2 hòa tan trong nước, kết quả làm tròn đến phần trăm).
(Xem giải) Câu 26. Máy tạo oxygen y tế sử dụng phương pháp điện phân nước (trong môi trường acid) để cung cấp oxygen. Quá trình điện phân nước được biểu diễn bằng các bán phản ứng như sau:
(-) Cathode 2H+ + 2e → H2
(+) Anode 2H2O → O2 + 4H+ + 4e
Biết chỉ thêm đúng dịch nước (trong môi trường acid) vào máy ban đầu, trong quá trình hoạt động không bổ sung thêm nước. Biết một máy tạo được 1 lít oxygen (đkc) mỗi phút; máy hoạt động 30 lần mỗi ngày với mỗi lần 15 phút. Nước sử dụng có khối lượng riêng là 1 g/mL. Cứ trung bình 10 lần hoạt động, lượng nước trong máy chỉ còn 20% so với ban đầu, nên cần đổ thêm nước đầy về mức ban đầu. Giả thiết hiệu suất điện phân nước là 100% thì tổng lượng nước cần sử dụng để vận hành máy tạo oxygen trong một ngày là bao nhiêu mL (làm tròn đến hàng đơn vị).
(Xem giải) Câu 27. Sắt là kim loại chuyển tiếp dãy thứ nhất, có khả năng tạo phức chất phong phú và có nhiều ứng dụng thực tiễn: [Fe(H2O)6]SO4; K4[Fe(CN)6]; [Fe(CO)5]; [Fe(H2O)6]Cl3. Có bao nhiêu phức chất trong đó nguyên tử trung tâm là Fe2+?
(Xem giải) Câu 28. Glucose trong cơ thể được hình thành từ quá trình thủy phân tinh bột dưới tác dụng của enzyme. Trong quá trình hô hấp tế bào, cứ 1 mol glucose bị oxi hóa hoàn toàn thông qua các phản ứng sinh hóa tạo thành carbon dioxide, nước và giải phóng năng lượng là 2803 kJ. Trong khẩu phần ăn hằng ngày của một người trưởng thành có 300 gam gạo. Hàm lượng tinh bột trong gạo là 80%. Giả sử 60% lượng tinh bột trong gạo chuyển hoá thành glucose và toàn bộ lượng glucose này tham gia vào quá trình hô hấp tế bào. Năng lượng giải phóng từ sự oxi hoá hoàn toàn glucose chiếm x % so với nhu cầu năng lượng trung bình (2500 kCal/ngày) của một người trưởng thành. Tính giá trị của x (kết quả làm tròn đến hàng phần mười). Cho biết: 1 Calo = 4,18 J.

Bình luận