[H10A.C4B13] Phản ứng oxi hóa – khử
I. CÂU HỎI THẢO LUẬN TRONG BÀI HỌC:
(Xem giải) 1. Quá trình bị gỉ của đinh ốc ngoài không khí được mô tả như hình dưới đây:
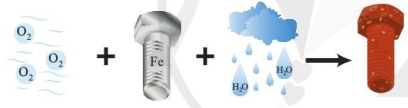
Trong quá trình này hãy cho biết nguyên tử nguyên tố nào nhường electron, nguyên tử nguyên tố nào nhận electron. Giải thích.
(Xem giải) 2. Xác định số oxi hóa của mỗi nguyên tử nguyên tố trong các hợp chất ion Al2O3, CaF2.
(Xem giải) 3. Xác định số oxi hóa của mỗi nguyên tử trong hợp chất sau: NO, CH4.
(Xem giải) 4. Dựa theo quy tắc octet, giải thích vì sao số oxi hóa của O là -2, của kim loại nhóm IA là +1, của kim loại nhóm IIA là +2 và của Al là +3.
(Xem giải) 5. Xác định số oxi hóa của mỗi nguyên tử trong các hợp chất: Fe2O3, Na2CO3, KAl(SO4)2.
(Xem giải) 6. Xác định số oxi hóa của mỗi nguyên tử trong các ion NO3–, NH4+, MnO4–.
(Xem giải) 7. Xác định số oxi hóa của mỗi nguyên tử trong NH3 theo cách 2.
(Xem giải) 8. Dựa vào độ âm điện, giải thích vì sao công thức ion giả định của OF2 là F–O2+F– mà không phải là F+O2-F+.
(Xem giải) 9. Xác định số oxi hóa của các nguyên tử trong phản ứng (1), (2). Cho biết nguyên tố nào có sự thay đổi số oxi hóa.
(1) 2Ag + Cl2 → 2AgCl
(2) 2AgNO3 + BaCl2 → 2AgCl + Ba(NO3)2
(Xem giải) 10. Nguyên tố Cl thể hiện bao nhiêu số oxi hóa trong phản ứng (3)?
(3) Cl2 + 2NaOH → NaOCl + NaCl + H2O
(Xem giải) 11. Trong phản ứng ở ví dụ 1, hãy chỉ ra chất khử, chất oxi hóa, quá trình khử, quá trình oxi hóa.
Al + O2 → Al2O3
(Xem giải) 12. Cân bằng các phản ứng oxi hóa – khử sau. Chỉ ra chất oxi hóa, chất khử, sự oxi hóa, sự khử.
a) Fe2O3 + CO → Fe + CO2
b) NH3 + O2 → NO + H2O
(Xem giải) 13. Các phản ứng dưới thường gặp trong đời sống và trong sản xuất. Những phản ứng này thường diễn ra trong quá trình nào?
a) Fe2O3 + CO → Fe + CO2
b) NH3 + O2 → NO + H2O
(Xem giải) 14. Cân bằng các phản ứng oxi hóa – khử sau:
a) HCl + PbO2 → PbCl2 + Cl2 + H2O
b) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
(Xem giải) 15. Sắt bị gỉ trong không khí ẩm. Đó có phải là phản ứng oxi hóa – khử không? Đề xuất một vài biện pháp hạn chế sự tạo gỉ kim loại nêu trên.
(Xem giải) 16. Hãy viết các quá trình thay đổi số oxi hóa của mỗi nguyên tử nguyên tố trong phản ứng oxi hóa hoàn toàn methane (thành phần chính của khí thiên nhiên).
II. BÀI TẬP TRONG SÁCH GIÁO KHOA:
(Xem giải) Bài 1. Xác định số oxi hóa của mỗi nguyên tử trong phân tử và ion sau đây:
a) H2SO3 b) Al(OH)4– c) NaAlH4 d) NO2–
(Xem giải) Bài 2. Xác định chất oxi hóa, chất khử, viết quá trình oxi hóa, quá trình khử trong các phản ứng sau:
a) Ag+ + Fe2+ → Ag + Fe3+
b) 3Hg2+ + 2Fe → 3Hg + 2Fe3+
c) 2As + 3Cl2 → 2AsCl3
d*) Al + 6H+ + 3NO3– → Al3+ + 3NO2 + 3H2O
(Xem giải) Bài 3. Cân bằng các phản ứng oxi hóa – khử sau đây bằng phương pháp thăng bằng electron:
a) NaBr + Cl2 → NaCl + Br2
b) Fe2O3 + CO → Fe + CO2
c) CO + I2O5 → CO2 + I2
d) Cr(OH)3 + Br2 + OH– → CrO42- + Br– + H2O
e) H+ + MnO4– + HCOOH → Mn2+ + H2O + CO2
(Xem giải) Bài 4. Nước oxi già có tính oxi hóa mạnh, do khả năng oxi hóa của hydrogen peroxide (H2O2).
a) Từ công thức cấu tạo H – O – O – H, hãy xác định số oxi hóa của mỗi nguyên tử.
b) Nguyên tử nguyên tố nào gây nên tính oxi hóa của H2O2. Viết quá trình khử minh họa cho nguyên tử nguyên tố đó.
(Xem giải) Bài 5. Xăng E5 được tạo nên bởi sự pha trộn xăng A92 và ethanol (C2H5OH) theo tỉ lệ thể tích tương ứng là 95 : 5, giúp thay thế một phần nhiên liệu hóa thạch, phù hợp với xu thế phát triển chung trên thế giới và góp phần đảm bảo an ninh năng lượng quốc gia.
Viết phương trình của phản ứng hóa học đốt cháy ethanol thành CO2 và H2O. Phản ứng này có phải là phản ứng oxi hóa – khử hay không? Nó thuộc loại phản ứng cung cấp hay tích trữ năng lượng.
III. BÀI TẬP TRONG SÁCH BÀI TẬP:
(Xem giải) 13.1. Phát biểu nào sau đây là đúng?
A. Số oxi hoá của nguyên tử trong bất kì một đơn chất hoá học nào đều bằng 0.
B. Tổng số oxi hoá của tất cả các nguyên tử trong một phân tử và trong một ion đa nguyên tử bằng 0.
C. Trong tất cả các hợp chất, hydrogen luôn có số oxi hoá là +1.
D. Trong tất cả các hợp chất, oxygen luôn có số oxi hoá là -2.
(Xem giải) 13.2. Phát biểu nào sau đây không đúng?
A. Số oxi hoá của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử đó với giả thiết đó là hợp chất ion.
B. Trong hợp chất, oxygen có số oxi hoá bằng -2, trừ một số trường hợp ngoại lệ.
C. Số oxi hoá của hydrogen trong các hydride kim loại bằng +1.
D. Các nguyên tố phi kim có số oxi hoá thay đổi tuỳ thuộc vào hợp chất chứa chúng.
(Xem giải) 13.3. Số oxi hoá của chromium (Cr) trong Na2CrO4 là
A. -2. B. +2. C. +6. D. -6.
(Xem giải) 13.4. Số oxi hoá của carbon và oxygen trong C2O42- lần lượt là:
A. +3, -2. B. +4, -2. C. +1, -3. D. +3, -6.
(Xem giải) 13.5. Số oxi hoá của Cl trong các chất NaOCl, NaClO2, NaClO3, NaClO4 lần lượt là:
A. -1, +3, +5, +7. B. +1, -3, +5, -2.
C. +1, +3, +5, +7. D. +1, +3, -5, +7.
(Xem giải) 13.6. a) Xác định số oxi hoá của mỗi nguyên tử trong các chất hoá học hoặc các ion sau: NO3–; H2PO4–; CaHAsO4; Mg2TiO4.
b) Ghép phân tử/ ion ở cột A với nhóm số oxi hoá của các nguyên tử trong phân tử/ ion ở cột B cho phù hợp.
| Cột A: Phân tử, ion | Cột B: Số oxi hóa của các nguyên tử trong phân tử, ion (theo thứ tự như trong phân tử, ion) |
| a) SbCl5
b) BrO3- c) Na2O2 d) Na2S e) NH4+ |
1. (-3, +1)
2. (+5, -1) 3. (+1, -2) 4. (+1, -1) 5. (+5, -2) 6. (-1, +2) |
(Xem giải) 13.7. Dựa vào công thức cấu tạo, hãy xác định số oxi hóa của mỗi nguyên tố trong các hợp chất sau:
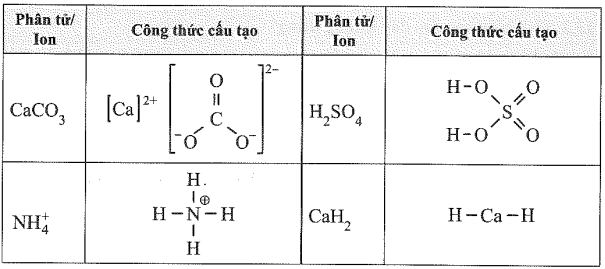
(Xem giải) 13.8. Magnetite là một loại sắt oxide có công thức Fe3O4 (còn gọi là oxit sắt từ). Chất này được coi là hỗn hợp của hai oxide. Tìm hiểu và xác định số oxi hóa của từng nguyên tử Fe trong magnetite.
(Xem giải) 13.9. Những phát biểu nào sau đây đúng?
A. Sự oxi hoá là sự nhường electron hay sự làm tăng số oxi hoá.
B. Trong quá trình oxi hoá, chất khử nhận electron.
C. Sự khử là sự nhận electron hay là sự làm giảm số oxi hoá.
D. Trong quá trình khử, chất oxi hoá nhường electron.
E. Trong quá trình khử, chất oxi hoá nhận electron và bị khử xuống số oxi hoá thấp hơn.
G. Trong quá trình oxi hoá, chất khử nhường electron và bị oxi hoá lên số oxi hoá cao hơn.
(Xem giải) 13.10. Những phát biểu nào sau đây không đúng?
A. Chất khử (chất bị oxi hoá) là chất nhường electron và chất oxi hoá (chất bị khử) là chất nhận electron.
B. Quá trình nhường electron là quá trình khử và quá trình nhận electron là quá trình oxi hoá.
C. Trong quá trình oxi hoá, chất oxi hoá bị oxi hoá lên số oxi hoá cao hơn.
D. Trong quá trình khử, chất khử bị khử xuống số oxi hoá thấp hơn.
E. Phản ứng trong đó có sự trao đổi electron là phản ứng oxi hoá – khử.
G. Trong phản ứng oxi hoá – khử, sự oxi hoá và sự khử luôn xảy ra đồng thời.
(Xem giải) 13.11. Điền vào chỗ trống trong đoạn thông tin sau: Phản ứng Fe2O3 + CO → Fe + CO2 xảy ra trong quá trình luyện gang từ quặng hemantite là phản ứng …. (1) … vì có sự thay đổi … (2) … của các nguyên tố Fe và C. CO là … (3)…, trong đó … (4) … electron và Fe2O3 là … (5)…, trong đó mỗi … (6)… electron.
(Xem giải) 13.12. Trong công nghiệp, sulfuric acid được sản xuất từ quặng pirite sắt có thành phần chính là FeS2, theo sơ đồ sau: FeS2 → SO2 → SO3 → H2SO4
a) Hoàn thành sơ đồ trên bằng các phương trình hoá học, cân bằng các phương trình hoá học đó. Trong sơ đồ trên, những phản ứng nào là phản ứng oxi hoá – khử? Chỉ rõ chất khử và chất oxi hoá của mỗi phản ứng đó.
b) Tính khối lượng H2SO4 98% điều chế được từ 1 tấn quặng chứa 60% FeS2. Biết hiệu suất cả quá trình là 80%.
c) Đề xuất một công thức cấu tạo phù hợp cho FeS2, biết S có số oxi hoá -1 trong chất này.
(Xem giải) 13.13. Trong những phản ứng hoá học xảy ra theo các phương trình dưới đây, những phản ứng nào là phản ứng oxi hoá – khử?
(1) PCl3 + Cl2 → PCl5
(2) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
(3) CO2 + 2LiOH → Li2CO3 + H2O
(4) FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
Chọn phương án đúng.
A. (3). B. (4). C. (1) và (2). D. (1), (2) và (3).
Với phương án đã chọn, chỉ ra chất khử, chất oxi hóa và viết các quá trình oxi hóa và quá trình khử tương ứng.
(Xem giải) 13.14. Hãy xác định chất bị khử, chất bị oxi hóa trong các phản ứng hóa học dưới đây.
a) 2HNO3 + 3H3AsO3 → 2NO + 3H3AsO4 + H2O
b) NaI + 3HOCl → NaIO3 + 3HCl
c) 2KMnO4 + 5H2C2O4 + 3H2SO4 → 10CO2 + K2SO4 + 2MnSO4 + 8H2O
d) 6H2SO4 + 2Al → Al2(SO4)3 + 3SO2 + 6H2O
(Xem giải) 13.15. Viết các phản ứng cho quá trình oxi hóa, quá trình khử và cân bằng các phản ứng sau:
a) Ag+ + Fe2+ → Ag + Fe3+
b) Cr3+ + Zn → Cr + Zn2+
c) CH4 + O2 → CO2 + H2O
d) MnO2 + Al → Mn + Al2O3
(Xem giải) 13.16. Một số loại xe ô tô được trang bị một thiết bị an toàn là túi chứa một lượng nhất định hợp chất ion sodium azide (NaN3), được gọi là “túi khí”. Khi có va chạm mạnh xảy ra, sodium azide bị phân huỷ rất nhanh, giải phóng khí N2 và nguyên tố Na, làm túi phồng lên, bảo vệ được người trong xe tránh khỏi thương tích. Viết phương trình hoá học của phản ứng xảy ra và xác định đây có phải là phản ứng oxi hoá – khử không. Vì sao? Xác định số oxi hoá của mỗi nguyên tử trong NaN3.
(Xem giải) 13.17. Sự cháy của hydrocarbon trong oxygen:
Quá trình đốt cháy nhiên liệu (khí đốt, xăng, dầu hoặc khí hoá lỏng) là một ví dụ về sự cháy của hydrocarbon trong oxygen và cung cấp cho chúng ta năng lượng. Nếu oxygen dư thì sự cháy xảy ra hoàn toàn và cho sản phẩm là CO2 và nước. Nếu thiếu oxygen, sự cháy xảy ra không hoàn toàn và một phần carbon chuyển thành CO là một khí độc, gây ô nhiễm môi trường. Còn khi rất thiếu oxygen thì chỉ tạo ra nước và để lại muội là carbon. Hãy viết các phương trình hoá học cho phản ứng cháy của xăng (octane – C8H18) trong ba điều kiện: dư oxygen, không dư oxygen và rất thiếu oxygen. Theo em, điều kiện nào sẽ tiết kiệm năng lượng nhất? Vì sao? Trong điều kiện đó, một phân tử C8H18 sẽ nhường bao nhiêu electron?

Bình luận