[H10C.C1B03] Cấu trúc lớp vỏ electron của nguyên tử
I. CÂU HỎI THẢO LUẬN TRONG BÀI HỌC:
(Xem giải) 1. Mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử như thế nào?
(Xem giải) 2. Orbital s có dạng
A. hình tròn. B. hình số tám nổi.
C. hình cầu. D. hình bầu dục.
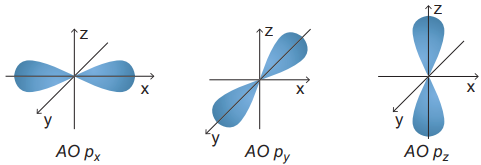
(Xem giải) 3. Quan sát hình dưới và nêu sự định hướng của các AO p trong không gian.
(Xem giải) 4. Hãy cho biết tổng số electron tối đa chứa trong:
a) Phân lớp p.
b) Phân lớp d.
(Xem giải) 5. Lớp electron có số electron tối đa gọi là lớp electron bão hòa. Tổng số electron tối đa có trong các lớp L và M là
A. 2 và 8. B. 8 và 10. C. 8 và 18 D. 18 và 32.
(Xem giải) 6. Cấu hình electron của nguyên tử có Z = 16 là
A. 1s22s22p63s23p3. B. 1s22s22p63s23p5.
C. 1s22s22p63s23p4. D. 1s22s22p63s23p6.
(Xem giải) 7. Biểu diễn cấu hình electron của các nguyên tử có Z = 8 và Z = 11 theo ô orbital.
(Xem giải) 8. Silicon được sử dụng trong nhiều ngành công nghiệp: gốm, men sứ, thủy tinh, luyện thép, vật liệu bán dẫn, … Hãy biểu diễn cấu hình electron của nguyên tử silicon (Z = 14) theo ô orbital, chỉ rõ việc áp dụng các nguyên lí vững bền, nguyên lí Pauli và quy tắc Hund.
(Xem giải) 9. Chlorine (Z = 17) thường được sử dụng để khử trùng nước máy trong sinh hoạt. Viết cấu hình electron của nguyên tử chlorine và cho biết tại sao chlorine là phi kim.
(Xem giải) 10. Nguyên tố calcium giúp cho xương chắc, khỏe. Cấu hình electron lớp ngoài cùng của nguyên tử calcium là 4s2. Hãy viết cấu hình electron đầy đủ của nguyên tử calcium và cho biết nguyên tố calcium là kim loại, phi kim hay khí hiếm.
II. BÀI TẬP TRONG SÁCH BÀI TẬP:
(Xem giải) 3.1. Orbital nguyên tử là
A. Đám mây chứa electron dạng hình cầu.
B. Đám mây chứa electron có dạng hình số 8 nổi.
C. Khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
D. Quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước và năng lượng xác định.
(Xem giải) 3.2. Sự phân bố electron trong một orbital dựa vào nguyên lí hay quy tắc nào sau đây?
A. Nguyên lí vững bền. B. Quy tắc Hund
C. Nguyên lí Pauli D. Quy tắc Pauli
(Xem giải) 3.3. Sự phân bố electron trên các phân lớp thuộc các lớp electron dựa vào nguyên lí hay quy tắc nào sau đây?
A. Nguyên lí vững bền và nguyên lí Pauli.
B. Nguyên lí vững bền và quy tắc Hund.
C. Nguyên lí Pauli và quy tắc Hund.
D. Nguyên lí vững bền và quy tắc Pauli
(Xem giải) 3.4. Sự phân bố electron vào các lớp và phân lớp căn cứ vào
A. nguyên tử khối tăng dần. B. điện tích hạt nhân tăng dần.
C. số khối tăng dần. D. mức năng lượng electron.
(Xem giải) 3.5. Ở trạng thái cơ bản, trong nguyên tử, electron chiếm các mức năng lượng
A. lần lượt từ cao đến thấp. B. lần lượt từ thấp đến cao.
C. bất kì. D. từ mức thứ hai trở đi.
(Xem giải) 3.6. Các lớp electron được đánh số từ trong ra ngoài bằng các số nguyên dương: n = 1, 2, 3, … với tên gọi là các chữ cái in hoa là
A. K, L, M, O, … B. L, M, N, O, …
C. K, L, M, N, … D. K, M, N, O, …
(Xem giải) 3.7. Các phân lớp trong mỗi lớp electron được kí hiệu bằng các chữ cái viết thường theo thứ tự là
A. s, d, p, f, … B. s, p, d, f, .. C. s, p, f, d, … D. f, d, p, s, …
(Xem giải) 3.8. Phát biểu nào sau đây đúng?
A. Những electron ở lớp K có mức năng lượng thấp nhất.
B. Những electron ở gần hạt nhân có mức năng lượng cao nhất.
C. Electron ở orbital 3p có mức năng lượng thấp hơn electron ở orbital 3s.
D. Các electron trong cùng một lớp có năng lượng bằng nhau.
(Xem giải) 3.9. Mỗi orbital nguyên tử chứa tối đa
A. 1 electron B. 2 electron C. 3 electron D. 4 electron
(Xem giải) 3.10. Số orbital trong các phân lớp s, p, d lần lượt bằng
A. 1, 3, 5. B. 1, 2, 4. C. 3, 5, 7. D. 1, 2, 3.
(Xem giải) 3.11. Phân lớp 3d có số electron tối đa là
A. 6 B. 18 C. 14 D. 10
(Xem giải) 3.12. Lớp L có số phân lớp electron bằng
A. 1 B. 2 C. 3 D. 4
(Xem giải) 3.13. Lớp M có số orbital tối đa bằng
A. 3 B. 4 C. 9 D. 18
(Xem giải) 3.14. Lớp M có số electron tối đa bằng
A. 3 B. 4 C. 9 D. 18
(Xem giải) 3.15. Các electron của nguyên tử nguyên tố X được phân bố trên ba lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là
A. 6 B. 8 C. 14 D. 16
(Xem giải) 3.16. Nguyên tố X có Z = 17. Electron lớp ngoài cùng của nguyên tử nguyên tố X thuộc lớp
A. K B. L C. M D. N
(Xem giải) 3.17. Cách biểu diễn electron trong AO nào sau đây không tuân theo nguyên lí Pauli?
A. ↑. B. ↓. C. ↑↓. D. ↑↑.
(Xem giải) 3.18. Sự phân bố electron theo ô orbital nào dưới đây là đúng?
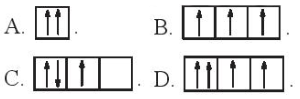
(Xem giải) 3.19. Dùng ô orbital để mô tả cách sắp xếp electron trong orbital s.
(Xem giải) 3.20. Trường hợp trong orbital p có chứa hai electron thì có những cách nào biểu diễn electron trong orbital đó? Cách nào tuân theo quy tắc Hund?
(Xem giải) 3.21. Nêu mối quan hệ về năng lượng của electron trên các orbital, các phân lớp, các lớp electron.
(Xem giải) 3.22. Cho biết tổng số electron tối đa chứa trong:
a) Phân lớp p; b) Phân lớp d; c) Lớp K; d) Lớp M.
(Xem giải) 3.23. Nguyên tố X có Z = 12 và nguyên tố Y có Z = 17. Viết cấu hình electron nguyên tử của nguyên tố X và Y. Khi nguyên tử của nguyên tố X nhường đi hai electron và nguyên tử của nguyên tố Y nhận thêm một electron thì lớp electron ngoài cùng của chúng có đặc điểm gì?
(Xem giải) 3.24. Viết cấu hình electron theo ô orbital của nguyên tử các nguyên tố có Z = 9, Z = 14 và Z = 21. Chúng là nguyên tố kim loại, phi kim hay khí hiếm?
(Xem giải) 3.25. Hợp chất A có công thức M4X3. Tổng số hạt proton, electron và neutron trong phân tử A là 214. Tổng số hạt proton, neutron, electron của [M]4 nhiều hơn so với [X]3 trong A là 106.
a) Xác định công thức hóa học của A.
b) Viết cấu hình electron của các nguyên tử tạo nên A.

Bình luận