[2022 – 2023] Thi học sinh giỏi lớp 11 – Hà Nội
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Thời gian làm bài: 120 phút
⇒ Đề thi, đáp án và giải chi tiết:
Câu I (4,0 điểm)
1. Viết phương trình hóa học của phản ứng xảy ra (nếu có) dưới dạng phân tử và ion thu gọn khi trộn lẫn các dung dịch sau:
(Xem giải) a) NaHSO3 và HCl.
(Xem giải) b) AgNO3 và Na3PO4.
(Xem giải) c) Ca(H2PO4)2 và NaOH (tỉ lệ mol 1 : 2).
(Xem giải) d) Ba(HCO3)2 và KHSO4 (tỉ lệ mol 1 : 1).
(Xem giải) 2. Cho hỗn hợp các khí CO2, C2H2, CH4. Lập sơ đồ, viết các phương trình hóa học tách riêng từng chất ra khỏi hỗn hợp sao cho không làm thay đổi khối lượng mỗi khí sau quá trình tách. Các điều kiện và dụng cụ cần thiết có đủ.
Câu II (4,0 điểm)
1. Giải thích vì sao:
(Xem giải) a) Nồng độ CO2 hòa tan trong nước tăng không có lợi cho sự hình thành các nhũ đá.
(Xem giải) b) Ở các cây xăng, kho chứa xăng dầu thường treo các biển “cấm lửa”, “cấm hút thuốc”.
(Xem giải) 2. Xác định các chất X1, X2, X3, X4, X5, X6, X7, X8, X9 và viết các phương trình hóa học thực hiện sơ đồ chuyển hóa. Cho biết: có 2 chất thuộc loại polime; phân tử các chất X1, X2, X4, X6, X8 có cùng số nguyên tử cacbon và MX5 = 3MX4
X1 → X2 → X3 (1500°C, làm lạnh nhanh) → X4 → X5
X7 ← X6 ← X4 → X8 → X9
Câu III (4,0 điểm)
(Xem giải) 1. Hình vẽ bên mô tả cách điều chế axit X trong phòng thí nghiệm:
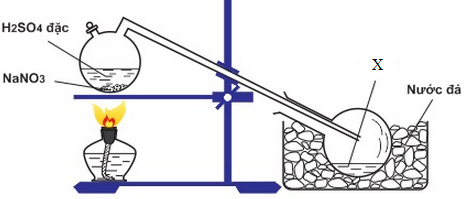
a) X là chất nào? Viết phương trình hóa học.
b) Vì sao phải sử dụng NaNO3 rắn, H2SO4 đặc và đun nóng hỗn hợp phản ứng?
c) Nêu vai trò của nước đá.
d) Bằng phản ứng tương tự giữa H2SO4 đặc với muối halogenua rắn, có thể điều chế được HBr, HCI không? Vì sao?
(Xem giải) 2. Cho hỗn hợp Al4C3 và CaC2 tác dụng với nước dư thu được 16,8 lít (đktc) hỗn hợp khí X. Chia X thành 2 phần: phần 1 tác dụng với lượng dư dung dịch AgNO3/NH3 thu được 36 gam kết tủa; đốt cháy hoàn toàn phần 2 rồi cho toàn bộ sản phẩm cháy hấp thụ hết vào bình đựng dung dịch Ca(OH)2 dư, sau phản ứng lọc bỏ kết tủa thấy khối lượng dung dịch giảm 32,2 gam so với khối lượng dung dịch Ca(OH)2 ban đầu.
a) Viết các phương trình hóa học của các phản ứng xảy ra.
b) Xác định % thể tích các khí trong X.
c) Nếu thêm 0,7 mol H2 vào phần 2 được hỗn hợp khí Y. Dẫn Y qua bột Ni đun nóng thu được hỗn hợp khí Z. Z phản ứng tối đa với dung dịch chứa a mol Br2. Tính giá trị của a biết tỉ khối của Z so với H2 là 6,2.
Câu IV (4,0 điểm)
(Xem giải) 1. Cho các hiđrocacbon mạch hở X, Y. Phân tử X có 11 liên kết σ và 1 liên kết π, phân tử Y chỉ có 16 liên kết σ.
a) Xác định công thức phân tử, viết các đồng phân của X, Y và gọi tên.
b) Y phản ứng với Cl2 trong điều kiện thích hợp chỉ tạo ra 1 dẫn xuất monoclo. Tìm công thức cấu tạo đúng của Y.
(Xem giải) 2. Nhỏ từ từ từng giọt dung dịch Ba(OH)2 vào dung dịch chứa hỗn hợp a mol H2SO4 và b mol Al2(SO4)3. Sự phụ thuộc của khối lượng kết tủa thu được vào số mol Ba(OH)2 phản ứng được thể hiện trong bảng sau:
| Số mol Ba(OH)2 (mol) | 0,06 | 0,134 | 0,155 |
| Khối lượng kết tủa (gam) | 13,98 | 34,03 | 33,4 |
Lập luận tính giá trị của a và b.
Câu V (4,0 điểm)
(Xem giải) 1. Chuẩn độ axit – bazơ là kĩ thuật phân tích cho phép xác định nồng độ của dung dịch axit hoặc dung dịch bazơ dựa trên phản ứng trung hòa giữa dung dịch chuẩn (đã biết nồng độ) với một thể tích xác định của dung dịch cần chuẩn độ. Điểm tương đương của chuẩn độ là điểm mà dung dịch chuẩn phản ứng vừa hết với dung dịch cần chuẩn độ. Trong chuẩn độ axit – bazơ, điểm này thường được đánh dấu bằng các chất chỉ thị có khoảng pH đổi màu trùng hoặc rất sát với pH tại điểm tương đương; điểm mà chất chỉ thị thực sự thay đổi màu sắc được gọi là điểm cuối.
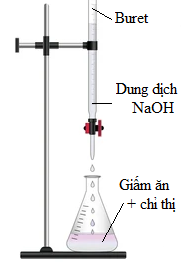
Để xác định lại nồng độ của axit CH3COOH trong mẫu giấm ăn (có nồng độ khoảng 4%; khối lượng riêng D = 1,050 g.ml-1) người ta pha loãng 10,00 ml giấm ăn trên bằng nước cất được 100,00 ml dung dịch X rồi chuẩn độ 10,00 ml dung dịch X bằng dung dịch NaOH chuẩn với chỉ thị thích hợp. Việc chuẩn độ được lặp lại 3 lần.
a) Viết phương trình của phản ứng chuẩn độ (dạng phân tử và ion thu gọn).
b) Vì sao phải thực hiện chuẩn độ nhiều lần?
c) Trong phòng thí nghiệm có các dung dịch NaOH chuẩn với nồng độ như sau: NaOH 1,00M; NaOH 0,05M; NaOH 0,02M. Để thực hiện phép chuẩn độ, sử dụng dung dịch NaOH chuẩn nào là hợp lí nhất? Vì sao? Cho biết buret sử dụng để đựng chất chuẩn trong thí nghiệm này là loại có dung tích 25 ml.
d) Kết quả chuẩn độ 10 ml dung dịch X khi sử dụng dung dịch chuẩn NaOH 0,05M như sau:
| Lần 1 | Lần 2 | Lần 3 | |
| VddNaOH (ml) | 15,0 | 15,1 | 14,9 |
Tính nồng độ phần trăm của CH3COOH trong mẫu giấm ăn trên. Chấp nhận các thành phần khác trong mẫu không ảnh hưởng đến kết quả chuẩn độ.
e) Có thể dùng chất chỉ thị nào trong số các chỉ thị được cho trong bảng sau trong phép chuẩn độ trên? Giải thích ngắn gọn (không cần tính toán). Nêu sự đổi màu của dung dịch tại điểm cuối chuẩn độ tương ứng khi sử dụng chỉ thị đó.
| Chỉ thị | pH đổi màu | Màu dạng axit | Màu dạng bazơ |
| Metyl da cam | 4,4 | Đỏ | Vàng |
| Phenolphtalein | 9,0 | Không màu | Hồng |
(Xem giải) 2. Hòa tan hết 9,6 gam kim loại X trong 60 gam dung dịch HNO3 52,5% đun nóng thu được dung dịch Y chỉ chứa một muối. Chia Y thành 2 phần bằng nhau: Phần 1 cho tác dụng với 200 ml dung dịch NaOH 1M, lọc bỏ kết tủa rồi cô cạn dung dịch thu được chất rắn Z. Nung Z tới khối lượng không đổi thu được 12,35 gam chất rắn. Biết hiđroxit của X không tan trong dung dịch kiềm.
a) Tìm X và tính nồng độ % của chất tan trong dung dịch Y.
b) Làm lạnh phần 2 xuống nhiệt độ T thấy tách ra 3,63 gam tinh thể T và dung dịch còn lại có nồng độ 41,82%. Tìm công thức của T.

Bình luận