[2022 – 2023] Thi học sinh giỏi lớp 10 – Hà Nội
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Thời gian làm bài: 180 phút
⇒ Đề thi, đáp án và giải chi tiết:
Câu I (4,0 điểm)
(Xem giải) 1. Hình vẽ bên mô tả thí nghiệm khám phá tia âm cực của Thomson. Nhờ vào kết quả thí nghiệm, ông đã tìm ra một trong các loại hạt cấu tạo nên nguyên tử.
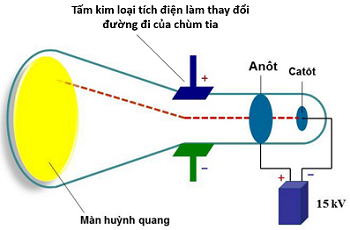
a) Thí nghiệm trên tìm ra loại hạt nào?
b) Nêu vai trò của màn huỳnh quang trong thí nghiệm.
c) Tia âm cực có đặc điểm:
– Bị lệch về cực dương khi đặt ống thủy tinh trong một điện trường.
– Nếu đặt một chong chóng nhẹ trên đường đi của tia âm cực thì chong chóng sẽ quay.
Từ các hiện tượng đó, hãy nêu kết luận về tính chất của tia âm cực.
(Xem giải) 2. Trong tự nhiên, halogen X có hai đồng vị A và B.
a) X tạo được các acid có công thức phân tử là HXOn (với n = 0; 1; 2; 3 và 4). Viết công thức Lewis và công thức cấu tạo các acid của X khi n = 0; 1; 2.
b) Có bao nhiêu loại công thức cấu tạo khác nhau ứng với phân tử acid HXO2? Biết: H có 3 đồng vị ![]() ,
, ![]() ,
, ![]() và O có 3 đồng vị
và O có 3 đồng vị ![]() ,
, ![]() ,
, ![]() .
.
c) Tính số khối của mỗi đồng vị A, B. Biết rằng tổng số hạt cơ bản trong hạt nhân của một nguyên tử A và một nguyên tử B là 72 và nguyên tử A có ít hơn 2 hạt so với nguyên tử B.
d) Trong acid HXO3, B chiếm 10,61% về khối lượng. Tính nguyên từ khối trung bình của X (lấy chính xác đến 2 chữ số thập phân). Cho: H = 1;O = 16.
(Xem giải) Câu II (3,0 điểm)
Bốn nguyên tố M, R, X, Y đều thuộc chu kì nhỏ. M và R thuộc hai nhóm kế tiếp, X và Y cũng thuộc hai nhóm kế tiếp. Tổng số hạt proton trong hạt nhân hai nguyên tử M, R bằng tổng số hạt electron ở lớp vỏ hai nguyên tử X, Y và đều bằng 23. Số electron độc thân của nguyên tử các nguyên tố tăng dần theo thứ tự M, R, X, Y. Biết dạng đơn chất của X và Y không phản ứng trực tiếp với nhau.
1. Tim M, R, X, Y.
2. Viết công thức oxide cao nhất của M, R, X. So sánh tính acid của các oxide đó và giải thích.
3. Biểu diễn quá trình tạo thành các ion đơn nguyên tử của M, R, Y. So sánh bán kinh của các ion đó và giải thích.
(Xem giải) Câu III (3,0 điểm)
Cho bảng số liệu sau:
| Hydrogen halide | HF | HCl | HBr | HI |
| Nhiệt độ sôi (°C) | 19,5 | -84,9 | -66,7 | -35,8 |
| Khối lượng mol phân tử (gam.mol-1) | 20 | 36,5 | 81 | 128 |
| Năng lượng liên kết H-X (kJ.mol-1) | 565 | 431 | 364 | 297 |
1. Nhận xét và giải thích chiều hướng biến đổi năng lượng liên kết từ HF đến HI. Từ đó so sánh độ bền nhiệt của các HX.
2. Tại sao HF lại có nhiệt độ sôi cao hơn hẳn so với các halogen halide khác? Tại sao từ HCI đến HI nhiệt độ sôi lại tăng?
3. Biểu diễn liên kết hydrogen có thể có trong dung dịch HF.
Câu IV (5,0 điểm)
1. Lập phương trình hóa học theo phương pháp thăng bằng electron của phản ứng xảy ra trong các trường hợp sau (mỗi trường hợp chỉ biểu diễn bằng một phương trình); chỉ rõ chất khử, chất oxi hóa.
(Xem giải) a) Sodium peroxide (Na2O2) là chất oxi hóa mạnh được sử dụng trong bình lặn hoặc tàu ngầm để hấp thụ khí carbon dioxide (CO2) và cung cấp khí oxygen (O2) cho con người trong hô hấp.
(Xem giải) b) Để bảo vệ dung dịch ferrous sulfate (FeSO4) không bị chuyển hóa thành ferric sulfate (Fe2(SO4)3) trong phòng thí nghiệm người ta thường ngâm vào dung dịch ferrous sulfate một đinh sắt (Fe) sạch.
(Xem giải) c) Hòa tan kim loại copper (Cu) vào dung dịch nitric acid (HNO3) thu được muối cupric nitrate (Cu(NO3)2), nước và hỗn hợp khí A gồm nitrogen monoxide (NO) và nitrogen dioxide (NO2). Biết A có tỉ khối so với hydrogen là 19,8. Cho: H = 1;N = 14; O = 16.
(Xem giải) 2. Cho V lít hỗn hợp khí Cl2 và O2 phản ứng hết với 2,21 gam hỗn hợp Al và Zn thu được m gam chất rắn X. Cho X vào bình chứa 700 mL dung dịch HCl 0,1M đến khi phản ứng kết thúc thu được dung dịch Y; 0,975 gam một kim loại chưa tan và thấy có khí thoát ra. Thêm tiếp vào bình dung dịch AgNO3 dư thu được 17,59 gam kết tủa.
Tính % khối lượng của Al trong hỗn hợp ban đầu. Cho: Al = 27; Cl = 35,5; Zn = 65; Ag = 108.
(Xem giải) Câu V (3,0 điểm)
Xăng (Gasoline), khí dầu mỏ hóa lỏng (LPG – Liquefied Petroleum Gas) là các nhiên liệu được sử dụng phổ biến trong thực tế. Thành phần hóa học chính của xăng và LPG là các hydrocarbon. Cho phương trình nhiệt hóa học của phản ứng đốt cháy một số hydrocarbon (propane, butane và octane) như sau:
(1) C3H8 (l) + 5O2 (g) → 3CO2 (g) + 4H2O (l) ![]() = -2024 kJ
= -2024 kJ
(2) C4H10 (l) + 6,5O2 (g) → 4CO2 (g) + 5H2O (l) 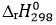 = -2668 kJ
= -2668 kJ
(3) C8H18 (l) + 12,5O2 (g) → 8CO2 (g) + 9H2O (l) 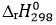 = -5016 kJ
= -5016 kJ
1. Tính enthalpy tạo thành chuẩn của các chất: C3H8 (l), C4H10 (l) và C8H18 (l) Cho enthalpy tạo thành chuẩn của CO2 (g) và H2O (l) lần lượt là -393,5 kJ.mol-1 và -285,8 kJ.mol-1
2. Giả sử rằng: Xăng chỉ chứa octane (C8H18); LPG chỉ gồm propane (C3H8) và butane (C4H10) với số mol bằng nhau; khối lượng riêng của octane, propane, butane lần lượt là 0,70 kg/L, 0,50 kg/L, 0,57 kg/L. Cho: H = 1; C = 12 và xét ở điều kiện chuẩn:
a) Tính năng suất tỏa nhiệt (nhiệt lượng tỏa ra khi đốt cháy hoàn toàn 1 kg nhiên liệu) của xăng và LPG.
b) Một chiếc xe có mức tiêu thụ xăng là 13,0 lit/100 km. Nếu có thể sử dụng LPG làm nhiên liệu thay thế cho ô tô này, hãy tính quãng đường ô tô đi được với 1 lít LPG. Coi hiệu suất động cơ của ô tô là như nhau đối với cả xăng và LPG.
(Xem giải) Câu VI (2,0 điểm)
Ung thư tuyến giáp là loại ung thư phổ biến nhất trong các bệnh ung thư của hệ nội tiết. Người bệnh bị ung thư tuyến giáp thể biệt hóa thường được điều trị bằng đồng vị phóng xạ ![]() sau khi phẫu thuật cắt giáp toàn bộ. Do tế bào ung thư biểu mô tuyến giáp biệt hoá có khả năng bắt giữ và tập trung
sau khi phẫu thuật cắt giáp toàn bộ. Do tế bào ung thư biểu mô tuyến giáp biệt hoá có khả năng bắt giữ và tập trung 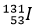 nên khi vào cơ thể
nên khi vào cơ thể 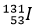 sẽ tập trung vào tế bào hoặc tổ chức ung thư, ở đó tia β (
sẽ tập trung vào tế bào hoặc tổ chức ung thư, ở đó tia β (![]() ) do
) do 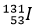 phát ra sẽ tiêu diệt tế bào ung thư theo phương trình của phản ứng hạt nhân sau:
phát ra sẽ tiêu diệt tế bào ung thư theo phương trình của phản ứng hạt nhân sau:
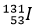 →
→ ![]() +
+ 
Phản ứng này tự xảy ra và cứ sau 8 ngày thì lượng 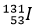 chỉ còn lại một nửa.
chỉ còn lại một nửa.
1. Tính Z và A cho biết phản ứng hạt nhân có sự bảo toàn số khối và điện tích.
2. Tại sao trước khi điều trị cho bệnh nhân cần xác định lại liều phóng xạ?
3. Tại sao nên hạn chế tiếp xúc gần với bệnh nhân vừa mới điều trị phóng xạ 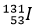 ?
?

Bình luận