[2024 – 2025] Khảo sát HSG trường Hậu Lộc 4 – Thanh Hóa (Lần 6)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề 027-H12A năm 2024-2025
⇒ Thời gian làm bài: 90 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1C | 2A | 3D | 4C | 5D | 6A | 7C | 8C | 9B | 10B |
| 11B | 12D | 13A | 14A | 15C | 16D | 17A | 18B | 19C | 20D |
| Câu 21 | Câu 22 | Câu 23 | Câu 24 | Câu 25 | Câu 26 | |
| (a) | Đ | Đ | Đ | S | Đ | S |
| (b) | Đ | S | S | S | S | Đ |
| (c) | Đ | Đ | Đ | Đ | S | S |
| (d) | Đ | S | Đ | Đ | S | Đ |
| Câu 27 | Câu 28 | Câu 29 | Câu 30 | Câu 31 | Câu 32 |
| 57 | 1,04 | 41,9 | 321 | 24 | 234 |
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 20. Mỗi câu thí sinh chỉ chọn một phương án đúng
(Xem giải) Câu 1: Polymer nào sau đây thuộc loại polymer tổng hợp?
A. Tinh bột. B. Tơ tằm. C. Polyethylene. D. Cao su thiên nhiên.
(Xem giải) Câu 2: Loại polymer thiên nhiên nào có thành phần chính là cellulose?
A. Bông. B. Tơ tằm. C. Len. D. Cao su thiên nhiên.
(Xem giải) Câu 3: Amine nào sau đây ở trạng thái lỏng ở nhiệt độ phòng?
A. Methylamine. B. Ethylamine. C. Dimethylamine. D. Aniline.
(Xem giải) Câu 4: Bộ dụng cụ chiết dùng để tách hai chất lỏng X, Y được mô tả như hình vẽ bên.
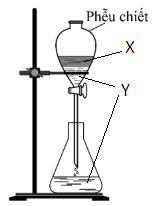
X, Y có thể là những chất nào?
A. Tinh dầu chàm và ethanol. B. Ethanol và nước cất.
C. Tinh dầu chàm và nước cất. D. Nước đường và nước cất.
(Xem giải) Câu 5: Dạng ion chủ yếu nào của amino acid có trong môi trường acid mạnh (pH thấp)?
A. H2N-CH2-COO-. B. +H3N-CH2-COO-.
C. +H3N-CH(CH3)-COO- D. +H3N-CH(CH3)-COOH
(Xem giải) Câu 6: Một pin điện hoá Zn – H2 được thiết lập ở các điều kiện như hình vẽ bên (vôn kế có điện trở rất lớn).
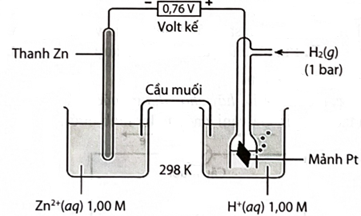
Phát biểu nào sau đây không đúng
A. Giá trị thế điện cực chuẩn của cặp oxi hoá – khử Zn2+/Zn là 0,76 V.
B. Quá trình khử xảy ra ở cathode là: 2H+ + 2e → H2.
C. Chất điện li trong cầu muối là KCl.
D. Phản ứng hoá học xảy ra trong pin là: Zn + 2H+ → Zn2+ + H2.
(Xem giải) Câu 7: Lượng NaF có trong 100ml dung dịch HF 0,1M bằng bao nhiêu? Biết dung dịch có pH = 3,5; hằng số cân bằng Ka của HF là 3,17.10^-4 (bỏ qua sự phân li của H2O)
A. 0,21 gam. B. 0,54 gam. C. 0,42 gam. D. 0,63 gam.
(Xem giải) Câu 8: Phát biểu nào sau đây không đúng?
A. Cả glucose và fructose đều bị oxi hóa bởi thuốc thử Tollens (t°) hoặc Cu(OH)2/NaOH (t°).
B. Để phân biệt dung dịch glucose và fructose có thể dùng thuốc thử dung dịch Br2.
C. Trong công nghiệp, saccharose được dùng để tráng gương và ruột phích vì saccharose có phản ứng tráng bạc.
D. Glucose và fructose là đồng phân của nhau.
(Xem giải) Câu 9: Quan sát hình mô phỏng thí nghiệm bên:
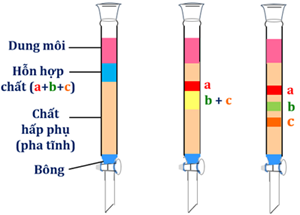
Cho các phát biểu sau
a) Hình mô phỏng thí nghiệm phương pháp sắc kí cột.
b) Chất bị hấp phụ mạnh nhất là chất a.
c) Chất bị hấp phụ kém nhất là chất c.
d) Pha tĩnh là một chất rắn có diện tích bề mặt rất lớn có khả năng hòa tan tốt tất cả các chất a, b, c.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 5.
(Xem giải) Câu 10: Ester là hợp chất hữu cơ dễ bay hơi, một số ester được sử dụng làm chất tạo mùi thơm cho các loại bánh, thực phẩm. Phản ứng điều chế ester là một phản ứng thuận nghịch, ví dụ: CH3COOH(l) + C2H5OH(l) ⇋ CH3COOC2H5(l) + H2O(l) có ![]() > 0. Khi chịu tác động những yếu tố sau: a) tăng nồng độ C2H5OH, b) giảm nồng độ CH3COOH, c) giảm nồng độ CH3COOC2H5, d) tăng áp suất, e) Thêm sulfuric acid đặc vào hệ, f) giảm nhiệt độ phản ứng về nhiệt độ phòng.
> 0. Khi chịu tác động những yếu tố sau: a) tăng nồng độ C2H5OH, b) giảm nồng độ CH3COOH, c) giảm nồng độ CH3COOC2H5, d) tăng áp suất, e) Thêm sulfuric acid đặc vào hệ, f) giảm nhiệt độ phản ứng về nhiệt độ phòng.
Có bao nhiêu tác động làm cân bằng trên chuyển dịch theo chiều thuận
A. 2. B. 3. C. 4. D. 5.
(Xem giải) Câu 11: Cho cấu tạo dạng mạch vòng của saccharose và maltose như hình bên:
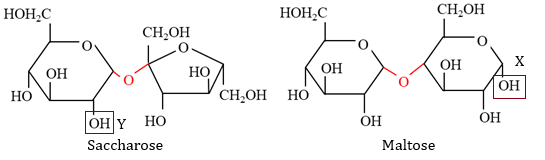
Nhận định nào sau đây đúng?
A. Maltose và saccharose đều có dạng mở vòng.
B. Nhóm OH (X) trong công thức maltose là nhóm OH hemiacetal.
C. Nhóm OH (Y) trong công thức saccharose là nhóm OH hemiketal.
D. Saccharose và maltose đều có 7 nhóm OH.
(Xem giải) Câu 12: Sau khi điều chế, khí SO2 có lẫn hơi nước được dẫn qua bình làm khô chứa các hạt chất rắn T rồi thu vào bình chứa theo hình vẽ bên:
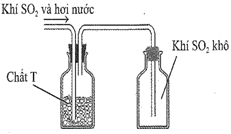
Chất T có thể là :
A. KOH. B. NaOH. C. CaO. D. P2O5.
(Xem giải) Câu 13: Cho các chất, kèm theo các phát biểu sau:
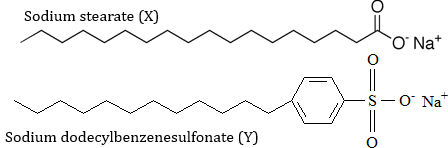
a) Chất X và Y đều là thành phần chính của xà phòng.
b) Chất Y được tổng hợp từ parafin dầu mỏ.
c) Trong X đầu ưa nước là COONa còn trong Y đầu ưa nước là gốc hydrocarbon.
d) Trong dung dịch chất X và Y đều tạo kết tủa với ion Ca2+.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 14: Cho các số liệu nhiệt động của các quá trình chuyển hóa sau (ở 298K)
| STT | Phản ứng | |
| 1 | H2 (g) + Cl2 (g) → 2HCl (g) | -184,6 |
| 2 | CO2 (g) + H2 (g) → CO (g) + H2O (g) | +41,13 |
| 3 | COCl2 (g) → Cl2 (g) + CO (g) | +12,5 |
| 4 | 2NH3 (g) + COCl2 (g) → CO(NH2)2 (s) + 2HCl (g) | -201 |
| 5 | C (s) + ½O2 (g) → CO (g) | -110,5 |
| 6 | H2 (g) + ½O2 (g) → H2O (g) | -241,87 |
| 7 | CO(NH2)2 (s) + H2O (g) → CO2 (g) + 2NH3 (g) | ΔH(7) |
Cho các phát biểu sau:
a) Enthalpy tạo thành chuẩn (![]() ) của CO2; COCl2 và ΔH(7) lần lượt là -393,5 kJ/mol, -123 kJ/mol, +12,23 kJ.
) của CO2; COCl2 và ΔH(7) lần lượt là -393,5 kJ/mol, -123 kJ/mol, +12,23 kJ.
b) Số phản ứng thu nhiệt và tỏa nhiệt lần lượt là 3 và 4.
c) Có 5 phản ứng thuộc loại phản ứng oxi hóa khử.
d) Phản ứng xảy ra thuận lợi nhất (dễ xảy ra nhất) và kém thuận lợi nhất (khó xảy ra nhất) về mặt năng lượng lần lượt là phản ứng 6 và phản ứng 3.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 15: Cho cấu tạo của ammonia và nitrogen như sau:
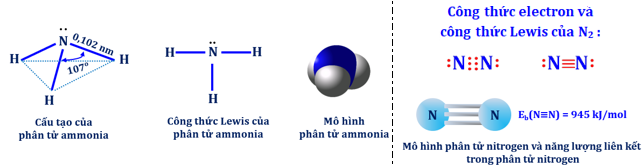
Cho các phát biểu sau
a) Phân tử ammonia có cấu trúc hình chóp tam giác, với nguyên tử nitrogen ở đỉnh, đáy là một tam giác mà đỉnh là ba nguyên tử hydrogen và các liên kết N–H là liên kết cộng hóa trị không phân cực.
b) Ammonia tan nhiều trong nước do các phân tử ammonia có khả tạo được liên kết hydrogen mạnh với nước .
c) Khí nitrogen dễ hóa lỏng hơn khí ammonia vì liên kêt giữa các phân tử nitrogen là tương tác Van der waals yếu, liên kết giữa các phân tử ammonia là liên kết hydrogen mạnh.
d) Do tạo được liên kết hydrogen với nước nên trong dung dịch, ammonia thể tính base.
e) Khi tham gia phản ứng hóa học nitrogen và ammonia đều có tính base vì trên nguyên tử nitrogen đều còn cặp electron chưa liên kết. Ngoài ra ammonia còn có tính khử, nitrogen vừa có tính khử vừa có tính oxi hóa.
Số phát biểu sai là
A. 2. B. 3. C. 4. D. 5.
(Xem giải) Câu 16: Cho các phát biểu sau:
(a) Trong phân tử alcohol có nhóm -OH.
(b) Ethyl alcohol dễ tan trong nước vì phân tử ethyl alcohol phân cực và tạo được liên kết hydrogen với phân tử nước.
(c) Hợp chất C6H5OH là alcohol thơm, đơn chức.
(d) Nhiệt độ sôi của CH3-CH2-CH2OH cao hơn của CH3-O-CH2-CH3.
(e) Có 5 alcohol đồng phân cấu tạo ứng với công thức phân tử C4H10O.
Số phát biểu đúng là
A. 2. B. 5. C. 4. D. 3.
(Xem giải) Câu 17: Cho phổ hồng ngoại (IR) của chất X như sau?
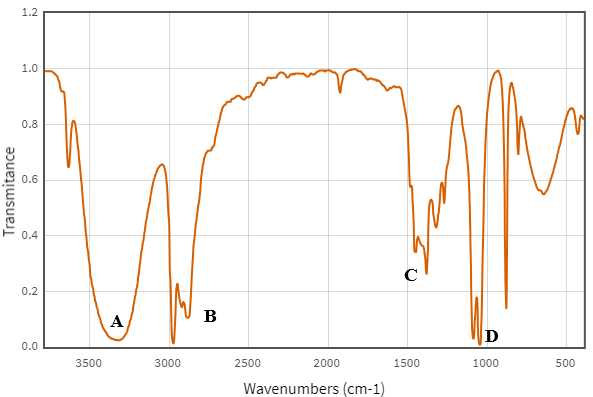
Cho các phát biểu sau:
a) Peak A là tín hiệu của nhóm OH.
b) Peak A và peak D cho thấy X là một carboxylic acid.
c) Peak B và peak D cho thấy X là một aldehyde.
d) Peak C là tín hiệu của nhóm chức C=O.
Số phát biểu đúng là
A. 1. B. 5. C. 4. D. 3.
(Xem giải) Câu 18: Tiến hành làm các thí nghiệm sau:
(1) Cho hỗn hợp gồm x mol copper và x mol Iron (II, III) oxide (Fe3O4) vào dung dich chứa 4x mol sulfuric acid loãng.
(2) Cho hỗn hợp sodium hydrogensulfate và potassium hydrogencarbonate (ti lệ mol 1:1) vào nước dư.
(3) Cho dung dich chứa x mol barium hydroxide vào dung dich chứa x mol sodium hydrogencarbonate.
(4) Cho dung dịch sodium carbonate dư vào dung dịch chứa barium chloride.
Sau khi các phản ứng kết thúc, số thí nghiệm mà sản phẩm thu được dung dich có chứa 2 muối là
A. 1. B. 3. C. 4. D. 2.
(Xem giải) Câu 19: Cho các phát biểu sau
(a) Trong môi trường pH = 3,22, glutamic acid tồn tại ở dạng HOOC-[CH2]2-CH(NH3+)-COO-. Trong quá trình điện di với môi trường pH = 10, glutamic acid trở thành cation và di chuyển về cực âm.
(b) Ethanol là chất kích thích thần kinh trong các loại đồ uống có cồn (rượu, bia…).
(c) Do nhiệt độ sôi của ethanol và nước khác nhau nhiều nên bằng phương pháp chưng cất thường có thể tách được hoàn toàn ethanol tinh khiết từ hỗn hợp ethanol và nước.
(d) Công thức của chất béo chứa 6 liên kết “C = C” có dạng CnH2n-10O6.
(e) Hợp chất hữu cơ no, mạch hở C5H10O có tối đa 2 đồng phân tạo kết tủa màu vàng với I2/NaOH và có tối đa 3 đồng phân tạo kết tủa đỏ gạch với Cu(OH)2 /NaOH (t°).
Số phát biểu sai là
A. 2 B. 5 C. 4 D. 3
(Xem giải) Câu 20: Để bảo đảm năng suất lúa vụ hè thu tại Đồng bằng sông Cửu Long, với mỗi hecta đất trồng lúa, người nông dân cần cung cấp 70 kilogram N; 60 kilogram P2O5 và 110 kilogram K2O. Loại phân mà người nông dân sử dụng là phân hỗn hợp NPK (20 – 20 – 15) trộn với phân kali KCl (độ dinh dưỡng 60%) và urea (độ dinh dưỡng 46%). Tổng khối lượng (kg) phân bón mà người nông dân phải sử dụng cho 1 hecta (1 hecta = 10.000 m²) đất có giá trị gần nhất với giá trị nào sau đây?
A. 300 kg. B. 110 kg. C. 400 kg. D. 430 kg.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 21 đến câu 26. Trong mỗi ý a), b), c), d) ở mỗi câu,thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 21: Ethylene được ứng dụng rộng rãi trong việc sản xuất bao bì, dệt may, điện tử, vận chuyển. Sử dụng cho ngành chất dẫn xuất và ngành hóa dầu. Ethylene tham gia vào các phản ứng tạo ra hóa chất, tổng hợp các chất hữu cơ như: ethylene glycol, ethanol,…Sơ đồ dưới đây tổng hợp một số chất hữu cơ từ ethylene.
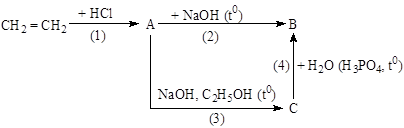
Biết rằng A, B, C đều là các chất hữu cơ.
a) Nếu thay ethylene bằng but-1-ene, biết A là sản phẩm chính, thì sản phẩm chính thu được ở phản ứng (3) là CH3CH=CHCH3.
b) Hợp chất C là C2H4.
c) Hợp chất hữu cơ B là CH3CH2OH.
d) Các Phản ứng (1), (3), (4) đều là phản ứng oxi hoá – khử.
(Xem giải) Câu 22. Biểu đồ dưới đây biểu diễn lượng đường huyết trước, trong và sau quá trình tập thể dục của một người khoẻ mạnh, không mắc bệnh đái tháo đường.
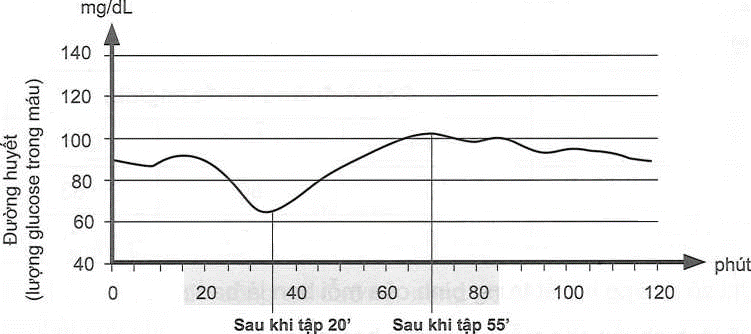
Biểu đồ đường huyết theo thời gian (phần tô màu là thời gian tập thể dục)
Sau khi quan sát biểu đồ trên, có các nhận định sau:
a) Quá trình tập thể dục diễn ra trong khoảng 70 phút.
b) Lượng đường huyết giảm khi bắt đầu tập thể dục và xuống mức thấp nhất sau 25 phút tập.
c) Lượng đường huyết tăng lên mức cao nhất sau khi tập thể dục được 55 phút.
d) Sau khi tập thể dục xong, lượng đường huyết luôn ổn định ở mức 100 mg/dL.
(Xem giải) Câu 23: Để tách lấy lượng phân bón chứa potasium người ta thường tách KCl khỏi quặng Sylvinit thành phần chính của quặng là NaCl và KCl. Do NaCl và KCl có nhiều tính chất tương tự nhau nên người ta không dùng phương pháp hóa học để tách chúng. Thực tế người ta dựa vào độ tan khác nhau của chúng trong nước theo nhiệt độ để tách hai chất này. Biết rằng độ tan (ký hiệu là S) của một chất ở nhiệt độ xác định là khối lượng chất đó tan trong 100 gam nước để tạo dung dịch bão hòa.
| t°C | 10 | 20 | 30 | 40 | 50 | 70 | 90 | 100 | |
| S(NaCl) | 35,6 | 35,7 | 35,8 | 36,7 | 36,9 | 37,5 | 37,5 | 38,5 | 39,1 |
| S(KCl) | 28,5 | 32,0 | 34,7 | 42,8 | 45,2 | 48,3 | 48,3 | 53,8 | 56,6 |
Tiến hành các bước sau:
– Bước 1: Hòa tan một lượng quặng sinvinit được nghiền nhỏ vào 1000 gam nước ở 100°C, lọc bỏ phần rắn không tan thu được dung dịch bão hòa.
– Bước 2: Làm lạnh dung dịch bão hòa đến 0°C (lượng nước không đổi) thấy tách ra m1 gam chất rắn.
– Bước 3: Tiếp tục cho m1 gam chất rắn này vào 100 gam H2O ở 10°C, khuấy đều thì tách ra m2 gam chất rắn không tan.
Cho các nhận định sau:
a) Giá trị m1 = 316 gam.
b) Trong chất rắn m2 vẫn còn một lượng nhỏ muối NaCl.
c) Sau bước 2 chưa tách được hoàn toàn KCl ra khỏi hỗn hợp.
d) Giá trị m2 = 249 gam.
(Xem giải) Câu 24: Rutin có nhiều trong hoa hòe, có tác dụng làm bền vững thành mạch, chống co thắt, chống viêm cầu thận cấp. Rutin được dùng để điều chế thuốc chứa quercetin có tác dụng chống oxi hóa, kháng viêm, chống dị ứng, ngăn ngừa ung thư. Trong môi trường acid, một phân tử rutin phản ứng với 2 phân tử nước, thu được sản phẩm gồm quercetin, glucose và rhamnose (C6H12O5). Biết độ tan của rutin (gam/1L nước) ở 100°C và 25°C lần lượt là 5,2 và 0,125. Rutin có công thức cấu trúc như hình sau:
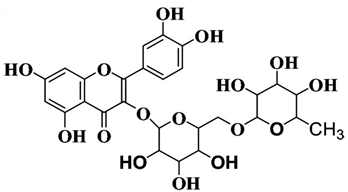
a) Không nên uống trà có hoa hòe vì hoa hòe chứa các chất gây hại cho sức khỏe.
b) Công thức phân tử của rutin là C26H28O16.
c) Để tách rutin từ hoa hòe có thể dùng phương pháp chiết và kết tinh.
d) Công thức phân tử của quercetin là C15H10O7.
(Xem giải) Câu 25: Methyl butanoate có mùi thơm của trái cây nên thường được sử dụng trong công nghiệm sản xuất bánh kẹo, nước giải khát…. Trong phòng thí nghiệm, methyl butanoate được tổng hợp bằng cách đun nóng hỗn hợp gồm methanol, butanoic acid và sulfuric acid đặc trong bình cầu chịu nhiệt ở điều kiện thích hợp. Sau một thời gian thu được hỗn hợp E gồm alcohol, acid, ester và nước. Biết một số tính chất vật lí của các chất trong hỗn hợp E như sau:
| Chất | Khối lượng riêng ở 25°C (g.mL-1) | Độ tan ở 25°C (g/100g nước) | Nhiệt độ sôi (°C) |
| H2O | 1,00 | 100 | |
| CH3OH | 0,79 | ∞ | 78 |
| CH3CH2CH2COOH | 0,96 | ∞ | 163,5 |
| CH3CH2CH2COOCH3 | 0,89 | 1,4 | 102 |
a) Bình cầu chịu nhiệt cần thêm đá bọt giúp tránh chất lỏng sôi trào.
b) Để yên bình cầu một thời gian, hỗn hợp bị phân thành 3 lớp, lớp trên cùng là Methyl butanoate, lớp giữa là methanol và butanoic acid, lớp dưới cùng là sulfuric acid.
c) Để tách methyl butanoate ra khỏi hỗn hợp E, người sử dụng phương pháp chưng cất sẽ phù hợp hơn phương pháp chiết.
d) Trong thực tế, người ta thường thêm vào hỗn hợp E dung dịch NaCl bão hòa nhằm mục đích làm tăng khối lượng riêng của methyl butanoate.
(Xem giải) Câu 26: Muối Mohr có công thức (NH4)2Fe(SO4)2.6H2O. Để xác định độ tinh khiết của một loại muối Mohr (cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến hành các thí nghiệm sau: Cân chính xác 7,237 gam muối Mohr, pha thành 100 ml dung dịch X. Lấy chính xác 10 mL dung dịch X, thêm 10 mL dung dịch H2SO4 10%, được dung dịch Y. Chuẩn độ dung dịch Y bằng dung dịch chuẩn KMnO4 0,023M. Thực hiện chuẩn độ 3 lần. Kết quả đạt được như sau:
| Lần chuẩn độ | 1 | 2 | 3 |
| Thể tích dung dịch KMnO4 (ml) | 16 | 16,1 | 16 |
a) Theo kết quả chuẩn độ ở trên, trong số các giá trị: 93,32; 98,45; 97,36; 99,87, độ tinh khiết (% khối lượng (NH4)2Fe(SO4)2.6H2O) của muối Mohr có giá trị gần nhất với 98,45.
b) Dung dịch H2SO4 được thêm vào dung dịch chuẩn độ để tạo môi trường acid, giúp phản ứng xảy ra theo hướng tạo thành Mn2+.
c) Có thể thay dung dịch H2SO4 đã dùng bằng dung dịch acid mạnh như HCl, HNO3 nhưng phải đảm bảo lượng H+ dư sau phản ứng.
(d) Trong mỗi lần chuẩn độ, dung dịch KMnO4 được xem là phản ứng vừa đủ với muối Mohr (điểm dừng) khi giọt dung dịch KMnO4 cuối cùng nhỏ vào dung dịch Y không mất màu.
Phần III: Trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 27 đến câu 32.
(Xem giải) Câu 27: Carboxylic acid X đơn chức có tác dụng kháng khuẩn nhẹ, được sử dụng trong điều trị một số loại bệnh. Kết quả phân tích nguyên tố (theo khối lượng) cho thấy X chứa 53,33% oxygen. Ethanol phản ứng với X trong môi trường H2SO4 đặc tạo thành chất hữu cơ Y theo phương trình hoá học sau:
C2H5OH(l) + X(l) (H+, t°) ⇋ Y(l) + H2O(l)
Ở nhiệt độ t°C, giá trị Kc của phản ứng trên là 3,4. Nếu cho 46,0 g ethanol phản ứng với 60,0 g X ở t°C thì khối lượng Y thu được trong hỗn hợp ở trạng thái cân bằng là bao nhiêu gam (làm tròn kết quả đến hàng đơn vị)? (Coi tổng thể tích của hệ phản ứng không đổi).
(Xem giải) Câu 28: Theo Hiệp hội bảo vệ môi trường Mỹ (EPA) sử dụng nhôm tái chế để sản xuất chỉ tiêu tốn năng lượng và xả lượng chất thải chỉ bằng 5% so với việc dùng kim loại nhôm. EPA đã cung cấp một danh sách cụ thể để về mức năng lượng tiết kiệm được thông qua hoạt động tái chế. Ví dụ như tái chế 10 lon bia sẽ tiết kiệm nguồn năng lượng đủ cho 1 chiếc máy tính xách tay hoạt động trong 52 giờ. Một nhà máy phế liệu dùng m tấn phế thải chứa 98% khối lượng Al2O3, còn lại tạp chất trơ không chứa Al để luyện nhôm. Cho biết hàm lượng 1kg Al sinh ra tương ứng với 30 lon bia. Hiệu suất quá trình phản ứng là 93%. Với lượng phế liệu trên sẽ tiết kiệm năng lượng cho 1 chiếc máy tính hoạt động trong 78343,2 giờ. Giá trị của m bằng bao nhiêu? (Làm tròn kết quả đến hàng trăm).
(Xem giải) Câu 29: Trong công nghiệp, calcium (Ca) là chất khử để sản xuất các kim loại phóng xạ thorium (Th), uranium (U), …và tạo hợp kim cùng với nhôm, beryllium, magnesium, …… Sản xuất calcium bằng phương pháp điện phân nóng chảy CaCl2 với dòng điện có cường độ 3000A và điện áp U = 25V. Hiệu suất điện phân là 80%. Tính điện năng (theo kWh) đã sử dụng điều chế 1kg Ca. (Làm tròn kết quả đến hàng phần mười). Cho biết: Điện năng, A = U.q (q là điện lượng, U là điện áp); 1 mol điện lượng = 96485C; 1kWh = 3,6.10^6J).
(Xem giải) Câu 30: Một nhà máy nhiệt điện khí có sản lượng điện 10^6 kWh/ngày (1 kWh = 3600 kJ) đã sử dụng khí thiên nhiên hóa lỏng LNG (chứa 94% CH4, 6% C2H6 về thể tích) làm nhiên liệu. Các nhiên liệu bị đốt cháy hoàn toàn tạo ra sản phẩm khí (biết 62% nhiệt lượng tỏa ra trong quá trình đốt cháy được chuyển hóa thành điện năng). Tính khối lượng khí CO₂ (theo tấn) mà nhà máy thải ra trong 1 ngày (kết quả làm tròn đến hàng đơn vị)? Biết nhiệt bay hơi của H2O(l) ở 25°C và 1 bar là 44 kJ/mol; CH4 và C2H6 cháy theo các phương trình nhiệt hóa học:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) 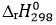 = -893 kJ
= -893 kJ
C2H6(g) + 3,5O2(g) → 2CO2(g) + 3H2O(l) 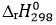 = -1560 kJ
= -1560 kJ
(Xem giải) Câu 31: Enzyme là một thành phần thiết yếu của các chất giặt rửa cao cấp và việc sử dụng chúng mang lại cho người tiêu dùng những lợi ích rõ rệt. Những lợi ích này bao gồm khả năng làm việc ở nhiệt độ thấp, tiết kiệm nước, đồng thời loại bỏ nhu cầu sử dụng các hoá chất khắc nghiệt, gây tác động tiêu cực đến môi trường. Ngoài ra, enzyme có thể phân huỷ sinh học nên không để lại dư lượng độc hại. Protease là loại enzyme không thể thiếu trong tất cả các loại hoá chất giặt rửa, nhất là trong bột giặt, do protease thích hợp để dễ loại bỏ các vết bẩn do thức ăn, máu và các dịch do cơ thể con người tiết ra. Để khảo sát độ hoạt động của protease theo nhiệt độ, người ta tiến hành thí nghiệm nghiên cứu tốc độ phân huỷ chất bẩn bởi protease. Kết quả cho bởi biểu đồ bên:
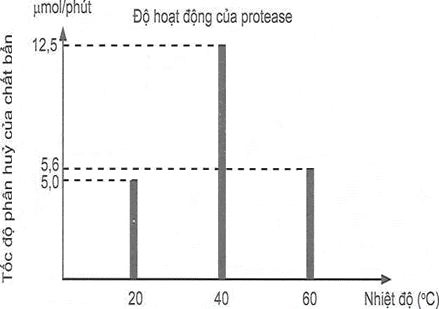
Cho các phát biểu sau:
(1) Chất giặt rửa chứa enzyme protease phân hủy chất bẩn tốt hơn nhưng gây ô nhiểm môi trường, để lại dư lượng chất độc hại.
(2) Chất giặt rửa chứa enzyme protease hoạt động tối ưu ở nhiệt độ 40°C.
(3) Khi tăng nhiệt độ, tốc độ phân hủy của các vết bẩn trên trong quần, áo sẽ nhanh hơn vì hoạt động của enzyme protease tăng dần.
(4) Tỉ lệ tốc độ phân hủy của chất bẩn ở nhiêt độ 40°C và 20°C tương ứng là 5 : 2.
(5) Do có tính chọn lọc cao, phải sử dụng ở một nhiệt độ nghiêm ngặt nên người ta đang dần thay thế chất giặt rửa chứa enzyme bằng chất giặt có chứa các chất tẩy rửa mạnh.
Liệt kê theo thứ tự từ bé đến lớn số phát biểu đúng?
(Xem giải) Câu 32: Cho sơ đồ nguyên tắc quá trình Haber tổng hợp ammonia như hình bên:
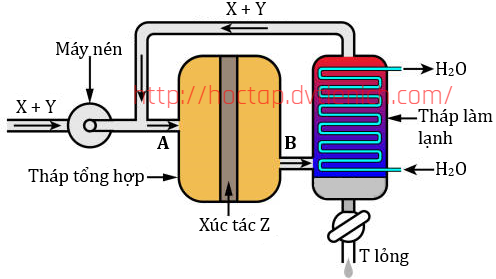
Ban đầu thêm vào lần lượt thể tích chất X và chất Y lần lượt bằng 3,7185 m³ và 1,2395 m³ (các khí đo ở cùng điều). Cho các phát biểu sau:
(1) Các chất X, Y, Z và T lần lượt là N2, H2, Fe và NH3.
(2) Nhiệt độ sôi của T cao hơn so với X và Y và tại tháp làm lạnh toàn bộ khí T sẽ hóa lỏng sau đó tách ra, còn X và Y vẫn ở trạng thái khí và thực hiện vòng tuần hoàn mới.
(3) Bộ phận nén có vai trò tăng áp suất của hệ phản ứng trong tháp phản ứng lên đến gần 200 bar để cân bằng phản ứng tổng hợp ammonia chuyển dịch theo chiều thuận (chiều tạo ammonia).
(4) Biết rằng tỉ lệ mol N2 : H2 trong tháp tổng hợp là 1 : 3. Nếu tốc độ dòng khí đi qua điểm (A) là 1000 mol/s; Khí đi qua điểm (B) là 900 mol/s, thì hiệu suất phản ứng tổng hợp NH3 ở tháp phản ứng là 20%.
Liệt kê theo thứ tự từ bé đến lớn số phát biểu đúng?

Bình luận