[2024 – 2025] Thi học sinh giỏi lớp 12 cụm Hải Dương (Lần 2)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 002-H12B năm 2024-2025
⇒ Thời gian làm bài: 90 phút
⇒ Bảng đáp án phần trắc nghiệm:
Đáp án phần 1:
| 1B | 2A | 3D | 4C | 5A | 6A | 7D | 8A |
| 9D | 10D | 11B | 12D | 13A | 14D | 15A | 16A |
| 17B | 18C | 19B | 20C | 21C | 22A | 23D | 24D |
Đáp án phần 2:
| Câu 1 | Câu 2 | Câu 3 | Câu 4 | Câu 5 | Câu 6 | |
| (a) | S | S | Đ | Đ | S | S |
| (b) | Đ | S | Đ | S | S | Đ |
| (c) | S | Đ | S | Đ | Đ | S |
| (d) | Đ | Đ | S | S | S | Đ |
Đáp án phần 3:
| Câu 1 | Câu 2 | Câu 3 | Câu 4 | Câu 5 | Câu 6 | Câu 7 | Câu 8 |
| 680 | 6 | 40 | 2 | 52,7 | 877 | 280 | 76 |
⇒ Đề thi và giải chi tiết:
Phần I: Câu hỏi trắc nghiệm nhiều lựa chọn (6,0 điểm)
(Xem giải) Câu 1. Phương trình hóa học của phản ứng tổng hợp ammonia từ nitrogen và hydrogen bằng quá trình Haber như sau: N2 (g) + 3H2 (g) ⇋ 2NH3 (g)  = -91,8 kJ
= -91,8 kJ
Có bao nhiêu phát biểu sau đây liên quan tới quá trình Haber nào sau đây là đúng?
(a) Là quá trình thuận nghịch nên tại thời điểm cân bằng, hỗn hợp trong buồng phản ứng gồm ammonia, nitrogen và hydrogen.
(b) Do ammonia dễ hóa lỏng hơn nên khi làm lạnh hỗn hợp sẽ tách được ammonia lỏng ra khỏi hỗn hợp khí.
(c) Nếu giảm áp suất của hệ thì phản ứng sẽ chuyển dịch theo chiều thuận.
(d) Phản ứng thuận là phản ứng tỏa nhiệt. Vì vậy, để phản ứng chuyển dịch theo chiều thuận, cần phải giảm nhiệt độ. Tuy nhiên, nếu giảm nhiệt độ xuống thấp thì tốc độ phản ứng lại giảm.
A. 4. B. 3. C. 6. D. 5.
(Xem giải) Câu 2. Sự thay đổi màu của hoa cẩm tú cầu đã tạo nên vẻ đẹp kì diệu của loài hoa này. Màu của loài hoa này có thể thay đổi tùy thuộc vào pH của đất trồng nên có thể điểu chỉnh màu hoa thông qua việc điều chỉnh độ pH của đất
| pH đất trồng | < 7 | = 7 | > 7 |
| Hoa sẽ có màu | Lam | Trắng sữa | Hồng |
Khi trồng loài hoa trên, nếu ta bón thêm 1 ít vôi (CaO) hoặc đạm 2 lá (NH4NO3) và chỉ tưới nước thì khi thu hoạch hoa sẽ có màu lần lượt là
A. hồng – lam. B. lam – hồng. C. trắng sữa – hồng. D. hồng – trắng sữa.
(Xem giải) Câu 3. Sau khi điều chế, khí SO2 có lẫn hơi nước được dẫn qua bình làm khô chứa các hạt chất rắn T rồi thu vào bình chứa theo hình vẽ sau:
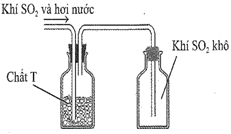
Chất T có thể là
A. KOH. B. NaOH. C. CaO. D. P2O5.
(Xem giải) Câu 4. Hình vẽ dưới đây mô tả các bước tiến hành phương pháp kết tinh:
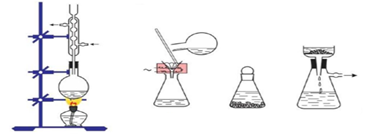
Mục đích của phương pháp kết tinh là
A. tách các chất lỏng có nhiệt độ sôi khác nhau nhiều.
B. tách hai chất lỏng không trộn lẫn được vào nhau.
C. tách hai chất rắn có độ tan khác nhau.
D. tách chất lỏng và chất rắn.
(Xem giải) Câu 5. Có bao nhiêu alkane (có số nguyên tử C ≤ 5) khi tác dụng với chlorine (có ánh sáng hoặc đun nóng) tạo duy nhất một sản phẩm thế monochloro?
A. 3. B. 2. C. 1. D. 4.
(Xem giải) Câu 6. Cho nhiệt đốt cháy hoàn toàn 1 mol các chất ethane, propane, butane và pentane lần lượt là 1570 kJ/mol; 2220 kJ/mol; 2875 kJ/mol và 3536 kJ/mol. Khi đốt cháy hoàn toàn 1 gam chất nào sẽ thu được lượng nhiệt lớn nhất?
A. Ethane. B. Propane. C. Pentane. D. Butane.
(Xem giải) Câu 7. Biết độ dài liên kết C=C là 134pm, liên kết C-C là 154 pm. Thực tế 3 liên kết π trong vòng benzene không cố định mà trải đều trên toàn bộ vòng benzene. Giá trị nào dưới đây phù hợp với độ dài liên kết giữa carbon và carbon trong phân tử benzene?
A. 125 pm. B. 132 pm. C. 160 pm. D. 139 pm.
(Xem giải) Câu 8. Hydrocarbon thơm X có công thức phân tử C8H10, khi tác dụng với dung dịch KMnO4 trong môi trường H2SO4 tạo nên hợp chất hữu cơ đơn chức Y. X phản ứng với chlorine có chiếu sáng tạo hợp chất hữu cơ Z chứa một nguyên tử Cl trong phân tử (là sản phẩm chính). Các chất X, Y, Z có công thức cấu tạo lần lượt là
A. C6H5CH2CH3; C6H5COOH; C6H5CHClCH3.
B. C6H5CH2CH3; C6H5CH2COOH; C6H5CHClCH3.
C. o-CH3C6H4CH3; o-HOOCC6H4COOH; o-ClCH2C6H4CH2Cl.
D. p-CH3C6H4CH3; p-HOOCC6H4COOH; p-ClCH2C6H4CH2Cl.
(Xem giải) Câu 9. Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: HCOOH; CH3COOH; HCl; C6H5OH. Giá trị pH của các dung dịch trên cùng nồng độ 0,01M, ở 25°C đo được như sau:
| Chất | X | Y | Z | T |
| pH | 6,48 | 3,22 | 2,00 | 3,45 |
Nhận xét nào sau đây đúng?
A. Y tạo kết tủa trắng với nước bromine.
B. X được điều chế trực tiếp từ ethyl alcohol
C. T bị oxi hóa bởi thuốc thử Tollens
D. Z tạo kết tủa trắng với dung dịch AgNO3.
(Xem giải) Câu 10. Acetic acid được sử dụng rộng rãi để điều chế polymer, tổng hợp hương liệu,… Acetic acid được tổng hợp từ nguồn khí than đá (giá thành rẻ) theo các phản ứng sau:
CO + 2H2 (t°, xt) → CH3OH (1)
CH3OH + CO (t°, xt) → CH3COOH (2)
Giả sử hiệu suất của các phản ứng (1) và (2) đều đạt 90%. Để sản xuất 1000 lít acetic acid (D = 1,05g/mL), cần thể tích khí CO và H2 (ở điều kiện chuẩn) lần lượt là
A. 964,06 m³ và 1928,12 m³. B. 535,6 m³ và 1071,17 m³.
C. 964,06 m³ và 964,06 m³. D. 1017,6 m³ và 1071,2 m³.
(Xem giải) Câu 11. Chất nào dưới đây được sử dụng để tẩy rửa sơn móng tay, tẩy keo siêu dính, chất tẩy trên các đồ gốm sứ, thủy tinh; ngoài ra, còn được sử dụng làm phụ gia để bảo quản thực phẩm?
A. HCHO. B. CH3COCH3. C. CH3COOH. D. CH3CHO.
(Xem giải) Câu 12. Hỗn hợp E gồm X, Y, Z (57 < MX < MY < MZ < 78), đều là những hợp chất hữu cơ tạp chức, trong phân tử chỉ chứa C, H và O. X, Y, Z có các tính chất sau:
– X, Y, Z đều tác dụng được với Na.
– Y, Z đều tác dụng được với NaHCO3
– X, Y đều có phản ứng với thuốc thử Tollens.
Tổng khối lượng mol các chất X, Y, Z là
A. 196. B. 212. C. 194. D. 210.
(Xem giải) Câu 13. Cho các phát biểu sau:
(a) Phân bón có vai trò cung cấp các nguyên tố dinh dưỡng cho cây trồng và góp phần cải tạo đất.
(b) Việc lựa chọn phân bón cần dựa vào: Nhu cầu dinh dưỡng của mỗi loại cây trồng, ở các giai đoạn sinh trưởng khác nhau và đặc điểm của mỗi loại đất.
(c) Phân bón hữu cơ là phân bón chứa các hợp chất hữu cơ mà con người tổng hợp được.
(d) Phân bón hữu cơ có thể được sản xuất tại hộ gia đình.
Số phát biểu đúng là
A. 3. B. 2. C. 1. D. 4.
(Xem giải) Câu 14. Phân bón nào sau đây cung cấp nguyên tố nitrogen và phosphorus cho cây trồng?
A. Potassium chloride. B. Calcium dihydrogen phosphate.
C. Ammonium sulfate. D. Ammonium dihydrogen phosphate.
(Xem giải) Câu 15. Geranyl acetate là ester có trong hoa hồng và được chiết xuất để làm hương liệu cho nước hoa. Công thức cấu tạo thu gọn của geranyl acetate là
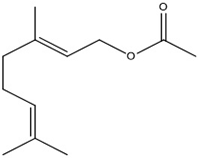
Công thức phân tử của Geranyl acetate là
A. C12H20O2. B. C11H18O2. C. C11H16O2. D. C12H18O2.
(Xem giải) Câu 16. Thủy phân hoàn toàn 1 mol triester X trong dung dịch NaOH dư, thu được 1 mol glycerol, 1 mol sodium propionate và 2 mol sodium acrylate. Phát biểu nào sau đây đúng?
A. Phân tử X có 5 liên kết π.
B. Có 3 đồng phân cấu tạo thỏa mãn tính chất của X.
C. Phân tử chất X có chứa 18 nguyên tử hydrogen.
D. 1 mol X làm mất màu tối đa 1 mol Br2 trong dung dịch.
(Xem giải) Câu 17. Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho vào cốc thủy tinh chịu nhiệt khoảng 5 gam mỡ lợn và 10 mL dung dịch NaOH 40%.
Bước 2: Đun sôi nhẹ hỗn hợp, liên tục khuấy đều bằng đũa thủy tinh khoảng 30 phút và thỉnh thoảng thêm nước cất để giữ cho thể tích hỗn hợp không đổi. Để nguội hỗn hợp.
Bước 3: Rót thêm vào hỗn hợp 15 – 20 mL dung dịch NaCl bão hòa nóng, khuấy nhẹ. Để yên hỗn hợp.
Cho các phát biểu sau:
(1) Sau bước 3 thấy có lớp chất rắn màu trắng nổi lên là glycerol.
(2) Vai trò của dung dịch NaCl bão hòa ở bước 3 là để tách muối sodium của acid béo ra khỏi hỗn hợp.
(3) Ở bước 2, nếu không thêm nước cất, hỗn hợp bị cạn khô thì phản ứng thủy phân không xảy ra.
(4) Ở bước 1, nếu thay mỡ lợn bằng dầu dừa thì hiện tượng thí nghiệm sau bước 3 vẫn xảy ra tương tự.
(5) Trong công nghiệp, phản ứng ở thí nghiệm trên được ứng dụng để sản xuất xà phòng và glycerol.
Có bao nhiêu phát biểu đúng?
A. 5. B. 4. C. 3. D. 2.
(Xem giải) Câu 18. Cho hai chất hữu cơ mạch hở E, F có cùng công thức đơn giản nhất là CH2O. Các chất E, F, X tham gia phản ứng theo đúng tỉ lệ mol như sơ đồ dưới đây:
E + NaOH → X + Y
F + NaOH → X + Z
X + HCl → T + NaCl
Biết: X, Y, Z, T là các chất hữu cơ và ME < MF < 100. Cho các phát biểu sau:
(a) Chất X có phân tử khối bằng 68.
(b) Từ chất Y điều chế trực tiếp được acetic acid.
(c) Oxi hóa Z bằng CuO, thu được acetic aldehyde.
(d) Chất F làm quỳ tím chuyển thành màu đỏ.
(e) Chất T có nhiệt độ sôi lớn hơn ethyl alcohol.
Số phát biểu đúng là bao nhiêu?
Có bao nhiêu phát biểu đúng?
A. 5. B. 4. C. 3. D. 2.
(Xem giải) Câu 19. Metyl salixylat dùng làm thuốc xoa bóp giảm đau, được điều chế theo phản ứng sau:
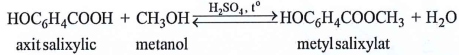
Để sản xuất 3,8 triệu tuýp thuốc xoa bóp giảm đau cần tối thiểu m tấn axit salixylic. Biết mỗi tuýp thuốc chứa 2,7 gam metyl salixylat và hiệu suất phản ứng tính theo axit salixylic là 75%. Giá trị của m là
A. 9,315. B. 12,420. C. 6,986. D. 15,068.
(Xem giải) Câu 20. Cho sơ đồ phản ứng sau:
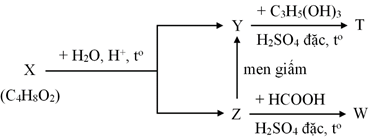
Biết rằng X, Y, Z, T, W là các hợp chất hữu cơ khác nhau; T chỉ chứa một loại nhóm chức. Phát biểu nào sau đây là sai?
A. Y có trong thành phần của giấm ăn.
B. Z có trong thành phần của nước rửa tay khô có tác dụng diệt khuẩn.
C. Phần trăm khối của O trong T là 36,36%.
D. Công thức phân tử của W là C3H6O2.
(Xem giải) Câu 21. Cho đồ thị sau:
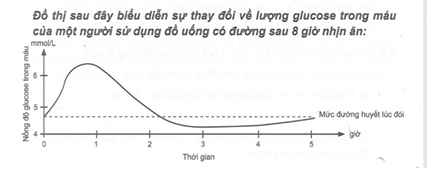
Khi sử dụng đồ uống có đường, nồng độ glucose trong máu tăng cao nhất sau khi
A. sử dụng khoảng 20 phút. B. sử dụng khoảng 2 giờ.
C. sử dụng khoảng 50 phút. D. sử dụng khoảng 3 giờ.
(Xem giải) Câu 22. Cho các phát biểu sau
(a) Mạch nha có hàm lượng maltose cao.
(b) Trong môi trường acid, glucose và fructose có thể chuyển hóa lẫn nhau.
(c) CH3CH2COOCH=CH2 tham gia phản ứng thủy phân trong dung dịch NaOH dư, đun nóng thu được alcohol và muối sodium propionate.
(d) Carbohydrate là những hợp chất hữu cơ đa chức, thường có công thức chung là Cn(H2O)m.
(e) Do có nhóm –OH hemiacetal nên glucose có khả năng phản ứng với methanol khi có mặt HCl khan.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 5.
(Xem giải) Câu 23. Tiến hành các bước thí nghiệm như sau:
– Bước 1: Cho một nhúm bông vào cốc đựng dung dịch H2SO4 70%, đun nóng đồng thời khuấy đều đến khi thu được dung dịch đồng nhất.
– Bước 2: Trung hòa dung dịch thu được bằng dung dịch NaOH 10%.
– Bước 3: Lấy dung dịch sau khi trung hòa cho vào ống nghiệm đựng lượng dư dung dịch AgNO3 trong NH3, sau đó đặt trong cốc nước nóng.
Nhận định nào sau đây đúng?
A. Sau bước 2, nhỏ dung dịch I2 vào cốc thì thu được dung dịch có màu xanh tím.
B. Thí nghiệm trên dùng để chứng minh celulose có chứa nhiều nhóm -OH.
C. Sau bước 1, trong cốc thu được hai loại monosaccarit.
D. Sau bước 3, trên thành ống nghiệm xuất hiện lớp kim loại màu trắng bạc.
(Xem giải) Câu 24. Phản ứng nào sau đây không phải là tính chất của glucose?
A. Phản ứng với Cu(OH)2 tạo phức màu xanh lam. B. Phản ứng với thuốc thử Tollens.
C. Phản ứng lên men tạo ethanol. D. Phản ứng với carboxylic acid tạo ester.
Phần II: Câu hỏi trắc nghiệm dạng Đúng/Sai (6,0 điểm)
(Xem giải) Câu 1 (1,0 điểm): Muối Mohr có công thức (NH4)2Fe(SO4)2.6H2O. Để xác định độ tinh khiết của một loại muối Mohr (cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến hành các thí nghiệm sau: Cân chính xác 7,237 gam muối Mohr, pha thành 100 ml dung dịch X. Lấy chính xác 10 mL dung dịch X, thêm 10 mL dung dịch H2SO4 10%, được dung dịch Y. Chuẩn độ dung dịch Y bằng dung dịch chuẩn KMnO4 0,023M. Thực hiện chuẩn độ 3 lần. Kết quả đạt được như sau:
| Lần chuẩn độ | 1 | 2 | 3 |
| Thể tích dung dịch KMnO4 (ml) | 16 | 16,1 | 16 |
Chọn đúng hoặc sai trong mỗi phát biểu sau:
a. Theo kết quả chuẩn độ ở trên, trong số các giá trị: 93,32; 98,45; 97,36; 99,87, độ tinh khiết (% khối lượng (NH4)2Fe(SO4)2.6H2O) của muối Mohr có giá trị gần nhất với 98,45.
b. Dung dịch H2SO4 được thêm vào dung dịch chuẩn độ để tạo môi trường acid, giúp phản ứng xảy ra theo hướng tạo thành Mn2+.
c. Có thể thay dung dịch H2SO4 đã dùng bằng dung dịch acid mạnh như HCl, HNO3 nhưng phải đảm bảo lượng H+ dư sau phản ứng.
d. Trong mỗi lần chuẩn độ, dung dịch KMnO4 được xem là phản ứng vừa đủ với muối Mohr (điểm dừng) khi giọt dung dịch KMnO4 cuối cùng nhỏ vào dung dịch Y không mất màu.
(Xem giải) Câu 2 (1,0 điểm): Hợp chất hữu cơ X gồm 3 nguyên tố C, H, O. Kết quả phân tích nguyên tố của hợp chất hữu cơ X có mC : mH : mO = 42 : 7 : 16. X có mạch không phân nhánh, có phổ khối lượng và phổ hồng ngoại như sau:
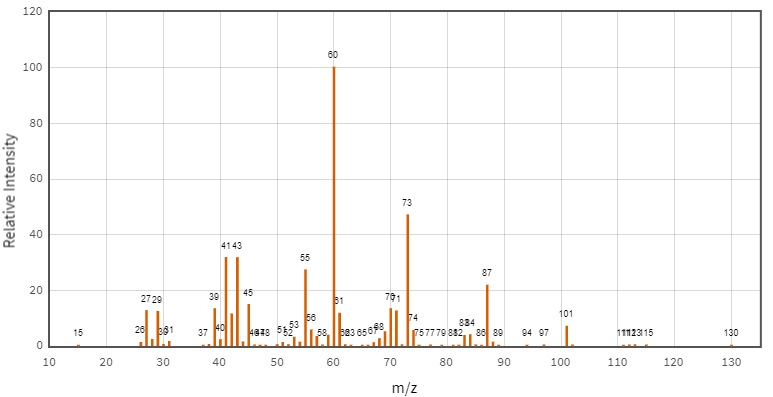
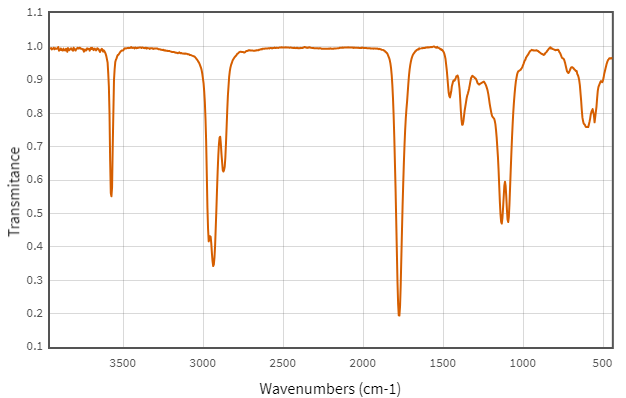
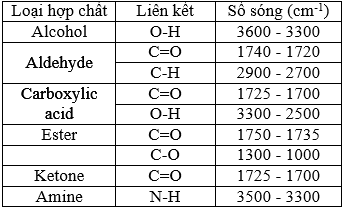
Cho bảng số sóng đặc trưng của các liên kết ở bảng bên. Chọn đúng hoặc sai trong mỗi phát biểu sau:
a. X có 6 nguyên tử carbon.
b. X thuộc loại hợp chất ester
c. X tác dụng được với NaHCO3.
d. X hòa tan trong nước kém hơn acetic acid
(Xem giải) Câu 3 (1,0 điểm): Cho sơ đồ sau (các chất phản ứng theo đúng tỉ lệ mol):
(1) X + NaOH (t°) → X1 + X2
(2) X1 + NaOH (CaO, t°) → X3 + Na2CO3
(3) X2 (H2SO4 đặc, 170°C) → X4 + H2O
(4) X2 + O2 (men giấm) → X5 + H2O
(5) 2X3 (1500°C, làm lạnh nhanh) → X6 + 3H2
(6) X6 + H2O (HgSO4, 80°C) → X7
(7) X7 + H2 → X2
Chọn đúng hoặc sai trong mỗi phát biểu sau:
a. X5 hòa tan Cu(OH)2 tạo thành dung dịch màu xanh.
b. Số nguyên tử hydrogen trong phân tử X là 8.
c. X6 có phản ứng với dung dịch AgNO3 trong NH3 dư, tạo thành kết tủa màu trắng bạc.
d. Đốt cháy hoàn toàn 1,5 mol X7 cần 3 mol O2 (hiệu suất phản ứng 100%).
(Xem giải) Câu 4 (1,0 điểm): Hiện nay người ta dùng thiết bị breathalyzer để đo nồng độ cồn trong khí thở của người tham gia giao thông. Khi có nồng độ cồn trong khí thở sẽ xảy ra phản ứng:
C2H5OH + K2Cr2O7 + H2SO4 CH3COOH + Cr2(SO4)3 + K2SO4 + H2O (*)
Tùy thuộc vào lượng K2Cr2O7 phản ứng, trên màn hình thiết bị sẽ xuất hiện số chỉ nồng độ cồn tương ứng. Người đi xe máy có nồng độ cồn trong khí thở sẽ bị xử phạt theo khung sau đây (trích từ Nghị định 100/ 2019/ NĐ-CP sửa đổi tại Nghị định 123/2021/NĐ-CP):
| Nồng độ cồn
(mg/1L khí thở) |
Mức tiền phạt
(VND) |
Hình phạt bổ sung
(tước giấy phép lái xe) |
| £ 0,25 | 2 triệu – 3 triệu | 10 – 12 tháng |
| 0,25 đến 0,4 | 4 triệu – 5 triệu | 16 – 18 tháng |
| > 0,4 | 6 triệu – 8 triệu | 22 – 24 tháng |
Chọn đúng hoặc sai trong mỗi phát biểu sau:
a. Sau khi uống đồ uống có cồn, ethanol sẽ được hấp thụ vào cơ thể thông qua hệ tiêu hóa.
b. Sau khi cân bằng với các hệ số của các chất là số nguyên nhỏ nhất thì tổng hệ số các chất tham gia phản ứng và sản phẩm của phản ứng (*) là 30.
c. Một mẫu khí thở của một người điều khiển xe máy tham gia giao thông có thể tích 26,25 mL được thổi vào thiết bị breathalyzer thì có 0,056 mg K2Cr2O7 phản ứng (trong môi trường H2SO4 và ion Ag+ xúc tác). Người điều khiển xa máy đã vi phạm giao thông với mức tiền phạt (6 triệu – 8 triệu), tước giấy phép lái xe (22 – 24 tháng).
d. Phương pháp sản xuất các đồ uống có cồn được sử dụng phổ biến là hydrate hóa alkene.
(Xem giải) Câu 5 (1,0 điểm): Cho ester hai chức, mạch hở X (C9H14O4) tác dụng với lượng dư dung dịch NaOH, đun nóng, thu được alcohol Y (no, hai chức) và hai muối của hai carboxylic acid Z và T (MZ < MT). Chất Y không hoà tan được Cu(OH)2 trong môi trường kiềm. Hydrogen hóa hoàn toàn chất Z thu được chất T.
Chọn đúng hoặc sai trong mỗi phát biểu sau:
a. Acid Z có đồng phân hình học.
b. Có 2 công thức cấu tạo thỏa mãn tính chất của X.
c. Khối lượng mol của acid T là 74 gam/mol.
d. Oxi hóa Y bằng oxygen (xúc tác thích hợp), thu được acetic acid.
(Xem giải) Câu 6 (1,0 điểm): Saccharose monolaurate là ester thu được khi cho saccharose tác dụng với lauric acid. Saccharose monolaurate có cấu tạo:
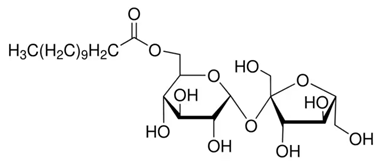
Chọn đúng hoặc sai trong mỗi phát biểu sau:
a. Công thức phân tử của saccharose monolaurate C24H45O12.
b. Saccharose monolaurate được sử dụng làm chất nhũ hoá do phân tử có một đầu ưa nước gắn với một đuôi dài kị nước.
c. Saccharose monolaurate có phản ứng với thuốc thử Tollens.
d. Từ 500 g saccharose và 100 g lauric acid có thể điều chế được tối đa 123,14 gam saccharose monolaurate. Cho biết hiệu suất phản ứng đạt 47%.
Phần III: Câu hỏi trắc nghiệm dạng trả lời ngắn (2,0 điểm)
(Xem giải) Câu 1 (0,25 điểm). Sulfuric acid có thể được điều chế từ quặng pyrite theo sơ đồ: FeS2 → SO2 → SO3 → H2SO4. Biết hiệu suất của cả quá trình là 90%, các tạp chất trong quặng không chứa sulfur. Thể tích dung dịch H2SO4 95% (D = 1,82 g/mL) thu được từ 1 tấn quặng pyrite (chứa 80% FeS2) là bao nhiêu lít? Kết quả làm tròn đến hàng đơn vị.
(Xem giải) Câu 2 (0,25 điểm). Một hợp chất hữu cơ X chứa 37,5% C, 3,1% H và 59,4% F về khối lượng. Cho bay hơi 1,00 g chất này tại 90°C với áp suất 0,50 bar thì thể tích thu được là 0,94 L. Tổng số nguyên tử các nguyên tố có trong phân tử chất X bằng bao nhiêu. Biết phương trình trạng thái khí lý tưởng: PV = nRT (1 bar = 0,987atm; R = 0,082).
(Xem giải) Câu 3 (0,25 điểm). Bình “ga” loại 12 cân sử dụng trong hộ gia đình Y có chứa 12 kg khí hóa lỏng (LPG) gồm propane và butane với tỉ lệ mol tương ứng là 2 : 3. Khi đốt cháy hoàn toàn, 1 mol propane tỏa ra lượng nhiệt là 2220 kJ và 1 mol butane tỏa ra lượng nhiệt là 2850 kJ. Trung bình, lượng nhiệt tiêu thụ từ đốt khí “ga” của hộ gia đình Y là 10 000 kJ/ngày và hiệu suất sử dụng nhiệt là 67,3%. Sau bao nhiêu ngày hộ gia đình Y sử dụng hết bình ga trên? Kết quả làm tròn đến hàng đơn vị.
(Xem giải) Câu 4 (0,25 điểm). X, Y, Z là ba hydrocarbon mạch hở (MX < MY < MZ < 62) có cùng số nguyên tử carbon trong phân tử và đều phản ứng với dung dịch AgNO3 trong NH3 dư. Cho 26,2 gam hỗn hợp E gồm X, Y, Z (tỉ lệ mol tương ứng là 1 : 2 : 2) tác dụng tối đa với a mol Br2 trong dung dịch. Tính a.
(Xem giải) Câu 5 (0,25 điểm). Một loại quặng có chứa 74,4% Ca3(PO4)2, còn lại là các chất trơ không chứa phosphorus, không tan trong nước và acid. Để điều chế phân superphosphate kép X người ta cho phosphoric acid tác dụng vừa đủ với quặng trên. Tính độ dinh dưỡng của X. Kết quả làm tròn đến chữ số thập phân thứ 1.
(Xem giải) Câu 6 (0,25 điểm). Vải Thiều Lục Ngạn (Bắc Giang) là loại quả mang giá trị dinh dưỡng và kinh tế cao. Theo tính toán của một nhà vườn, cứ thu được 100 kg quả vải thì cần cung cấp khoảng 1,84 kg nitrogen, 0,62 kg phosphorus và 1,26 kg kali, để bù lại cho cây phục hồi, sinh trưởng và phát triển. Trong một vụ thu hoạch, nhà vườn đã thu được 10 tấn quả vải và đã dùng hết x kg phân bón NPK (20 – 20 – 15) trộn với y kg phân KCl (độ dinh dưỡng 60%) và z kg urea (độ dinh dưỡng 46%) để bù lại cho cây. Tổng giá trị (x + y + z) bằng bao nhiêu?. Kết quả làm tròn đến hàng đơn vị.
(Xem giải) Câu 7 (0,25 điểm). Chỉ số acid của chất béo là số miligam KOH cần dùng để trung hòa acid béo tự do có trong 1 gam chất béo. Chỉ số xà phòng hóa là tổng số miligam KOH cần để xà phòng hóa triglyceride và trung hòa acid béo tự do trong 1 gam chất béo. Chất béo E gồm triglyceride X và acid béo Y có chỉ số xà phòng hóa là 191,61 và chỉ số acid là 6,18. Khi xà phòng hóa hoàn toàn E bằng dung dịch KOH, thu được dung dịch chỉ chứa một muối. Khối lượng của Y trong 9,06 gam E là m miligam. Giá trị của m bằng bao nhiêu?. Kết quả làm tròn đến hàng đơn vị.
(Xem giải) Câu 8 (0,25 điểm). Cho sơ đồ phản ứng theo đúng tỉ lệ mol
(1) X + 2NaOH → X1 + X2 + X3
(2) X1 + HCl → X4 + NaCl
(3) X2 + HCl → X5 + NaCl
(4) X3 + CuO → X6 + Cu + H2O
Biết X có công thức phân tử C6H10O4 và chứa hai chức ester; X1, X2 đều có hai nguyên tử carbon trong phân tử và khối lượng mol của X1 nhỏ hơn khối lượng mol của X2. Phân tử khối của X5 bằng bao nhiêu?
Phần IV: Tự luận (6,0 điểm): Thí sinh trình bày lời giải câu hỏi tự luận, gồm 3 câu ra giấy thi
Câu 1: (2,0 điểm).
(Xem giải) 1. Hiện nay người ta sản xuất ammonia bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí methane (thành phần chính của khí thiên nhiên).
Phản ứng điều chế H2: CH4 + 2H2O ⇋ CO2 + 4H2 (1)
Phản ứng loại O2 để thu N2: CH4 + 2O2 → CO2 + 2H2O (2)
Phản ứng tổng hợp NH3: N2 + 3H2 ⇋ 2NH3 (3)
a. Để sản xuất khí ammonia, nếu lấy 841,4 m³ không khí (chứa 21,03% O2; 78,02% N2, còn lại là khí hiếm theo thể tích), thì cần phải lấy bao nhiêu m³ khí methane và bao nhiêu m³ hơi nước để có đủ lượng N2 và H2 theo tỉ lệ 1 : 3 về thể tích dùng cho phản ứng tổng hợp ammonia. Giả thiết các phản ứng (1), (2) đều xảy ra hoàn toàn và các thể tích khí đo ở cùng điều kiện.
b. Trong công nghiệp, người ta điều chế phân đạm urea bằng cách cho khí ammonia (NH3) tác dụng với khí carbon dioxide (CO2) ở nhiệt độ 180-200°C, khoảng 200 atm.
Biết hiệu suất phản ứng là 70%, vậy để sản xuất được 6 tấn urea cần phải sử dụng bao nhiêu m³ khí NH3 và bao nhiêu m³ khí CO2 (đkc)?
(Xem giải) 2. Hỗn hợp chất rắn A gồm M2CO3, MHCO3, MCl (M là kim loại kiềm). Cho 43,71 gam A tác dụng hết với lượng dư V mL dung dịch HCl 10,52% (d = 1,05 g/mL), thu được dung dịch B và 17,6 gam khí C. Chia B làm hai phần bằng nhau.
– Phần một tác dụng vừa đủ với 125 mL dung dịch KOH 0,8M. Cô cạn dung dịch sau phản ứng, thu được m gam muối khan.
– Phần hai cho tác dụng hoàn toàn với dung dịch AgNO3 dư, thu được 68,88 gam kết tủa trắng.
a. Xác định kim loại M.
b. Tính % khối lượng các chất trong A.
c. Tính V và tính m.
(Xem giải) Câu 2: (2,0 điểm).
Hợp chất hữu cơ X đơn chức chứa C, H, O. Cho một lượng chất X tác dụng hoàn toàn với 500ml dung dịch KOH 2,4 M rồi cô cạn thu được 105 gam chất rắn khan Y và m gam alcohol Z. Oxi hóa m gam alcohol Z bằng oxygen (có xúc tác) được hỗn hợp A. Chia A thành 3 phần bằng nhau:
– Phần một tác dụng với AgNO3 dư trong dung dịch ammonia thu được 21,6 gam Ag.
– Phần hai tác dụng với dung dịch NaHCO3 dư thu được 2,479 L khí (đkc).
– Phần ba tác dụng với Na vừa đủ thu được 4,958 L khí (đkc) và 25,8 gam chất rắn khan.
a. Xác định công thức cấu tạo của alcohol Z, biết khi đun nóng Z với H2SO4 đặc ở 170°C thu được alkene.
b. Viết các phương trình phản ứng xảy ra. Xác định công thức cấu tạo của X. Viết công thức cấu tạo các đồng phân cùng chức của X và gọi tên.
(Xem giải) Câu 3: (2,0 điểm). Đọc đoạn thông tin sau và trả lời các câu hỏi
Ô nhiễm không khí khiến hơn 3 triệu người chết sớm mỗi năm, nó đe dọa gần như toàn bộ cư dân thành phố lớn tại những nước đang phát triển. Theo đài Fox News, 80% các thành phố trên thế giới không đáp ứng được tiêu chuẩn của Tổ chức Y tế Thế giới (WHO) về chất lượng không khí, trong đó chủ yếu tập trung ở các nước nghèo. WHO cho biết mức độ ô nhiễm không khí đô thị toàn cầu đã tăng 8% bất chấp những cải thiện ở một số vùng. Điều này dẫn đến nguy cơ đột quỵ, bệnh tim mạch, ung thư phổi cùng hàng loạt vấn đề về đường hô hấp.
AQI (Air Quality Index – chỉ số chất lượng không khí) được xem là thước đo mức độ ô nhiễm không khí. Khi chỉ số AQI càng lớn thì những rủi ro đối với sức khoẻ cộng đồng càng cao. Chỉ số AQI tập trung vào các vấn đề về sức khoẻ có thể gặp trong vòng vài giờ hoặc vài ngày sau khi hít thở không khí ô nhiễm.
EPA tính toán chỉ số AQI với 5 thông số ô nhiễm không khí chủ yếu gồm ozone mặt đất; ô nhiễm phân tử (đánh giá quá chỉ số bụi mịn PM 2.5 và PM10); carbon monoxide (CO); sulfur dioxide (SO2) và nitrogen dioxide (NO2).
Đối với mỗi chất gây ô nhiễm, EPA đã thiết lập các tiêu chuẩn chất lượng không khí, trong đó, từng khoảng giá trị AQI được quy định để phản ánh mức độ ô nhiễm không khí. Ví dụ đối với carbon monoxide, EPA đưa ra thang cảnh báo sau:

Khí carbon monoxide được thải ra từ hầu hết các nguồn phát thải của các phương tiện giao thông đường bộ, đường thuỷ, đường hàng không, nhà máy nhiệt điện…
Nhà máy nhiệt điện là nhà máy dùng công nghệ đốt nhiên liệu hóa thạch (than, dầu, khí) để sản xuất ra điện năng. Theo Quy chuẩn kỹ thuật của Việt Nam về lượng khí thải trong công nhiệp nhiệt điện khi phát thải vào môi trường không khí, nồng độ tối đa cho phép các thông số của ô nhiễm khí thải trong công nghiệp ở 25°C và áp suất 760 mmHg, được tính bằng công thức sau:
Cmax = C. Kp. Kv
Trong đó:
Cmax: nồng độ tối đa cho phép của các thông số ô nhiễm khí thải công nghiệp (mg/m³)
C: nồng độ làm cơ sở tính toán nồng độ của các thông số ô nhiễm tối đa cho phép (mg/m³)
Kp: hệ số công suất thiết kế của nhà máy nhiệt điện
Kv: hệ số phân vùng, khu vực
| Thông số | Nồng độ C (mg/m3) | |
| Than | Khí | |
| Nitrogen oxide (NOx), tính theo NO2 | 650 | 250 |
| Sulfur dioxide (SO2) | 500 | 300 |
3.1. Em hãy nêu 5 yếu tố gây ô nhiễm không khí chủ yếu.
3.2. Giả sử nhà máy điện X có hệ số công suất thiết kế Kp = 0,85. Tính nồng độ tối đa cho phép (mg/m3) của các thông số ô nhiễm khí thải công nghiệp của nhà máy nhiệt điện này trong hai khu vực sau:
| Khu vực | Hệ số Kv | |
| Loại 1 | Đô thị đặc biệt, đô thị loại I, di sản thiên nhiên, di tích lịch sử, văn hóa được xếp hạng. Khoảng cách của nhà máy đến ranh giới của khu vực này là 5 km. | Kv = 0,6 |
| Loại 2 | Ngoại thành đô thị đặc biệt, đô thị loại I. Khoảng cách của nhà máy đến ranh giới của khu vực này là 5 km. | Kv = 0,8 |
3.3. Nhà máy nhiệt điện X (câu a) nằm gần Thành phố Y thuộc khu vực loại 1 đã đốt hết 100 tấn than đá (chứa 3,5% sulfur) trong một ngày đêm. Tính khối lượng (mg) SO2 mà nhà máy X phát thải vào không khí. Khi phân tích 40 lít không khí của Thành phố Y người ta thấy có chứa lượng SO2 bằng 1,875.10-4 mol. Hỏi không khí ở Thành phố Y có bị ô nhiễm không? Giải thích.
3.4. Em hãy đề xuất một số biện pháp khắc phục ô nhiễm không khí.

Bình luận