[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Lâm Đồng
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 057-H12B năm 2024-2025
⇒ Thời gian làm bài: 120 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1.1 | 1.2 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 1C | 2B | 3A | (a) | Đ | Đ | Đ | Đ | S | S |
| 4A | 5D | 6A | (b) | Đ | Đ | S | S | S | S |
| 7A | 8B | 9D | (c) | S | S | S | S | Đ | Đ |
| 10C | 11A | 12D | (d) | Đ | S | Đ | Đ | S | Đ |
Phần 1: Trắc nghiệm
1. Trắc nghiệm nhiều lựa chọn (6,0 điểm): Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ ghi một phương án.
(Xem giải) Câu 1. Cho 5 chất gồm: ethyl acetate, methyl methacrylate, tripalmitin, tristearin, triolein.
(1) Có 5 chất tác dụng với dung dịch NaOH 30%, đun nóng.
(2) Có 2 chất tác dụng với nước Br2.
(3) Có 2 chất là chất rắn ở nhiệt độ thường.
(4) Có 2 chất sau khi thuỷ phân trong môi trường kiềm, tạo ra sản phẩm có phản ứng với Cu(OH)2 cho dung dịch màu xanh đậm.
(5) Có 3 chất tác dụng dung dịch NaOH 40%, tạo ra muối dùng làm xà phòng.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 5.
(Xem giải) Câu 2. Cho các nguyên tố X (Z = 8), Y (Z = 13), T (Z = 17), R (Z = 20) ở trạng thái cơ bản. Nhận định nào sau đây là sai?
A. Có ba nguyên tố thuộc loại nguyên tố p.
B. Nguyên tử có số lượng electron độc thân lớn nhất ở trạng thái cơ bản là T.
C. Nguyên tử của R có electron ở lớp ngoài cùng chuyển động trên AO có dạng hình cầu.
D. Có một nguyên tố mà nguyên tử của nó có các phân lớp s, p đều bão hòa electron.
(Xem giải) Câu 3. Cho các phát biểu về carbohydrate:
(1) Carbohydrate là hợp chất hữu cơ tạp chức, thường có công thức chung là Cn(H2O)m.
(2) Nồng độ glucose trong máu người khoẻ mạnh trước khi ăn trong khoảng 4,2–7,2 mmol/L.
(3) Saccharose, tinh bột, cellulose bị thuỷ phân trong môi trường acid, môi trường base hoặc enzyme xúc tác.
(4) Phân tử saccharose được tạo bởi một đơn vị α–glucose và một đơn vị β–fructose, liên kết với nhau qua liên kết α–1,4–glycoside.
(5) Glucose, fructose, saccharose đều có phản ứng tráng bạc với thuốc thử Tollens.
(6) Thủy phân dung dịch chứa 129,76 gam saccharose thu được dung dịch X. Trung hòa dung dịch X rồi tiếp tục cho tác dụng với lượng dư dung dịch AgNO3 trong NH3, đun nóng để tráng bạc một loại gương soi có diện tích bề mặt gương là 10^4 cm² với độ dày lớp bạc được tráng lên là 10^-5 cm. Biết hiệu suất phản ứng thủy phân và tráng bạc đều là 80% và khối lượng riêng của bạc là 10,49 g/cm³. Số gương soi tối đa được tráng bạc là 100 cái.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 5.
(Xem giải) Câu 4. Cho các phát biểu sau:
(1) Củi khi được chẻ nhỏ sẽ cháy nhanh hơn so với củi có kích thước lớn.
(2) Tốc độ phản ứng dùng để đánh giá mức độ xảy ra nhanh hay chậm của phản ứng.
(3) Hằng số tốc độ phản ứng (kí hiệu k) phụ thuộc vào nông độ của chất phản ứng.
(4) Khi tăng áp suất, tốc độ của tất cả các phản ứng đều tăng.
(5) Biểu thức tốc độ tức thời của phản ứng 2CO(g) + O2(g) → 2CO2(g) có dạng v = k.C²(CO).C(O2). Khi tăng nồng độ của CO lên hai lần trong cùng điều kiện thí nghiệm, tốc độ của phản ứng này sẽ tăng lên 4 lần.
Số phát biểu đúng là
A. 3. B. 4. C. 2. D. 5.
(Xem giải) Câu 5. Cho các phát biểu:
(1) Ethanol công thức là C2H5OH được sử dụng làm dung môi, đồ uống có cồn, nhiên liệu…
(2) Nhiệt độ sôi của C2H5OH cao hơn hydrocarbon, aldehyde và acid có cùng số nguyên tử carbon.
(3) Xăng sinh học E5 (gasohol) được tạo ra bằng cách phối trộn xăng thông thường với ethanol theo một tỉ lệ nhất định.
(4) Có thể điều chế ethanol bằng phương pháp hydrate hoá ethylene hoặc lên men tinh bột, đường…
(5) Một đơn vị cồn tương đương 10 mL (hoặc 7,89 gam) ethanol. Theo khuyến cáo của Bộ Y tế, mỗi người trưởng thành không uống quá 2 đơn vị cồn mỗi ngày. Vậy, mỗi người trưởng thành không uống quá 60 mL rượu ethanol 40° mỗi ngày.
Số phát biểu đúng là
A. 2. B. 5. C. 4. D. 3.
(Xem giải) Câu 6. Cho các phát biểu sau:
(1) Poly(vinyl chloride) được sử dụng làm chất dẻo.
(2) Poly(methyl methacrylate) có đặc tính trong suốt, cho ánh sáng truyền qua.
(3) Tơ nylon–6,6 được tạo ra bằng phương pháp trùng hợp.
(4) Lưu hóa cao su thuộc phản ứng tăng mạch polymer.
(5) Cao su thiên nhiên không dẫn điện, có thể tan trong xăng, benzene và có tính dẻo.
(6) Tơ nitron bền và giữ nhiệt tốt nên thường được dùng để dệt vải may áo ấm.
(7) Việc tái chế chất dẻo giúp giảm thiểu ô nhiễm môi trường.
Số nhận định sai là
A. 2. B. 4. C. 5. D. 3.
(Xem giải) Câu 7. Khi làm lạnh nước ở áp suất cao, có mặt các nguyên tử khí hiếm như Ar, Kr,… sẽ có sự tạo thành của hợp chất clathrate. Trường hợp của Ar sẽ tạo thành hợp chất clathrate có công thức đơn giản dạng Ar.6H2O, trong đó các phân tử H2O tạo thành “lồng”, và nguyên tử Ar sẽ chiếm chỗ trống trong “lồng”. Loại liên kết hoặc tương tác nào không xuất hiện trong hợp chất Ar.6H2O?
A. Liên kết cho – nhận. B. Liên kết cộng hóa trị phân cực.
C. Tương tác van der Waals. D. Liên kết hydrogen.
(Xem giải) Câu 8. Phát biểu nào sau đây là sai khi nói về halogen và hợp chất?
A. HF có nhiệt độ sôi cao nhất trong số các hợp chất hydrogen halide.
B. Tính acid của các hydrohalic acid giảm theo thứ tự: HF > HCl > HBr > HI.
C. Cho 1 mL dung dịch AgNO3 0,1 M lần lượt vào 4 ống nghiệm chứa 1 mL các dung dịch nồng độ 0,1 M riêng biệt NaF, NaCl, NaBr, Nal thì có 3 ống nghiệm tạo ra kết tủa.
D. Tính oxi hóa của các đơn chất giảm dần theo thứ tự: F2 > Cl2 > Br2 > I2.
(Xem giải) Câu 9. Cho các phát biểu về sulfur và hợp chất:
(1) Khi tham gia phản ứng hoá học, sulfur có thể thể hiện tính oxi hoá hoặc tính khử.
(2) Sulfur dioxide là một trong các tác nhân làm ô nhiễm không khí, gây ra mưa acid.
(3) H2SO4 đặc có tính acid mạnh, tính oxi hoá mạnh và tính háo nước.
(4) Muối (NH4)2SO4 được sử dụng làm phân đạm.
(5) Khi cho dung dịch BaCl2 vào dung dịch Na2SO4 sẽ có kết tủa màu vàng xuất hiện.
(6) Sản xuất CuSO4 theo cách (I): 2Cu + O2 + 2H2SO4 → 2CuSO4 + 2H2O thì sẽ tiêu tốn acid H2SO4 ít hơn cách (II): Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O.
Số phát biểu đúng là
A. 4. B. 2. C. 3. D. 5.
(Xem giải) Câu 10. Để nghiên cứu về sự ăn mòn của kim loại, một học sinh đã thiết kế thí nghiệm như các hình dưới, trong đó bốn thanh sắt được đặt tiếp xúc với những kim loại khác nhau và đều được nhúng trong dung dịch HCl 1M.
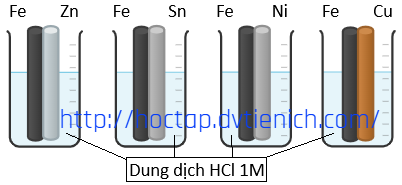
Có các phát biểu sau:
(1) Thanh sắt bị hòa tan nhanh nhất sẽ là thanh được đặt tiếp xúc với Cu.
(2) Cả 4 thí nghiệm đều xảy ra sự ăn mòn điện hóa.
(3) Có 2 thí nghiệm trong đó Fe đóng vai trò là cathode.
(4) Có 3 thí nghiệm trong đó Fe bị ăn mòn trước.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 11. Insulin là hormone có tác dụng điều tiết lượng đường trong máu. Thủy phân một đã thị phần insulin thu được heptapeptide X mạch hở. Khi thủy phân không hoàn toàn X với xúc tác đặc hiệu, thu được hỗn hợp chứa các peptide: Phe-Phe-Tyr, Pro-Lys-Thr, Tyr-Thr-Pro, Phe-Tyr-Thr. Amino acid đầu C của X có kí hiệu là
A . Thr. B. Pro. C. Tyr. D. Lys.
(Xem giải) Câu 12. Cho các hydrocarbon có cấu tạo như hình bên dưới.
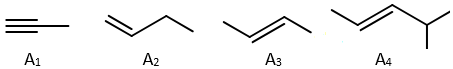
Chọn phát biểu sai.
A. Có hai chất là đồng phân của nhau.
B. Bốn chất trên đều làm mất màu nước bromine.
C. Có hai chất có đồng phân hình học là (A3) và (A4).
D. Có một chất phản ứng với dung dịch AgNO3 trong NH3 dư đun nóng tạo ra kết tủa Ag.
2. Trắc nghiệm đúng sai (6 điểm). Thí sinh trả lời từ câu 13 đến câu 18. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh ghi Đúng (Đ) hoặc Sai (S).
(Xem giải) Câu 13. Glutamic acid là một α-amino acid tự nhiên, có trong nhiều loại thực phẩm, có công thức HOOCCH2CH2CH(NH2)COOH. Từ glutamic acid có thể điều chế monosodium glutamate (MSG), là một chất điều vị phổ biến được sử dụng để tăng cường hương vị của thực phẩm, đó là mì chính (bột ngọt). MSG có khả năng làm tăng cường vị umami, một trong năm vị cơ bản (cùng với ngọt, chua, đắng và mặn). MSG có công thức là HOOCCH2CH2CH(NH2)COONa.
a) Glutamic acid có tính lưỡng tính.
b) Glutamic acid ở điều kiện thường là chất rắn, tan tốt trong nước.
c) Trong điện trường ở pH = 6,0 thì glutamic acid sẽ có xu hướng dịch chuyển về phía cực âm do nhóm amino bị proton hóa tạo thành ion dương.
d) Để tách MSG từ một hỗn hợp thực phẩm, người ta có thể dùng phương pháp kết tinh lại từ dung dịch nước bằng cách hạ thấp nhiệt độ. Biết độ tan trong nước của monosodium glutamate ở 60°C là 112 gam/100gam nước; ở 25°C là 74 gam/100 gam nước thì khối lượng tinh thể HOOCCH2CH2CH(NH2)COONa.H2O kết tinh khi làm nguội 1,0 tấn dung dịch monosodium glutamate bão hòa ở 60°C xuống 25°C là khoảng 215 kg.
(Xem giải) Câu 14. Bộ phận quan trọng nhất của máy tạo nhịp tim là một hệ pin điện hóa lithium – iodine (gồm hai cặp oxi hóa khử Li+/Li và I2/2I-). Hai điện cực được đặt vào tim, phát sinh dòng điện nhỏ kích thích tim đập ổn định. Cho biết: E°Li+/Li = -3,04V; E°I2/2I- = +0,54V; q = I.t = ne.F, trong đó q là điện lượng (C), I là cường độ dòng điện (A), t là thời gian (giây), 1 năm = 365 ngày, F = 96485 C/mol; nguyên tử khối của Li bằng 6,9.
a) Sức điện động chuẩn của pin Epin = +3,58V.
b) Khi pin hoạt động điện cực lithium đóng vai trò là anode.
c) Tại anode xảy ra quá trình khử.
d) Nếu pin tạo ra một dòng điện ổn định bằng I = 2,5.10^-5 A thì một pin được chế tạo bởi 0,50 gam lithium có thể hoạt động tối đa trong thời gian 6 năm.
(Xem giải) Câu 15. Thuốc chữa ghẻ lở, tróc vảy hoặc côn trùng cắn DEP (chứa thành phần diethyl phthalate) được sản xuất từ nguồn nguyên liệu đầu là naphthalene và ethyl acohol theo sơ đồ các quá trình chuyển hoá, kèm hiệu suất như sau:
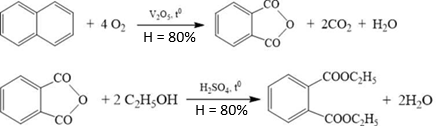
a) Diethyl phthalate là diester.
b) Diethyl phthalate có ba liên kết π trong phân tử.
c) Cho 1 mol diethyl phthalate tác dụng hết 2 mol NaOH thu được 1 mol alcohol và 2 mol muối.
d) Để sản xuất được 10 triệu hộp DEP (quy cách 10 gam/hộp, trong đó hoạt chất diethyl phthalate chiếm 88,8% về khối lượng) cần lượng tối thiểu x tấn naphthalene và y tấn ethyl alcohol. Tổng giá trị (x + y) bằng 126.
(Xem giải) Câu 16. PMMA (poly(methyl methacrylate)) là một nhựa nhiệt dẻo trong suốt thường được sử dụng ở dạng tấm, miếng như một vật liệu nhẹ, khó bể vỡ và có thể được dùng để thay thế cho kính và thủy tinh. PMMA được điều chế theo 2 giai đoạn:
– Giai đoạn 1: Methyl alcohol tác dụng với methacrylic acid tạo thành methyl methacrylate.
– Giai đoạn 2: Trùng hợp methyl methacrylate tạo thành PMMA.
a) Công thức của methyl methacrylate là CH2=C(CH3)COOCH3.
b) Xúc tác sử dụng trong giai đoạn 1 là dung dịch H2SO4 loãng.
c) Thủy phân hoàn toàn methyl methacrylate trong môi trường NaOH thu được một muối và một aldehyde.
d) Để sản xuất m tấm kính có chiều dài 20 cm, chiều rộng 15 cm và độ dày 1 cm (khối lượng riêng của tấm kính là D = 1,2 g/cm³) người ta cần tối thiểu 348,3 kg methacrylic acid. Biết trong mỗi tấm kính khối lượng PMMA chiếm 90% và hiệu suất phản ứng của toàn bộ quá trình tính theo methacrylic acid là 80%. Giá trị của m ở trên là 1000.
(Xem giải) Câu 17. Nước ép chanh chứa khoảng 5% (khoảng 0,3 mol/L) citric acid, điều này giúp nước chanh có vị chua và độ pH của nước chanh trong khoảng từ 2 – 3. Citric acid có cấu tạo là:
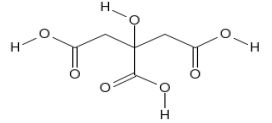
a) Tổng số nhóm chức có trong phân tử citric acid là 3.
b) Công thức phân tử của citric acid là C6H10O7.
c) Phần trăm về khối lượng của nguyên tố C trong citric acid là 37,5%.
d) Giá trị pH của nước ép chanh nói trên thấp hơn dung dịch HCl cùng nồng độ 0,3 mol/L.
(Xem giải) Câu 18. Cellulose là một loại polysaccharide, được hình thành từ nhiều đơn vị β-glucose liên kết với nhau. Đặc trưng của cellulose là cấu trúc mạch kéo dài, trong đó các đơn vị glucose nối tiếp nhau bằng liên kết glycoside.
a) Phân tử cellulose chứa liên kết β-1,4-glycoside và liên kết β-1,6-glycoside.
b) Nhờ tính chất khó phân hủy trong môi trường tự nhiên, cellulose được sử dụng trong sản xuất các sản phẩm bao bì nhựa phân hủy sinh học, nhằm giảm thiểu tác động môi trường.
c) Trong mỗi đơn vị β-glucose của cellulose có chứa 3 nhóm OH.
d) Để sản xuất 2,376 tấn thuốc súng không khói (cellulose trinitrate) từ cellulose ở trên thì cần 1,62 tấn cellulose và khoảng 1961 L dung dịch HNO3 63% (D = 1,53 g/cm³) biết sự hao hụt của phản ứng là 20%.
Phần 2: Tự luận
Câu 1. (2,0 điểm)
(Xem giải) 1.1. Quặng pyrite thường dùng trong sản xuất gang và điều chế H2SO4 trong công nghiệp. Thành phần chính của quặng pyrite là FeS2. Biết trong tự nhiên, Fe và S có các đồng vị tương ứng với tỉ lệ phần trăm số nguyên tử theo bảng cho dưới đây.
| Đồng vị | 54Fe | 56Fe | 57Fe | 58Fe | 32S | 33S | 34S | 36S |
| Tỉ lệ % | 5,8 | 91,7 | 2,2 | 0,3 | 94,93 | 0,76 | 4,29 | 0,02 |
a) Tính nguyên tử khối trung bình của Fe và S.
b) Tính phần trăm về khối lượng của đồng vị 56Fe trong FeS2. (Làm tròn đến hàng phần trăm).
(Xem giải) 1.2. Dầu thô thường bị nhiễm tạp chất là khí hydrogen sulfide. Khí này được loại bỏ khỏi dầu thô bằng quá trình Claus gồm hai bước
(1) 2H2S(g) + 3O2(g) → 2SO2(g) + 2H2O(l)
(2) 2H2S(g) + SO2(g) → 3S(s) + 2H2O(l)
Cho biết biến thiên enthalpy tạo thành chuẩn, ![]() (kJ/mol) của các chất như sau:
(kJ/mol) của các chất như sau:
| Chất | H2S(g) | SO2(g) | H2O(l) |
| -20,6 | -296,8 | -285,8 |
a) Tính biến thiên enthalpy cho phản ứng (1) và (2). (Làm tròn kết quả đến hàng đơn vị)
b) Tổng biến thiên enthalpy của quá trình Claus khi thu được 60 kg sulfur là x.10³ kJ. Xác định x. (Làm tròn kết quả đến hàng đơn vị)
c) Hãy xác định xem cần phải làm lạnh hay làm nóng bình phản ứng để giữ nhiệt độ không đổi khi thực hiện quá trình Claus.
Câu 2. (2,0 điểm)
(Xem giải) 2.1. Ammonia đóng vai trò quan trọng trong sản xuất phân bón. Trong công nghiệp, ammonia được sản xuất bằng quá trình Haber theo phản ứng:
N2(g) + 3H2(g) ⇋ 2NH3(g) (1)
Nghiên cứu về hiệu suất tổng hợp NH3 của phản ứng trên trong các điều kiện về nhiệt độ và áp suất khác nhau được biểu diễn theo đồ thị sau.
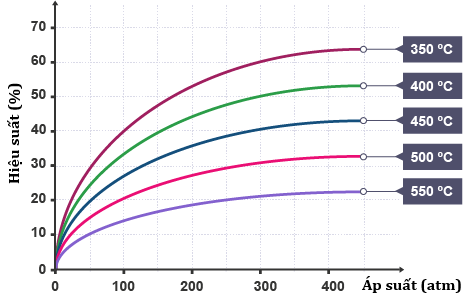
a) Dựa vào đồ thị, hãy cho biết và giải thích các trường hợp sau:
(i) Phản ứng (1) là phản ứng tỏa nhiệt hay thu nhiệt?
(ii) Hằng số cân bằng Kc của phản ứng (1) ở nhiệt độ 400°C so với ở nhiệt độ 500°C là nhỏ hơn hay lớn hơn?
b) Xác định chiều chuyển dịch của cân bằng (1) và giải thích khi thực hiện các tác động sau:
(i) tăng áp suất;
(ii) tăng nhiệt độ.
(Xem giải) 2.2. Hình vẽ bên mô tả thí nghiệm điều chế khí C.
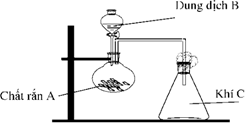
Hãy xác định 4 trường hợp tương ứng với chất rắn A, dung dịch B để thu được 4 khí C khác nhau (nặng hơn không khí) phù hợp với thí nghiệm trên. Viết phương trình hóa học cho từng trường hợp.
Câu 3. (2,0 điểm)
(Xem giải) 3.1. Trong công nghiệp, nhôm được sản xuất từ quặng bauxite (có thành phần chính là Al2O3.2H2O) theo hai giai đoạn:
– Giai đoạn 1: Tinh chế quặng bauxite (thường lẫn tạp chất Fe2O3 và SiO2) để thu được Al2O3.
– Giai đoạn 2: Điện phân nóng chảy Al2O3 có xúc tác cryolite. Ở anode sinh ra khí O2, tại đó, khí O2 tạo thành ở nhiệt độ cao đốt cháy dần anode than chì thành CO và CO2.
a) Hãy nêu cách tinh chế quặng bauxite để loại bỏ các tạp chất Fe2O3 và SiO2. Viết phương trình hóa học minh họa.
b) Tính khối lượng Al2O3.2H2O cần dùng (theo tấn) để sản xuất được 1,0 tấn Al. Biết hiệu suất đạt 98%. (Làm tròn kết quả đến hàng phần mười).
c) Tính khối lượng anode than chì (theo tấn) tối thiểu cần tiêu tốn để sản xuất được 1,0 tấn Al. Biết khí thoát ra chỉ có CO và CO2 với tỉ lệ mol là 1 : 1. (Làm tròn kết quả đến hàng phần trăm).
(Xem giải) 3.2. Một gói làm nóng thức ăn (FRH) được sử dụng trong quân đội chứa 8 gam hỗn hợp (Mg 90%, Fe 4%, NaCl 6% về khối lượng), khi tiếp xúc với nước sẽ xảy ra phản ứng Mg(s) + 2H2O(l) → Mg(OH)2(s) + 2H2(g). Phản ứng này tỏa ra nhiều nhiệt và làm nóng phần thức ăn đi kèm.
a) Cho biết vai trò của các thành phần và viết các quá trình oxi hóa – khử xảy ra khi sử dụng gói FRH.
b) Nếu sử dụng gói FRH trên để làm nóng nước từ 25°C lên 100°C, thì lượng nước tối đa (theo mL) được làm nóng là bao nhiêu? (Làm tròn kết quả đến hàng đơn vị).
Cho biết:
– Ethalpy tạo thành chuẩn (kJ/mol) của Mg(OH)2(s) và H2O(l) lần lượt là –928,4 và –285,8.
– Nhiệt dung riêng của nước, C = 4,2 J/g.°C; Khối lượng riêng của nước là D = 1 g/cm³.
– Phần nước được làm nóng chỉ nhận được tối đa 50% lượng nhiệt tỏa ra.
– Lượng nhiệt mà nước nhận được để thay đổi Δt (°C) được tính theo công thức: Q = m.C.Δt
Câu 4. (2,0 điểm)
(Xem giải) 4.1. Các aldehyde và ketone có nhóm methyl cạnh nhóm carbonyl (CH3CO-) tham gia được phản ứng tạo iodoform. Một nhóm học sinh dự đoán “Có thể nhận biết trực tiếp acetone trong các ống nghiệm riêng biệt chứa acetone, ethanol và formaldehyde bằng phản ứng tạo iodoform”. Từ đó học sinh tiến hành thí nghiệm để kiểm chứng dự đoán trên như sau:
• Bước 1: Chuẩn bị ba ống nghiệm sạch, đánh số rồi thêm vào ống nghiệm 1 khoảng 0,5 mL acetone. Ống nghiệm 2 thêm 0,5 mL ethanol nguyên chất. Ống nghiệm 3 thêm 0,5 mL dung dịch formalin.
• Bước 2: Tiếp tục cho vào ba ống nghiệm, mỗi ống nghiệm khoảng 2 mL dung dịch NaOH 10% và 2 mL dung dịch I2/KI.
• Bước 3: Lắc ống nghiệm, hơ nhẹ ống nghiệm trên đèn cồn hoặc đặt vào cốc nước nóng, sau đó làm nguội.
Hiện tượng quan sát được trong các ống nghiệm: Ống 1 và 2 xuất hiện kết tủa vàng nhạt. Ống 3 không thay đổi.
a) Viết phương trình hóa học của phản ứng tạo iodoform xảy ra với acetone.
b) Khi thấy ở ống nghiệm 2 xuất hiện kết tủa vàng nhạt, các bạn học sinh đã tiến hành lại thí nghiệm một cách cẩn thận thêm hai lần, nhưng kết quả thu được vẫn giống như lần đầu tiên. Hãy giải thích hiện tượng đã quan sát được ở ống nghiệm số 2 (không cần viết phương trình) và đưa ra kết luận về dự đoán của nhóm học sinh.
(Xem giải) 4.2. Phản ứng halogen hóa alkane có nhiều ứng dụng trong thực tiễn. So với phản ứng monochlorine hóa, phản ứng monobromine hóa có sự chọn lọc rất cao. Các câu hỏi sau đây chỉ xét đến sự tạo thành của sản phẩm monohalogen hóa, là sự thay thế của một nguyên tử hydrogen bằng một nguyên tử halogen. Điều kiện hν là ánh sáng khuếch tán.
a) Xác định sản phẩm chính và giải thích sự tạo thành sản phẩm chính bằng cơ chế phản ứng.

b) Sản phẩm của phản ứng dưới đây được sử dụng trong quá trình sản xuất dược phẩm. Xác định số lượng đồng phân cấu tạo của dẫn xuất monobromine có thể tạo ra của phản ứng này. Vẽ công thức cấu tạo của các đồng phân đó.



Bình luận