[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Nghệ An
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Thời gian làm bài: 150 phút
⇒ Bảng đáp án phần trắc nghiệm:
| Phần 1 | Phần 2 | 13 | 14 | 15 | 16 | ||
| 1C | 2C | 3A | (a) | S | S | Đ | Đ |
| 4D | 5B | 6A | (b) | S | Đ | Đ | S |
| 7B | 8A | 9A | (c) | Đ | S | S | Đ |
| 10D | 11C | 12C | (d) | Đ | Đ | Đ | Đ |
| Phần 3 | Câu 17 | 960 | Câu 18 | 1375 |
A. PHẦN TRẮC NGHIỆM (8,0 điểm)
PHẦN I (3,0 điểm): Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1: Sử dụng vôi sữa là phương pháp phổ biến để xử lý khí thải SO2. Vôi sữa hấp thụ 90% khí SO2 theo phương trình hóa học: Ca(OH)2 + SO2 → CaSO3 + H2O.
CaSO3 bị oxi hóa hoàn toàn thành CaSO4 dưới tác dụng của O2. Sau đó, CaSO4 được lọc tách, làm sạch, nung khô và thu hồi dưới dạng thạch cao thương phẩm (2CaSO4.H2O) với hiệu suất 80%. Một nhà máy trong một ngày thải ra 2000 m³ (đkc) khí thải chứa 1% về thể tích là SO2. Bằng phương pháp trên, tính khối lượng (kg) 2CaSO4.H2O thu được trong 30 ngày.
A. 7018,9. B. 2369,9. C. 2526,8. D. 2807,5.
(Xem giải) Câu 2: X là một trong những chất tạo ra mùi tanh của cá, đặc biệt là cá mè. Phân tích thành phần nguyên tố chất X thu được kết quả như sau: 61,02% C; 15,25% H; 23,73% N về khối lượng. Bằng phương pháp khác, xác định được phân tử X có cấu trúc đối xứng cao. Cho các nhận định sau:
(a) Công thức cấu tạo thu gọn của X là (CH3)3N.
(b) Phổ khối lượng của X có tín hiệu m/z lớn nhất bằng 59.
(c) Giữa các phân tử X có liên kết hydrogen bền.
(d) Phổ IR của X không có tín hiệu đặc trưng của liên kết N-H (có số sóng từ 3500 – 3300 cm-1).
Số nhận định đúng là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 3: X là ester tạo nên mùi thơm của hoa nhài. Xà phòng hóa hoàn toàn chất X bằng dung dịch NaOH thu được benzyl alcohol và sodium acetate. Phát biểu nào sau đây đúng?
A. Trong phân tử X có một vòng benzene. B. X là ester no, đơn chức, mạch hở.
C. X tác dụng với NaOH theo tỉ lệ 1 : 2. D. Công thức phân tử của X là C9H12O2.
(Xem giải) Câu 4: Phát biểu nào dưới đây sai?
A. Ở điều kiện thường, mỗi phân tử halogen đều có 2 nguyên tử.
B. Trong tự nhiên, các halogen tồn tại ở dạng hợp chất.
C. Tính chất hoá học cơ bản của các đơn chất halogen là tính oxi hoá.
D. Trong hợp chất, các halogen chỉ có số oxi hoá −1.
(Xem giải) Câu 5: Từ tinh dầu tràm, người ta phân lập được α-terpineol có công thức cấu tạo như hình dưới:
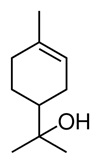
Phát biểu nào sau đây không đúng?
A. α-terpineol là alcohol bậc 3.
B. α-terpineol là hợp chất thơm.
C. α-terpineol tác dụng được với dung dịch Br2.
D. Công thức phân tử của α-terpineol là C10H18O.
(Xem giải) Câu 6: Trong bình phản ứng (có dung tích không đổi), ban đầu chứa chất X và chất Y với nồng độ mol/L bằng nhau. Xảy ra phản ứng thuận nghịch: X(g) ⇋ 2Y(g) (biết biểu thức tính tốc độ phản ứng tuân theo định luật tác dụng khối lượng). Tại thời điểm cân bằng, nồng độ chất X giảm đi một nửa so với ban đầu. Ở trạng thái cân bằng, nhận định nào sau đây đúng?
A. Nồng độ chất Y gấp 4 lần nồng độ chất X.
B. Tổng số mol hỗn hợp các chất phản ứng tăng 2 lần so với thời điểm ban đầu.
C. Tốc độ phản ứng nghịch gấp 4 lần tốc độ phản ứng thuận.
D. Tốc độ phản ứng nghịch tăng 2 lần so với thời điểm ban đầu.
(Xem giải) Câu 7: Cho sơ đồ xen phủ orbital nguyên tử như hình vẽ dưới đây:
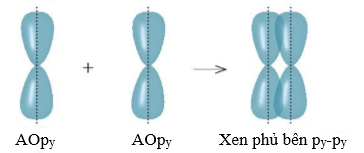
Đây là sự tạo thành liên kết nào trong phân tử CH2=CH2?
A. Liên kết σ giữa nguyên tử C với nguyên tử C.
B. Liên kết π giữa nguyên tử C với nguyên tử C.
C. Liên kết σ giữa nguyên tử C với nguyên tử H.
D. Liên kết π giữa nguyên tử C với nguyên tử H.
(Xem giải) Câu 8: Tiến hành thí nghiệm phản ứng giữa cellulose và nitric acid như sau:
– Bước 1: Cho 5 mL dung dịch HNO3 vào cốc thủy tinh ngâm trong chậu nước đá. Thêm từ từ 10 mL dung dịch H2SO4 đặc vào cốc và khuấy đều. Sau đó, lấy cốc ra khỏi chậu nước đá, thêm một nhúm bông vào cốc và dùng đũa thủy tinh ấn bông ngập trong dung dịch.
– Bước 2: Ngâm cốc trong chậu nước nóng khoảng 10 phút. Để nguội, lấy sản phẩm thu được ra khỏi cốc, rửa nhiều lần với nước lạnh (đến khi nước rửa không làm đổi màu quỳ tím), sau đó rửa lại bằng dung dịch NaHCO3 loãng.
– Bước 3: Cho sản phẩm vào giữa 2 miếng giấy lọc và ép để hút nước, làm khô tự nhiên.
Một học sinh đưa ra các nhận định về thí nghiệm trên
(a) Dung dịch NaHCO3 có vai trò trung hòa hoàn toàn acid còn lại trong sản phẩm.
(b) H2SO4 đặc đóng vài trò là chất xúc tác.
(c) Ở bước 3, có thể thay việc làm khô tự nhiên bằng cách sấy sản phẩm ở nhiệt độ cao.
(d) Phần còn lại trong cốc sau khi tách sản phẩm ở bước 2 được trung hòa và tách ion sulfate thì thu được dung dịch có phản ứng với thuốc thử Tollens.
Số nhận định đúng là
A. 3. B. 4. C. 1. D. 2.
(Xem giải) Câu 9: Formic acid là một chất lỏng, có thể bị phân hủy theo phản ứng:
HCOOH(l) → CO(g) + H2O(g) ![]() = 72,7 kJ
= 72,7 kJ
Biết nhiệt tạo thành chuẩn của CO(g) và H2O(g) lần lượt là -110,5 kJ/mol và -241,8 kJ/mol. Nhiệt tạo thành chuẩn của HCOOH(l) là
A. -425,0 kJ/mol. B. 279,6 kJ/mol. C. -279,6 kJ/mol. D. 425,0 kJ/mol.
(Xem giải) Câu 10: Biết những chất lỏng có điểm chớp cháy thấp hơn 37,8°C là chất lỏng dễ cháy. Cho bảng số liệu về điểm chớp cháy của một số chất lỏng sau:
| Chất | Pentane | Ethanol | Formic acid | Ethylene glycol |
| Điểm chớp cháy (°C) | -49 | 13 | 50 | 111 |
Nhận định nào sau đây không đúng?
A. Trong số các chất trên, pentane có khả năng gây cháy, nổ cao nhất.
B. Trong số các chất trên, ethylene glycol có khả năng gây cháy, nổ thấp nhất.
C. Pentane có điểm chớp cháy thấp hơn ethanol nên dễ bốc cháy hơn.
D. Trong số các chất trên, có một chất lỏng dễ cháy.
(Xem giải) Câu 11: Trong nông nghiệp, nếu bón nhiều phân superphosphate đơn sẽ làm đất chai cứng. Chất nào sau đây là nguyên nhân chính gây nên hiện tượng chai cứng đất
A. CaHPO4. B. Ca(H2PO4)2. C. CaSO4. D. Ca3(PO4)2.
(Xem giải) Câu 12: Cho vào ống nghiệm khoảng 2 mL dung dịch I2 bão hòa trong KI và 2 mL dung dịch NaOH 10% vào ống nghiệm. Thêm tiếp 0,5 mL dung dịch CH3CHO 10%. Lắc nhẹ và đặt ống nghiệm vào cốc nước nóng, sau một thời gian xuất hiện kết tủa màu vàng. Công thức của chất kết tủa trên là
A. CH3COONa. B. CH3I. C. CHI3. D. KI3
PHẦN II (4,0 điểm). Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, học sinh chọn đúng hoặc sai.
(Xem giải) Câu 13: Trong bình có dung tích không đổi 1 Lít, ban đầu nạp vào bình hỗn hợp gồm 0,9 mol chất A và 0,6 mol chất B. Giữ nhiệt độ ổn định ở 760°C, xảy ra cân bằng hóa học:
aA(g) + bB(g) ⇋ cC(g) + dD(g) (a, b, c, d là các hệ số nguyên, tối giản của phản ứng; biểu thức tính tốc độ phản ứng tuân theo định luật tác dụng khối lượng)
Sau 6 phút, phản ứng đạt tới trạng thái cân bằng. Sự phụ thuộc nồng độ mol/L của các chất trong bình phản ứng vào thời gian (phút) được biểu diễn bằng đồ thị sau:
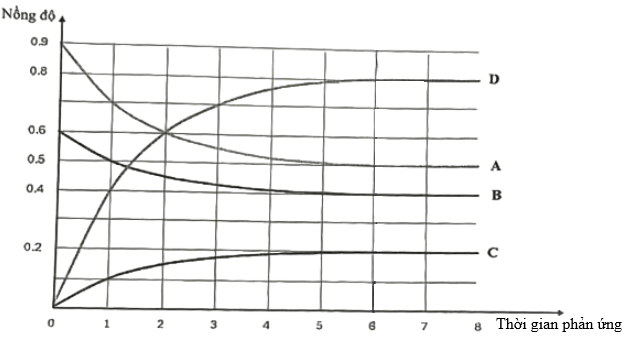
a) Trước khi đạt tới trạng thái cân bằng, tốc độ phản ứng nghịch giảm dần theo thời gian.
b) Ở trạng thái cân bằng, nếu tăng nhiệt độ của bình phản ứng thì số mol khí trong bình tăng lên, chứng tỏ rằng phản ứng thuận là phản ứng tỏa nhiệt.
c) Hằng số cân bằng của phản ứng ở 760°C là 0,8192.
d) Tốc độ trung bình của phản ứng thuận trong khoảng thời gian từ 0 đến 6 phút là 1/1800 mol/Ls
(Xem giải) Câu 14: Benzyl butyrate là một chất có mùi của quả Sơ ri. Nó là một chất lỏng không màu, tan tốt trong ethyl alcohol và ether, không tan trong nước. Có thể tách benzyl butyrate từ thực vật bằng phương pháp chưng cất lôi cuốn hơi nước rồi ngưng tụ sẽ thu được hỗn hợp dạng nhũ tương (benzyl butyrate bị phân tán trong nước).
a) Công thức phân tử của benzyl butyrate là C11H12O2.
b) Phổ IR của benzyl butyrate không có tín hiệu của nhóm hydroxyl (-OH).
c) Để tách benzyl butyrate từ hỗn hợp dạng nhũ tương trên, người ta dùng phương pháp chiết bởi dung môi ethyl alcohol.
d) Khi cho benzyl butyrate tác dụng hoàn toàn với dung dịch NaOH (dư 20% so với lượng phản ứng), sau đó cô cạn dung dịch thì được chất rắn có khối lượng gấp 59/89 lần khối lượng benzyl butyrate ban đầu.
(Xem giải) Câu 15: Trong công nghiệp, một trong những nguồn chính để sản xuất iodine là rong biển. Người ta phơi khô rong biển, đốt thành tro, ngâm tro trong nước để hòa tan hết các muối. Gạn lấy dung dịch, đem cô cạn cho đến khi các muối kết tinh, làm lạnh dung dịch xuống 20°C, phần lớn muối sodium chloride và muối sodium sulfate lắng xuống, còn muối iodide ở lại trong dung dịch. Cho dung dịch này tác dụng với một lượng khí chlorine (không lấy dư) theo phương trình hóa học:
2Nal(aq) + Cl2(g) → 2NaCl(aq) + I2(aq)
Sau đó chưng cất để được iodine.
a) Phản ứng trên chứng tỏ tính oxi hóa của chlorine mạnh hơn iodine.
b) Ở 20°C, độ tan trong nước của sodium iodide lớn hơn độ tan của sodium chloride.
c) Trong thực tế, để tăng hiệu suất phản ứng, người ta thay khí chlorine bằng khí florine.
d) Nếu dùng dư chlorine sẽ làm thất thoát iodine.
(Xem giải) Câu 16: α-linoleic acid (ALA) và γ-linoleic acid (GLA) thuộc nhóm omega-n (n là số thứ tự vị trí của liên kết đôi đầu tiên tính từ đầu nhóm methyl) là những acid béo có lợi cho sức khỏe, ngăn ngừa các bệnh về tim mạch. α-linoleic acid và γ-linoleic acid có công thức cấu tạo như hình dưới đây:
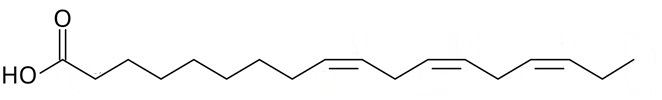 (α-linoleic)
(α-linoleic)
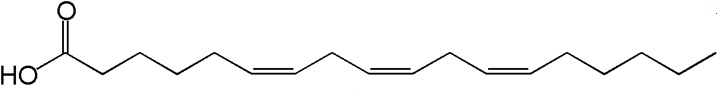 (γ-linoleic)
(γ-linoleic)
a) α-linoleic acid và γ-linoleic acid là đồng phân của nhau.
b) α-linoleic acid thuộc loại omega-6, γ-linoleic acid thuộc loại omega-3.
c) Hydrogen hóa hoàn toàn a-linoleic acid và γ-linoleic acid đều thu được stearic acid.
d) Thủy phân một triglyceride X thu được hỗn hợp glycerol, α-linoleic acid và γ-linoleic acid. Công thức phân tử của X là C57H92O6.
PHẦN III (1,0 điểm). Câu trắc nghiệm yêu cầu trả lời ngắn.
(Xem giải) Câu 17: Trong nước thải của một nhà máy, hàm lượng ion amonium là 192 mg/L. Để xử lí ion amonium về nồng độ cho phép là không quá 5 mg/L (theo quy chuẩn Việt Nam), người ta tiến hành xử lí nước thải theo phương pháp Anammox (Anaerobic Ammonium Oxidation). Phương pháp này gồm 2 giai đoạn:
• Giai đoạn 1: Oxi hóa ion amonium thành ion nitrite theo phản ứng sau: (HCO3- dùng dư 10% so với lượng cần thiết): 2NH4+ + 3O2 + 4HCO3- → 2NO2- + 4CO2 + 6H2O
• Giai đoạn 2: Diễn ra trong điều kiện yếm khí, ion amonium sẽ được oxi hoá trực tiếp thành khí nitrogen theo phản ứng: NH4+ + NO2- → N2 + 2H2O
Biết các phản ứng xảy ra hoàn toàn. Tính khối lượng (kg) NaHCO3 tối thiểu cần dùng để xử lí 1000 m³ nước thải trên (làm tròn kết quả đến hàng đơn vị).
(Xem giải) Câu 18: Một loại chất béo có chứa tristearin, tripalmitin, stearic acid, palmitic acid. Thành phần % về khối lượng và hiệu suất phản ứng của các chất khi xà phòng hóa chất béo này bằng dung dịch NaOH như sau:
| Thành phần | Tristearin | Tripalmitin | Stearic acid | Palmitic acid | Tạp chất |
| % khối lượng | 53,4% | 32,24% | 1,136% | 1,536% | 11,688% |
| Hiệu suất | 90% | 88% | 100% | 100% |
(Tạp chất không tạo ra muối của acid béo)
Một nhà máy cần sản xuất 15000 bánh xà phòng loại 100 gam (chứa 72% khối lượng muối sodium của các acid béo) bằng cách xà phòng hóa x kg chất béo nói trên với dung dịch NaOH. Biết trong quá trình đóng gói, lượng xà phòng bị hao hụt 4%. Tính giá trị của x (làm tròn kết quả đến hàng đơn vị).
B. TỰ LUẬN (12 điểm)
Câu I (3,0 điểm)
(Xem giải) I.1. Năng lượng liên kết và nhiệt độ sôi của các hydrogen halide như bảng sau:
| Tính chất | HF | HCl | HBr | HI |
| Năng lượng liên kết H-X (kJ/mol) | 565 | 431 | 364 | 297 |
| Nhiệt độ sôi (°C) | +19,5 | -84,9 | -66,7 | -35,8 |
a) Nêu và giải thích quy luật biến đổi năng lượng liên kết H-X trong dãy: HF, HCI, HBr, HI.
b) Giải thích quy luật biến đổi nhiệt độ sôi của HCl, HBr, HI và giải thích sự bất thường về nhiệt độ sôi của HF so với các hydrogen halide còn lại.
(Xem giải) I.2. Dinitrogen tetroxide (không màu) bị phân huỷ thành nitrogen dioxide (màu nâu đỏ) theo phản ứng: N2O4(g) ⇋ 2NO2(g)
Ban đầu, trong bình phản ứng dung tích không đổi 1 Lít có chứa 0,6 mol N2O4. Thời gian đạt tới trạng thái cân bằng và nồng độ N2O4 ở các nhiệt độ khác nhau như sau:
| Nhiệt độ | Thời gian đạt tới trạng thái cân bằng (phút) | Nồng độ N2O4 ở trạng thái cân bằng (mol/L) |
| 0°C | 18 | 0,32 |
| 20°C | 8 | 0,25 |
a) Khi tăng nhiệt độ, màu sắc hỗn hợp khí trong bình thay đổi như thế nào? Giải thích?
b) Tính hằng số cân bằng Kc của phản ứng trên ở 20°C.
(Xem giải) I.3. Một nhà máy nhiệt điện khí có sản lượng điện 10^6 kWh/ngày (1 kWh = 3600 kJ) đã sử dụng khí thiên nhiên hóa lỏng LNG (chứa 94% CH4, 6% C2H6 về thể tích) làm nhiên liệu. Các nhiên liệu bị đốt cháy hoàn toàn tạo ra sản phẩm khí (biết 64% nhiệt lượng tỏa ra của quá trình đốt cháy được chuyển hóa thành điện năng). Tính khối lượng khí CO2 mà nhà máy này thải ra trong 1 ngày
Biết nhiệt bay hơi của H2O(l) ở 25°C và 1 bar là 44 kJ/mol; CH4 và C2H6 cháy theo các phương trình nhiệt hóa học:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ![]() = -893 kJ
= -893 kJ
C2H6(g) + 3,5O2(g) → 2CO2(g) + 3H2O(l) ![]() = -1560 kJ
= -1560 kJ
Câu II (3,0 điểm)
(Xem giải) II.1. Sulfur dioxide là một trong các tác nhân gây mưa acid. Nó là chất phát thải chủ yếu từ các quá trình đốt cháy nhiên liệu như than đá, xăng, dầu,… Theo Quy chuẩn kỹ thuật quốc gia về chất lượng không khí xung quanh (QCVN 05:2023/BTNMT) thì nồng độ tối đa cho phép với SO2 ở điều kiện chuẩn là 350 μg/m³ (biết 1 μg = 10^-6 gam). Một nhà máy nhiệt điện khi vận hành đã đốt hết 500 tấn than đá (chứa 0,48% khối lượng sulfur, phần còn lại không chứa hợp chất của sulfur) trong 1 ngày.
a) Tính khối lượng SO2 mà nhà máy trên phát thải vào không khí trong 1 ngày.
b) Khi phân tích 100 Lít không khí ở khu vực nhà máy, người ta thấy có chứa lượng SO2 là 0,032 mg. Hỏi không khí ở khu vực trên có bị ô nhiễm không? Giải thích.
c) Khí SO2 thoát ra từ nhà máy trên đi vào khí quyển bị oxi hóa và gặp nước mưa chuyển hóa thành sulfuric acid. Biết rằng trong một tháng (30 ngày) có 1,5% lượng SO2 chuyển hóa thành sulfuric acid có nồng độ 1,2.10^-5 M trong nước mưa. Tính thể tích nước mưa đã bị nhiễm sulfuric acid.
(Xem giải) II.2. Phân bón hữu cơ có thành phần là chất hữu cơ tự nhiên, ưu điểm của nó là chứa đầy đủ các nguyên tố dinh dưỡng đa, trung và vi lượng. Do có nhiều ưu điểm nên phân bón hữu cơ được sử dụng rộng rãi trong nông nghiệp hiện nay.
Em hãy:
a) Giải thích tại sao cây trong rừng không được bón phân mà vẫn phát triển tốt.
b) Cho biết phân bón hữu cơ gồm những loại nào?
(Xem giải) II.3. Iodine phản ứng với potassium hydroxide khi đun nóng tương tự chlorine. Tiến hành thí nghiệm sau:
– Bước 1: Lấy 20 gam dung dịch KOH 42% (đặc) cho vào bình nón, đặt bình trên lưới amiang rồi đun nóng, vừa đun vừa thêm thật từ từ tinh thể iodine vào khuấy thật kỹ khi xuất hiện màu vàng rơm nhạt thì ngừng thêm iodine.
– Bước 2: Để nguội rồi ngâm bình nón trong nước đá trong vòng 15–20 phút để kết tinh sản phẩm. Lọc hỗn hợp trên phễu lọc để tách chất kết tinh, phần nước lọc đem cô cạn cẩn thận thu được chất rắn khan chứa tinh thể potassium iodide có lẫn một lượng nhỏ potassium iodate.
a) Viết phương trình hóa học của phản ứng xảy ra.
b) Biết các phản ứng xảy ra hoàn toàn, 99% potassium iodate và 2% potassium iodide bị kết tinh và được giữ lại trên phễu lọc. Tính độ tinh khiết (thành phần % khối lượng) của potassium iodide trong chất rắn thu được.
Câu III (3,5 điểm)
(Xem giải) III.1. Từ một loại tinh dầu, người ta tách được chất hữu cơ A chứa 76,92% C, 12,82% H và 10,26% O về khối lượng. Trong phổ MS của A xuất hiện một đỉnh có giá trị m/z cực đại là 156.
a) Xác định công thức phân tử chất A.
b) Khi tiến hành hydrogen hóa hoàn toàn 5-methyl-2-isopropylphenol thu được chất A. Hãy lập luận để xác định công thức cấu tạo của chất A.
c) Đun nóng A với H2SO4 đặc trong điều kiện thích hợp, thu được hỗn hợp 2 hydrocarbon có cùng công thức phân tử là C10H18. Viết phương trình hóa học của phản ứng xảy ra (các chất hữu cơ viết dưới dạng công thức cấu tạo).
(Xem giải) III.2. Hợp chất hữu cơ B (tồn tại cấu tạo ở dạng trans) có công thức phân tử C9H8O là một chất có mùi thơm, có trong thành phần của tinh dầu quế. Chất B có phản ứng với thuốc thử Tollens và làm mất màu dung dịch Br2 trong CCl4. Oxi hóa B bằng dung dịch KMnO4 (trong sulfuric acid loãng) đun nóng, thu được benzoic acid.
a) Lập luận để xác định công thức cấu tạo của chất B.
b) Viết phương trình hóa học của các phản ứng xảy ra (các chất hữu cơ viết dưới dạng công thức cấu tạo) khi cho B tác dụng với:
– Thuốc thử Tollens.
– Dung dịch nước Br2 dư.
(Xem giải) III.3. Từ vỏ cây Salix (cây liễu), người ta phân lập được chất X có công thức phân tử C7H6O3. X là hợp chất hữu cơ tạp chức (có nhóm chức nằm ở các nguyên tử C liên tiếp nhau). X có khả năng tác dụng với dung dịch NaHCO3 tạo ra chất Y có công thức C7H5O3Na. Cho X tác dụng với (CH3CO)2O tạo ra chất Z (C9H8O4), Z cũng tác dụng được với NaHCO3. Khi cho X tác dụng với methanol (có H2SO4 đặc xúc tác) thì tạo ra chất T (C8H8O3), T không tác dụng với NaHCO3 mà chỉ tác dụng với Na2CO3. Hãy xác định công thức cấu tạo của các X, Y, Z, T và viết phương trình hóa học của các phản ứng xảy ra.
(Xem giải) III.4. Ethanol được dùng để sản xuất xăng E5 (xăng chứa 5% ethanol về thể tích) được sản xuất từ cellulose theo sơ đồ sau: Cellulose → Glucose → Ethanol (Hiệu suất lần lượt là 81% và 80%).
Để tạo ra lượng ethanol đủ sản xuất được 100000 Lít xăng E5 thì cần m tấn mùn cưa (chứa 50% cellulose, còn lại là các chất không tạo ra được ethanol). Biết khối lượng riêng của ethanol là 0,8 g/mL. Tính giá trị của m.
(Xem giải) Câu IV. (1,0 điểm)
Trong công nghiệp sản xuất sulfuric acid, người ta dùng dung dịch H2SO4 98% để hấp thụ hoàn toàn SO3 tạo ra sản phẩm là oleum. Lấy 5,0 gam oleum sinh ra ở trên pha loãng với nước cất thu được 1000 mL dung dịch H2SO4 loãng (dung dịch X). Để xác định nồng độ H2SO4 trong X, người ta tiến hành chuẩn độ như sau:
– Bước 1: Rửa sạch burette loại 25 mL bằng nước cất, tráng lại bằng dung dịch chuẩn NaOH 0,1M rồi lắp burette lên giá đỡ, cho dung dịch chuẩn NaOH 0,1M vào burette, điều chỉnh dung dịch trong burette đến vạch 0.
– Bước 2: Hút chính xác 10,0 mL dung dịch X cho vào bình tam giác 250 mL. Thêm 3 – 4 giọt phenolphthalein, lắc đều.
– Bước 3: Mở khóa burette để dung dịch NaOH được nhỏ từ từ xuống bình tam giác, lắc đều cho đến khi dung dịch chuyển từ không màu sang màu hồng bền trong khoảng 30 giây thì dừng lại, ghi thể tích dung dịch NaOH đã dùng. Kết quả của 3 lần chuẩn độ như sau:
| Lần chuẩn độ | Thể tích dung dịch NaOH đã dùng (mL) |
| 1 | 11,7 |
| 2 | 11,8 |
| 3 | 11,7 |
a) Ở bước 1, tại sao sau khi rửa sạch burette bằng nước cất lại phải tráng lại bằng dung dịch NaOH chuẩn?
b) Vì sao cho chỉ thị phenolphthalein vào bình tam giác mà không cho vào burette?
c) Tính khối lượng dung dịch H2SO4 98% cần dùng để sản xuất được 10 tấn oleum ở trên.
Câu V. (1,5 điểm)
(Xem giải) V.1. Rutin là hợp chất hữu cơ có trong nụ hoa hòe, nó có tác dụng làm giảm các chứng suy giảm tĩnh mạch, giảm cholesterol trong máu. Ngoài ra rutin còn được dùng để điều chế thuốc quercetin có tác dụng chống oxy hóa mạnh, kháng viêm, chống dị ứng, ngăn ngừa tế bào ung thư. Công thức cấu tạo của rutin (bên trái) và quercetin (bên phải) như hình dưới đây:
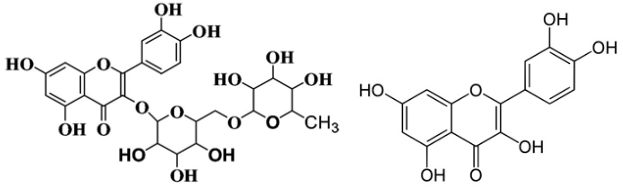
Trong môi trường acid, một phân tử rutin phản ứng với hai phân tử nước thu được sản phẩm gồm quercetin, glucose và rhamnose.
a) Xác định công thức phân tử của rhamnose và viết phương trình hóa học của phản ứng xảy ra (các chất viết dưới dạng công thức phân tử).
b) Biết hàm lượng quercetin trong một viên thuốc có khối lượng 500 mg là 96,64% về khối lượng, phần còn lại là tá dược khác. Để sản xuất 1 triệu viên thuốc trên, cần bao nhiêu tấn bột hoa hòe? (Biết hàm lượng rutin trong bột hoa hòe là 30,2%, phần còn lại không tạo ra quercetin; hiệu suất toàn bộ quá trình sản xuất đạt 80%).
(Xem giải) V.2. Thủy phân hoàn toàn 100 gam một loại chất béo X (chứa 8,86% tạp chất trơ) bằng một lượng vừa đủ dung dịch NaOH thu được sản phẩm hữu cơ gồm 8,28 gam glycerol và 93,935 gam muối của acid béo. Tính chỉ số acid của X (biết chỉ số acid của chất béo là số miligam KOH cần dùng để trung hòa acid tự do có trong 1 gam chất béo).


Bình luận