[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Sơn La
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 059-H12B năm 2024-2025
⇒ Thời gian làm bài: 180 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1C | 2C | 3D | 4A | 5D | 6A | 7D | 8D |
| 9D | 10C | 11A | 12A | 13A | 14D | 15A | 16B |
| 17B | 18C | 19D | 20A | 21D | 22C | 23D | 24A |
| 25 | 26 | 27 | 28 | 29 | 30 | |
| (a) | Đ | Đ | Đ | Đ | Đ | Đ |
| (b) | Đ | Đ | Đ | Đ | Đ | Đ |
| (c) | S | Đ | Đ | S | Đ | S |
| (d) | S | S | S | S | S | Đ |
| 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 |
| 0,11 | 72,3 | 2 | 12 | 6,48 | 250 | 32 | 7 |
I. PHẦN TRẮC NGHIỆM (10,0 điểm)
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 24. Mỗi câu hỏi thí sinh chỉ chọn một phương án
(Xem giải) Câu 1. Cho các phát biểu sau:
(a) Trong dung dịch, glycine tồn tại chủ yếu ở dạng ion lưỡng cực.
(b) Amino acid là chất rắn kết tinh, dễ tan trong nước.
(c) Phản ứng thế bromine vào vòng thơm của aniline dễ hơn benzene.
(d) Các protein dạng hình sợi dễ tan trong nước.
(e) Triolein và protein có cùng thành phần nguyên tố.
(g) Thủy phân không hoàn toàn tripeptide Ala-Gly-Ala thu được tối đa 2 dipeptide.
Số phát biểu đúng là
A. 5. B. 3. C. 4. D. 2.
(Xem giải) Câu 2. Đun nóng m gam hỗn hợp gồm a mol tetrapeptide mạch hở X và 2a mol tripeptide mạch hở Y với 100 mL dung dịch NaOH 1M (vừa đủ). Sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch, thu được 10,54 gam muối khan của các amino acid đều có một nhóm -COOH và một nhóm -NH2 trong phân tử. Giá trị của m là
A. 6,90. B. 7,26. C. 7,08. D. 6,54.
(Xem giải) Câu 3. Cho phản ứng: H2(g) + Cl2(g) → 2HCl(g). Ở điều kiện chuẩn, cứ 1 mol H2 phản ứng hết sẽ tỏa ra 184,6 kJ. Enthalpy tạo thành chuẩn của HCl(g) là
A. 184,6 kJ/mol. B. 92,3 kJ/mol. C. -184,6 kJ/mol. D. -92,3 kJ/mol.
(Xem giải) Câu 4. Cho các phát biểu sau:
(a) Tráng Sn lên Fe là phương pháp bảo vệ kim loại bằng phương pháp điện hóa.
(b) Trong quá trình điện phân, tại anode xảy ra quá trình oxi hóa.
(c) Cho mẩu nhỏ Na vào dung dịch CuSO4, thấy xuất hiện kết tủa màu đỏ.
(d) Vỏ các loài ốc, sò, hến có chứa CaCO3.
(e) Để phân biệt khí CO2 và SO2 có thể dùng dung dịch nước vôi trong.
Số phát biểu đúng là
A. 2. B. 5. C. 4. D. 3.
(Xem giải) Câu 5. Phát biểu nào sau đây sai?
A. Khi nhiệt độ tăng thì khả năng dẫn điện của kim loại giảm.
B. Trong cùng chu kì, bán kính nguyên tử kim loại lớn hơn bán kính nguyên tử phi kim.
C. Ở điều kiện thường, tính dẫn điện của Ag > Cu > Au > Al > Fe.
D. Các nguyên tử có 1 hoặc 2 hoặc 3 electron ở lớp ngoài cùng đều là kim loại.
(Xem giải) Câu 6. Dung dịch chất X hòa tan Cu(OH)2, thu được dung dịch màu xanh lam. Mặt khác, X bị thủy phân khi đun nóng trong môi trường acid. Chất X là
A. saccharose. B. amylose. C. glucose. D. fructose.
(Xem giải) Câu 7. Dãy chất nào sau đây chỉ chứa liên kết ion?
A. CO2; BaO; Na2O; NaCl. B. BaO; CaO; NaCl; H2S.
C. K2O; BaCl2; HCl; NaCl. D. KI; Li2O; BaCl2; NaF.
(Xem giải) Câu 8. Điện phân dung dịch copper (II) sulfate, nhóm học sinh đã tiến hành như sau: Nhúng hai điện cực vào cốc đựng khoảng 60 mL dung dịch CuSO4 0,5M rồi nối hai điện cực với nguồn điện để tiến hành điện phân (chú ý không để hai điện cực đã nối nguồn điện chạm vào nhau). Thời gian điện phân là 5 phút với cường độ dòng điện 10A. Quan sát hiện tượng thí nghiệm xảy ra, một học sinh đưa ra các phát biểu dưới đây, hãy cho biết phát biểu nào sai?
A. Màu xanh lam của dung dịch CuSO4 nhạt dần.
B. Kim loại màu đỏ được sinh ra bám vào cathode.
C. Có khí không màu (O2) thoát ra ở anode.
D. Thấy có khí thoát ra ở 2 điện cực.
(Xem giải) Câu 9. Cho độ tan (g/100 g nước) của một số muối trong nước ở 20°C:
| NO3- | SO42- | CO32- | |
| Be2+ | 108,00 | 39,10 | Phân huỷ |
| Mg2+ | 69,50 | 33,70 | 1,00.10-2 |
| Ca2+ | 130,95 | 0,24 | 1,30.10-3 |
| Sr2+ | 69,55 | 1,30.10-2 | 1,10.10-3 |
| Ba2+ | 9,02 | 1,04.10-5 | 5,08.10-5 |
Phát biểu nào sau đây sai?
A. Nhỏ từ từ dung dịch H2SO4 loãng vào dung dịch chứa Ba2+ và Ca2+ cùng nồng độ mol, kết tủa BaSO4 xuất hiện trước.
B. Muối nitrate của kim loại nhóm IIA có độ tan lớn hơn muối sulfate của kim loại nhóm IIA.
C. Nhỏ dung dịch Ba(NO3)2 bão hoà vào dung dịch MgSO4 bão hoà, xuất hiện kết tủa BaSO4.
D. Nhỏ dung dịch CaCO3 bão hoà vào dung dịch BaSO4 bão hoà, xuất hiện kết tủa CaSO4.
(Xem giải) Câu 10. Cho các chất sau: (1) CH3COOH, (2) CH3COOCH3, (3) C2H5OH, (4) C2H5COOH. Chiều tăng dần nhiệt độ sôi từ trái sang phải là
A. (1), (2), (3), (4). B. (3), (1), (2), (4).
C. (2), (3), (1), (4). D. (4), (3), (2), (1).
(Xem giải) Câu 11. Phân kali đỏ (chứa KCl) là một loại phân bón đa lượng phổ biến trên thị trường vì giá thành rẻ, phù hợp rất nhiều loại đất khác nhau và hàm lượng potassium cao. Phân kali đỏ thường được sản xuất từ quặng sylvinite (KCl.NaCl) bằng cách tách muối KCl ra khỏi quặng theo sơ đồ sau:
![]()
Phương pháp tách muối KCl ra khỏi quặng sylvinite là
A. kết tinh. B. sắc kí. C. chiết. D. chưng cất.
(Xem giải) Câu 12. Hợp chất hữu cơ X công thức phân tử là C3H4O2. Chất X tác dụng được với dung dịch sodium hydrogencarbonate và dung dịch bromine. Tên gọi của X là
A. acrylic acid. B. acetone. C. methyl acetate. D. propane-1,3-diol.
(Xem giải) Câu 13. Sử dụng cùng số mol các chất khử trong các phản ứng sau. Phản ứng nào cần số mol H2SO4 lớn nhất? Biết H2SO4 trong các phản ứng đều là H2SO4 đặc, nóng và SO2 là sản phẩm khử duy nhất.
A. Fe + H2SO4. B. Cu + H2SO4. C. FeO + H2SO4. D. S + H2SO4.
(Xem giải) Câu 14. Thực hiện phản ứng tách HCl từ dẫn xuất CH3CH2CH2Cl thu được alkene X. Cho alkene X phản ứng với dung dịch Br2/CCl4, thu được sản phẩm chính có công thức là
A. CH3CH2CHBг2. B. CH3CHBгCH3.
C. CH3CH2CH2Br. D. CH3CHBгCH2Br.
(Xem giải) Câu 15. Nhúng thanh Cu tinh khiết có khối lượng là m1 gam vào dung dịch iron (III) chloride, sau một thời gian, lấy thanh Cu ra cân lại thấy khối lượng là m2 gam. Phát biểu nào sau đây đúng?
A. Giá trị của m1 lớn hơn m2.
B. Phương trình phản ứng xảy ra là: 3Cu(s) + 2Fe3+(aq) → 2Fe(s) + 3Cu2+(aq).
C. Trên bề mặt thanh Cu có một lớp kim loại Fe bám vào.
D. Thí nghiệm trên có xảy ra ăn mòn điện hóa học.
(Xem giải) Câu 16. Trong số các dung dịch có cùng nồng độ 0,1M dưới đây, dung dịch chất nào có giá trị pH nhỏ nhất?
A. Ba(OH)2. B. H2SO4. C. NaOH. D. HCl.
(Xem giải) Câu 17. Số nguyên tử hydrogen có trong một mắt xích của nylon-6,6 là
A. 21. B. 22. C. 23. D. 20.
(Xem giải) Câu 18. Phát biểu nào sau đây sai?
A. Trong nguyên tử, số proton bằng số electron.
B. Khối lượng nguyên tử tập trung hầu hết ở hạt nhân.
C. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
D. Vỏ nguyên tử được cấu tạo từ các hạt electron.
(Xem giải) Câu 19. Phát biểu nào sau đây sai?
A. Tất cả các amine đều có tính base.
B. Ở điều kiện thường, aniline là chất lỏng, ít tan trong nước.
C. Amine có nhiệt độ sôi cao hơn hydrocarbon có cùng số nguyên tử carbon.
D. Các amine đều làm quỳ tím hóa xanh.
(Xem giải) Câu 20. Cho các phản ứng sau:
(a) 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
(b) 2HCl + Zn → ZnCl2 + H2.
(c) 14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2 + 7H2O.
(d) 6HCl + 2AI → 2AlCl3 + 3H2.
(e) 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
Số phản ứng trong đó HCl thể hiện tính oxi hóa là
A. 2. B. 1. C. 3. D. 4.
(Xem giải) Câu 21. X là citric acid có trong quả chanh có công thức phân tử là C6H8O7, thỏa mãn sơ đồ sau:
![]()
Biết rằng citric acid có cấu trúc đối xứng. Chọn phát biểu sai?
A. Citric acid là hợp chất hữu cơ tạp chức.
B. Citric acid có 1 nhóm chức alcohol (–OH) trong phân tử.
C. 2 mol X phản ứng tối đa với 3 mol Na2CO3 trong dung dịch.
D. Cho X phản ứng với CH3OH dư (H2SO4 đặc, t°), thu được sản phẩm là ester thuần chức.
(Xem giải) Câu 22. Các phức chất [Co(NH3)6]3+ và [Co(CN)6]3- có cấu trúc như sau:
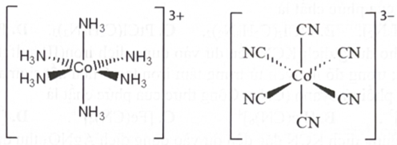
Phát biểu nào sau đây sai?
A. Nguyên tử trung tâm cobalt trong các phức chất trên có cùng số oxi hoá.
B. Các phức chất [Co(NH3)6]3+ và [Co(CN)6]3- đều có cấu trúc bát diện.
C. Các phức chất tạo từ cùng một nguyên tử trung tâm luôn có màu sắc giống nhau.
D. Hợp chất phức [Co(NH3)6]a[Co(CN)6]b có giá trị của a và b là bằng nhau.
(Xem giải) Câu 23. Tiến hành thí nghiệm điều chế isoamyl acetate (chất có mùi chuối chín) theo thứ tự các bước:
Bước 1: Cho khoảng 3 mL CH3CH(CH3)CH2CH2OH, 3 mL CH3COOH và vài giọt H2SO4 đặc vào ống nghiệm.
Bước 2: Lắc đều ống nghiệm rồi đun cách thuỷ (trong nồi nước nóng) khoảng 5 – 7 phút ở 65 – 70°C.
Bước 3: Làm lạnh, sau đó thêm khoảng 5 mL dung dịch NaCl bão hoà vào ống nghiệm.
Cho các phát biểu sau:
(a) H2SO4 đặc có vai trò xúc tác cho phản ứng tạo isoamyl acetate.
(b) Thêm dung dịch NaCl bão hoà vào để tránh phân huỷ sản phẩm.
(c) Sau bước 2, trong ống nghiệm vẫn còn CH3CH(CH3)CH2CH2OH và CH3COOH.
(d) Sau bước 3, trong ống nghiệm thu được hỗn hợp chất lỏng đồng nhất.
Số phát biểu đúng là
A. 1. B. 4. C. 3. D. 2.
(Xem giải) Câu 24. Cho R là nguyên tố mà nguyên tử có phân lớp electron ngoài cùng là np2n+1 (n là số thứ tự của lớp electron). Cho các nhận xét sau đây về nguyên tố R:
(a) Tổng số hạt mang điện của nguyên tử R là 18.
(b) Số electron độc thân trong nguyên tử R là 3.
(c) Oxide cao nhất tạo ra từ R là R2O7.
(d) NaR tác dụng với dung dịch AgNO3 tạo kết tủa.
(e) Hợp chất khí với hydrogen của R trong dung dịch nước có tính acid mạnh.
Số nhận xét đúng là
A. 1. B. 4. C. 2. D. 3.
Phần II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 25 đến câu 30. Trong mỗi ý a), b), c), d) ở mỗi câu thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 25. Aspirin được sử dụng làm thuốc giảm đau, hạ sốt. Sau khi uống, aspirin bị thuỷ nhân trong cơ thể tạo thành salicylic acid. Salicylic acid ức chế quá trình sinh tổng hợp prostaglandin (chất gây đau, sốt và viêm khi nồng độ trong máu cao hơn mức bình thường).
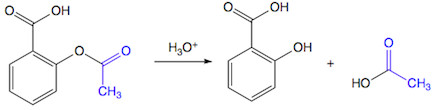
a) Salicylic acid có khả năng phản ứng với Na, NaOH, NaHCO3, CaCO3.
b) Salicylic acid phản ứng với NaOH theo tỉ lệ 1 : 2.
c) Aspirin có độ bất bão hòa k = 5.
d) Salicylic acid là hợp chất hữu cơ đa chức.
(Xem giải) Câu 26. Chromium là kim loại thuộc dãy chuyển tiếp thứ nhất, thuộc ô số 24 trong bảng tuần hoàn các nguyên tố hóa học. Chromium tạo được hợp chất K2Cr2O7. Trong dung dịch K2Cr2O7 tồn tại cân bằng: Cr2O72- (da cam) + H2O ⇋ 2CrO42- (vàng) + 2H+
a) Trong K2Cr2O7, Cr có số oxi hóa +6.
b) Khi tham gia phản ứng hóa học, nguyên tử Cr ưu tiên nhường electron ở phân lớp 4s trước rồi đến phân lớp 3d.
c) Chromium là kim loại cứng nhất trong tất cả các kim loại.
d) Nhỏ vài giọt dung dịch KOH vào dung dịch K2Cr2O7 thì dung dịch chuyển từ màu vàng sang da cam.
(Xem giải) Câu 27. Hợp chất X thuần chức chỉ chứa các nguyên tố: C, H, O. Bằng phổ NMR ¹³C, ¹H thì người ta phát hiện X có 6C, 12H. Phổ MS và phổ IR của X cho kết quả như sau:
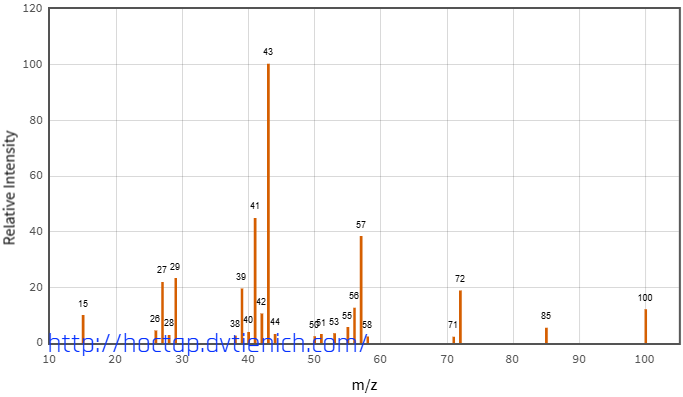
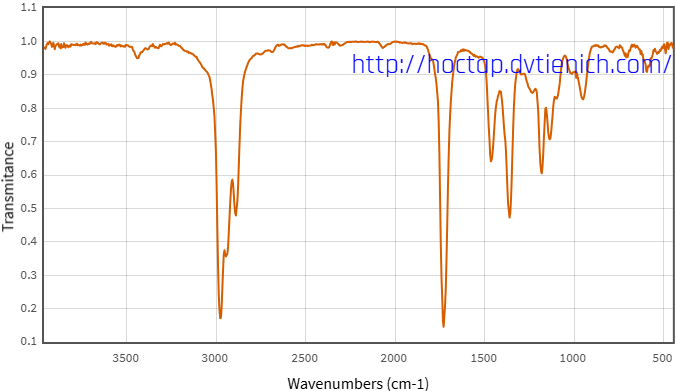
Người ta có thể điều chế X bằng cách cho alcohol Y tác dụng với CuO ở nhiệt độ cao. Alcohol Y có đặc điểm cấu tao: số nhóm CH2 bằng một nửa nhóm CH và bằng ⅓ số nhóm CH3.
a) Công thức phân tử của X là C6H12O.
b) Peak vùng 1740 cm-1 có thể xác định X chứa nhóm carbonyl.
c) Trong công thức cấu tạo của X có chứa 3 nhóm CH3.
d) Tên thay thế của alcohol Y là 4-methylpentan-1-ol.
(Xem giải) Câu 28. Hydrocarbon là nguồn nguyên liệu trong tổng hợp hữu cơ. Một trong các chuyển hóa hydrocarbon được biết đến là quá trình sản xuất xà phòng từ hydrocarbon no, mạch dài không phân nhánh. Quá trình được mô tả theo sơ đồ sau:
R-CH2-CH2-R + O2 → RCOOH + H2O (1)
RCOOH + NaOH → RCOONa + H2O (2)
(a) Trong phản ứng (1), số mol O2 phản ứng gấp 2,5 lần số mol hydrocarbon phản ứng.
(b) Trong phản ứng (2), có thể thay NaOH bằng Na2CO3 thì muối thu được không thay đổi.
(c) Muối sodium stearate có khả năng giặt rửa là do nhóm -COO- dễ xâm nhập vào các vết dầu mỡ.
(d) Nếu hiệu suất quá trình là 90% thì cần 1 tấn hydrocarbon để sản xuất được 1 tấn sodium stearate.
(Xem giải) Câu 29. Thực hiện thí nghiệm sau:
Bước 1: Cho dung dịch NaCl 5% vào ống thuỷ tinh hình chữ U như hình bên.
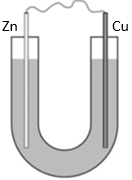
Bước 2: Nhúng một thanh đồng và một thanh kẽm đã làm sạch vào hai đầu của ống chữ U.
Bước 3: Nối hai thanh kim loại bằng dây dẫn.
a) Sau bước 2, không kim loại nào bị ăn mòn.
b) Sau bước 3, kẽm bị oxi hóa và đóng vai trò là anode.
c) Khoảng vài phút sau bước 3, nhỏ vài giọt phenolphthalein vào dung dịch gần thanh đồng và quan sát thấy dung dịch dần chuyển sang màu hồng.
d) Cu2+ bị khử thành Cu bám vào thanh đồng, làm khối lượng thanh đồng tăng dần.
(Xem giải) Câu 30. Một học sinh thực hiện các thí nghiệm để nhận biết hai dung dịch chất X và chất Y, thu được một số kết quả như sau:
– Dung dịch chất X và chất Y đều làm dung dịch phenolphthalein chuyển sang màu hồng.
– Trộn X và Y thu được kết tủa trắng.
– Chất X cháy với ngọn lửa màu lục trên đèn khí, trong khi chất Y cháy với ngọn lửa màu tím.
Biết mỗi chất X và Y đều chỉ chứa một loại cation và một loại anion.
a) Chất X có chứa cation Ba2+, chất Y chứa cation K+.
b) Chất X không thể là barium chloride.
c) Chất Y phải là potassium carbonate.
d) Kết tủa màu trắng phải là hợp chất của barium.
Phần III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 8.
(Xem giải) Câu 31. Thuỷ phân 13,68 gam saccharose một thời gian thu được dung dịch X (hiệu suất phản ứng thủy phân là 70%). Khi cho toàn bộ X tác dụng với một lượng dư dung dịch AgNO3 trong NH3, đến khi phản ứng xảy ra hoàn toàn, thu được a mol Ag. Xác định giá trị a. (Làm tròn kết quả đến chữ số hàng phần trăm).
(Xem giải) Câu 32. Caprolactam được tổng hợp từ cuối thế kỉ XIX. Hiện nay, nhu cầu sản xuất caprolactam trên thế giới khoảng 10 triệu tấn/năm; 90% trong đó dùng để tổng hợp tơ capron. Trong công nghiệp, caprolactam được điều chế theo sơ đồ sau:
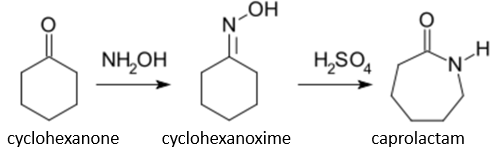
Để đáp ứng đủ nhu cầu sản xuất caprolactam trên thế giới trong 5 năm cần sử dụng bao nhiêu triệu tấn cyclohexanone (giả sử hiệu suất trung bình của cả quá trình trên là 60%)? (Làm tròn kết quả đến chữ số hàng phần mười).
(Xem giải) Câu 33. Cho sơ đồ chuyển hoá sau:
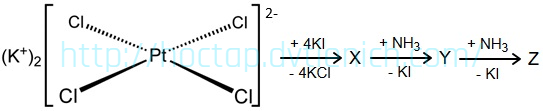
Biết rằng X, Y, Z đều là các phức chất vuông phẳng, đơn nhân. Cho các phát biểu sau:
(a) Các phản ứng trên đều có sự thay thế phối tử trong phức chất.
(b) Trong phức chất Y, có hai phối tử NH3 và hai phối tử iodo (I).
(c) Các phản ứng trong chuỗi trên đều kèm theo sự thay đổi số oxi hoá của nguyên tử trung tâm.
(d) Trong phức chất Y số oxi hóa của Pt là +2.
Có bao nhiêu phát biểu đúng?
(Xem giải) Câu 34. Cho chuỗi phương trình phản ứng:
![]()
Hợp chất X2 được tạo thành từ bao nhiêu nguyên tử?
(Xem giải) Câu 35. Người ta tách kim loại Ag bằng phương pháp cyanide: Nghiền nhỏ quặng silver sulfide (chứa Ag2S, Ag) rồi hoà tan bằng dung dịch NaCN, lọc lấy phần dung dịch chứa phức Na[Ag(CN)2]. Sau đó dùng Zn dư để khử ion Ag+ trong phức, thu được dung dịch chứa Na2[Zn(CN)4)] và chất rắn chứa Ag và Zn. Cuối cùng dùng dung dịch H2SO4 loãng, dư để hoà tan Zn dư, thu được Ag. Nếu sử dụng 14,95 gam Zn, sau khi các phản ứng xảy ra hoàn toàn, thu được 19,48 gam chất rắn gồm Ag và Zn dư. Tính khối lượng (gam) Ag thu được trong quá trình này.
(Xem giải) Câu 36. Hòa tan 4,5 gam tinh thể MSO4.5H2O vào nước thu được dung dịch X. Điện phân dung dịch X với điện cực trơ và cường độ dòng điện 1,93A. Nếu thời gian điện phân là t (s) thì thu được kim loại M ở cathode và 173,53 mL khí tại anode. Nếu thời gian điện phân là 2t (s) thì thu được 594,96 mL khí. Biết thể tích các khí đo ở điều kiện chuẩn. Coi như quá trình điện phân tuân theo lý thuyết, bỏ qua sự thay đổi nhiệt độ và quá thế. Xác định phân tử khối của tinh thể MSO4.5H2O.
(Xem giải) Câu 37. Hợp chất hữu cơ đơn chức X ở điều kiện thường là chất lỏng, có mùi thơm, được ứng dụng làm dung môi, chất tạo hương,… Kết quả phân tích nguyên tố cho thấy X có thành phần phần trăm về khối lượng của C và H lần lượt là 48,65% và 8,11%, còn lại là O. Trên phổ MS của X thấy xuất hiện tín hiệu của ion phân tử [M+] có giá trị m/z = 74. Chất X thường được tổng hợp bằng cách đun nóng hỗn hợp gồm chất hữu cơ A và chất hữu cơ B, có dung dịch H2SO4 đặc làm xúc tác. Từ B có thể điều chế A bằng một phản ứng. Xác định phân tử khối của chất B.
(Xem giải) Câu 38. Độ tan trong nước của MgSO4 ở 20°C và 80°C lần lượt là 33,7 gam và 55,8 gam (trong 100 gam nước). Làm lạnh 779 gam dung dịch bão hòa MgSO4 từ 80°C xuống 20°C thì thấy có 350,55 gam chất rắn MgSO4.nH2O kết tinh. Xác định giá trị của n.
II. PHẦN TỰ LUẬN (10,0 điểm)
(Xem giải) Câu 1. (1,0 điểm)
Trái cây chưa chín thường chứa các polycarboxylic acid, tức là các acid có nhiều hơn một nhóm carboxylic trong phân tử. Trong đó, có tartaric acid có công thức cấu tạo như hình bên.
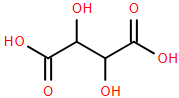
1. Viết công thức phân tử của tartaric acid.
2. Viết phương trình phản ứng của tartaric acid với NaHCO3 dư.
3. Một polycarboxylic A khác cũng có trong trái cây chưa chín là một chất rắn kết tinh không màu, có hàm lượng các nguyên tố như sau: C (35,8%), H (4,5%), O (59,7%) theo khối lượng. Biết phân tử khối của A là 134. Xác định công thức phân tử của A.
4. Hòa tan 1,97 gam A trong nước và chuẩn độ dung dịch thu được bằng NaOH 1,00 mol/L thì cần 29,4 mL dung dịch NaOH để trung hòa hoàn toàn. Xác định số nhóm carboxyl có trong mỗi phân tử của A. Đề xuất các cấu trúc có thể có của A. Biết rằng A có chứa các nhóm chức giống tartaric acid.
(Xem giải) Câu 2. (1,0 điểm)
Trong công nghiệp, chất rắn copper (II) sulfate pentahydrate có thể được sản xuất từ copper theo hai giai đoạn của quá trình:
– Giai đoạn 1: ngâm copper trong dung dịch sulfuric acid loãng và sục dòng khí oxygen liên tục, xảy ra phản ứng:
2Cu + O2 + 2H2SO4 → 2CuSO4 + 2H2O (1)
– Giai đoạn 2: tiến hành kết tinh CuSO4 từ dung dịch sau phản ứng (1) để thu được CuSO4.5H2O kết tinh.
CuSO4(aq) → CuSO4.5H2O(s) (2)
a) Tính khối lượng copper (II) sulfate pentahydrate rắn thu được khi sản xuất từ 1 tấn nguyên liệu chứa 96% khối lượng copper ở dạng đơn chất (còn lại là tạp chất trơ). Cho hiệu suất của quá trình là 80%.
b) Một ao nuôi thuỷ sản có diện tích bề mặt nước là 1000 m², độ sâu trung bình của nước trong ao là 1,5m đang có hiện tượng phú dưỡng. Để xử lí tảo xanh có trong ao, người dân cho copper (II) sulfate pentahydrate vào ao trong 3 ngày, mỗi ngày một lần, mỗi lần là 0,25 gam cho 1 m³ nước trong ao. Hiện tượng phú dưỡng là gì? Tác hại của hiện tượng phú dưỡng? Tính tổng khối lượng copper (II) sulfate pentahydrate người dân cần sử dụng cho ao nuôi thủy sản ở trên?
c) Có thể pha chế dung dịch copper (II) sulfate 10^-4M dùng để diệt một số loại vi sinh vật. Tính số mg copper (II) sulfate pentahydrate cần dùng để pha chế thành 500 mL dung dịch copper (II) sulfate 10^-4M.
Câu 3. (3,0 điểm)
(Xem giải) 1. Cá là nguồn thực phẩm giàu dinh dưỡng nhưng lại thường có mùi tanh khó chịu. Mùi tanh của cá là do sự có mặt của các hợp chất amine, đặc biệt là trimethylamine. Trong dân gian có thể sử dụng nước vo gạo để khử mùi tanh của cá. Nước vo gạo có chứa lactic acid, là acid yếu được sinh ra trong quá trình lên men tinh bột.
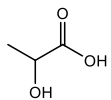
a) Viết phương trình phản ứng dạng ion của trimethylamine với dung dịch HCl, FeCl3 và lactic acid.
b) Ngoài nước vo gạo, hãy đề xuất một chất khác có thể dùng để khử mùi tanh của cá và giải thích.
(Xem giải) 2. Xà phòng hóa hoàn toàn 1,404 gam diester A bằng cách đun nóng với 15,00 mL dung dịch NaOH 1M. Sau phản ứng, cần 3,00 mL dung dịch HCl 1M để trung hòa lượng NaOH dư. Acid hóa nhẹ hỗn hợp sản phẩm thu được một diacid B cùng với methanol và 1 alcohol C. Oxi hóa C bằng CuO, t° thu được hợp chất hữu cơ D. D tác dụng với I2/NaOH, thu được kết tủa vàng và sodium benzoate. Biết A có đồng phân hình học và có độ bất bão hòa bằng 7.
a) Xác định phân tử khối của A.
b) Xác định công thức phân tử của A.
c) Xác định công thức cấu tạo của A, B, C, D và viết các phương trình phản ứng xảy ra.
Câu 4. (3,0 điểm)
(Xem giải) 1. Hỗn hợp chất rắn A gồm M2CO3, MHCO3 và MCl (M là kim loại kiềm). Hòa tan hoàn toàn 43,71 gam A vào 297,4 mL dung dịch HCl 10,52% (d = 1,05 g/mL) dư, thu được dung dịch B và 17,6 gam khí C. Chia B làm hai phần bằng nhau.
– Phần một tác dụng vừa đủ với 125 mL dung dịch KOH 0,8M. Cô cạn dung dịch sau phản ứng, thu được m gam muối khan.
– Phần hai cho tác dụng hoàn toàn với dung dịch AgNO3 dư, thu được 68,88 gam kết tủa trắng.
a) Xác định kim loại M.
b) Tính phần trăm khối lượng các chất trong A.
c) Tính m.
(Xem giải) 2. Nguyên tố X (có nhiều dạng thù hình) tạo hai oxide Z, T (MZ < MT). Trong đó Z là một khí độc. Độ âm điện của X nhỏ hơn oxygen. X có vai trò rất quan trọng trong sinh hóa. Khi kích thích 1 electron, tất cả các orbital lớp ngoài cùng của X đều có một electron.
a) Xác định X, Z và T. Viết cấu hình electron của X ở trạng thái cơ bản và trạng thái kích thích.
b) Một mảnh Mg cháy trong T cho hỗn hợp màu xám bao gồm hợp chất B màu trắng và đơn chất X màu đen (màu sắc của các chất xét ở dạng tinh khiết). Còn khi đốt Mg trong không khí, thu được hỗn hợp sản phẩm màu trắng gồm B và D. D phẩn hủy trong nước cho khí F có mùi đặc trưng. Phản ứng giữa T và F theo tỷ lệ mol 1 : 2 là phương pháp thông dụng để sản xuất một loại phân bón G. Hãy xác định các chất B, D, F, G và viết phương trình phản ứng minh họa.
c) Người ta sử dụng một dạng thù hình của X để phòng nhiễm độc khi trong không khí bị nhiễm Z. Hãy cho biết dạng thù hình của X và tính chất tương ứng với ứng dụng trên.
Câu 5. (2,0 điểm)
1.
(Xem giải) a) Phản ứng tạo triiodomethane (iodoform) có thể được dùng để kiểm tra sự hiện diện của một số nhóm chức trong phân tử. Hãy đề xuất tác nhân và điều kiện của phản ứng này. Viết công thức cấu tạo của một nhóm chức cho kết quả dương tính của phản ứng iodoform. Quan sát thấy gì khi phản ứng cho kết quả dương tính.
(Xem giải) b) Hãy xác định các hợp chất hữu cơ sau có phản ứng iodoform không?
CH3OH; CH3CHO; CH3COOH; C6H5CHO; C6H5COCH3 (-C6H5: gốc phenyl)
(Xem giải) c) Biết liên kết đôi C=C có thể bị oxi hóa bởi KMnO4 trong môi trường acid như sau:
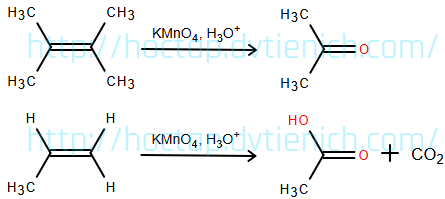
Phản ứng iodoform cùng với các phản ứng khác có thể được sử dụng để xác định cấu trúc của các hợp chất chưa biết. Dùng thông tin trong bảng dưới đây để suy ra cấu trúc của các hợp chất trong sơ đồ sau:
![]()
Kết quả các phép thử (✓: dương tính, ✕: âm tính)
| Thuốc thử | A | B | C |
| Iodoform | ✕ | ✓ | ✓ |
| Tollens | ✓ | ✕ | ✕ |
| Na2CO3(aq) | ✕ | ✕ | ✓ |
(Xem giải) 2. Sắt chiếm 0,328% khối lượng hemoglobin trong máu.
a) Dung dịch nước chứa 80 gam hemoglobin trong một lít dung dịch có áp suất thẩm thấu bằng 0,0260 atm ở 4°C. Tính khối lượng mol của hemoglobin. Biết áp suất thẩm thấu được tính theo công thức: P = RTC
Trong đó: P là áp suất thẩm thấu (atm).
R = 0,082 atm.L.mol-11. K-1.
T là nhiệt độ Kelvin (T = 273 + °C)
C là nồng độ của chất tan (CM).
b) Có bao nhiêu nguyên tử Fe trong một phân tử hemoglobin?

Bình luận