[2025 – 2026] Thi học sinh giỏi lớp 12 – Tỉnh Thái Nguyên
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 010-H12C năm 2025-2026
⇒ Thời gian làm bài: 150 phút
(Xem giải) Câu 1: (2,0 điểm). Trong công nghiệp, nhôm được sản xuất từ quặng bauxite (có thành phần chính là Al2O3.2H2O) theo hai giai đoạn:
– Giai đoạn 1: Tinh chế quặng bauxite (thường lẫn tạp chất Fe2O3 và SiO2) để thu được Al2O3.
– Giai đoạn 2: Điện phân nóng chảy Al2O3 có xúc tác cryolite. Khí O2 sinh ra tại anode oxi hóa dần anode than chì thành CO và CO2.
a. Hãy nêu cách tinh chế quặng bauxite để loại bỏ các tạp chất Fe2O3 và SiO2. Viết phương trình hóa học của các phản ứng xảy ra.
b. Tính khối lượng Al2O3.2H2O cần dùng (theo tấn) để sản xuất được 1,0 tấn Al. Biết hiệu suất đạt 98%.
c. Tính khối lượng anode than chì (theo tấn) tối thiểu cần tiêu tốn để sản xuất được 1,0 tấn Al. Biết khí thoát ra chỉ có CO và CO2 với tỉ lệ mol là 1 : 1.
Câu 2: (2,0 điểm)
(Xem giải) 1. Cho các giá trị nhiệt độ sôi của các hợp chất sau:
| Chất | HF | HCl | HBr | HI | H2O |
| Nhiệt độ sôi (°C) | +19,5 | -84,9 | -66,8 | -35,4 | +100 |
a. Giải thích sự biến đổi nhiệt độ sôi của dãy chất sau: HF, HCl, HBr, HI.
b. Liên kết H-F phân cực hơn liên kết O-H, nhưng nhiệt độ sôi của HF lại thấp hơn nhiệt độ sôi của H2O. Hãy giải thích.
(Xem giải) 2. Cân bằng các phản ứng oxi hóa – khử sau theo phương pháp thăng bằng electron. Xác định chất khử, chất oxi hóa trong các phản ứng đó.
(a) C6H5NO2 + Fe + HCl → C6H5NH3Cl + FeCl2 + H2O
(b) C6H5CH3 + KMnO4 + H2SO4 → C6H5COOH + K2SO4 + MnSO4 + H2O
Câu 3: (2,0 điểm)
(Xem giải) 1. Một nhà máy nhiệt điện khí có sản lượng điện 10^6 kWh/ngày (1 kWh = 3600 kJ) đã sử dụng khí thiên nhiên hóa lỏng LNG (chứa 94% CH4, 6% C2H6 về thể tích) làm nhiên liệu. Các nhiên liệu bị đốt cháy hoàn toàn tạo ra sản phẩm khí (biết 64% nhiệt lượng tỏa ra của quá trình đốt cháy được chuyển hóa thành điện năng). Tính khối lượng khí CO2 mà nhà máy này thải ra trong 1 ngày. Biết nhiệt bay hơi của H2O(l) ở 25°C và 1 bar là 44 kJ/mol; CH4 và C2H6 cháy theo các phương trình nhiệt hóa học:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ![]() = -893 kJ
= -893 kJ
C2H6(g) + 3,5O2(g) → 2CO2(g) + 3H2O(l) ![]() = -1560 kJ
= -1560 kJ
(Xem giải) 2. Cho phản ứng phân huỷ: 2N2O5(g) → 4NO2(g) + O2(g). Nồng độ của mỗi chất trong phản ứng trên tại thời điểm t1 = 0 giây và t2 = 100 giây được cho trong bảng sau:
| Thời gian (s) | C N2O5 (M) | C NO2 (M) | C O2 (M) |
| t1 = 0 | 0,0200 | ||
| t2 = 100 | 0,0169 | 0,0062 | 0,00155 |
Tính tốc độ trung bình của phản ứng theo chất tham gia và sản phẩm.
(Xem giải) Câu 4: (2,0 điểm). Một trong số những ứng dụng chính của ammonia là sản xuất phân đạm. Trong một nhà máy sản xuất đạm (NH4)2SO4, người ta hấp thụ NH3(g) bằng dung dịch H2SO4 loãng trong một tháp phản ứng. Khí NH3 và dung dịch H2SO4 loãng được đưa vào tháp phản ứng qua hai đường khác nhau (tỉ lệ mol NH3 : H2SO4 là 2 : 1). Nhiệt độ ban đầu của NH3(g) và dung dịch H2SO4 lần lượt là 75°C và 25°C. Coi hiệu suất phản ứng bằng 100%.
a. Viết phương trình hóa học của phản ứng xảy ra.
b. Tính lượng nhiệt cần dẫn ra khỏi tháp phản ứng (tính trên 1,0 mol (NH4)2SO4(aq) tạo thành) để nhiệt độ sản phẩm thu được là 25°C. Biết nhiệt dung của NH3 là 35,1 J/mol.K.
c. Nếu tháp phản ứng không trao đổi nhiệt, tính nhiệt độ cuối cùng của dung dịch sản phẩm biết nồng độ (NH4)2SO4 trong dung dịch sản phẩm là 1% về số mol. Bỏ qua sự bay hơi của nước, coi nhiệt dung riêng của dung dịch (NH)2SO4 trên là 4,184 J/g.K.
Cho biết:
| Chất | NH3(g) | H2SO4(aq) | (NH4)2SO4(aq) |
| -45,9 | -909,3 | -1174,3 |
Câu 5: (2,0 điểm)
(Xem giải) 1. Tinh dầu bưởi có tác dụng giảm đau đầu, tăng cường hệ miễn dịch, khử trùng, bảo quản thực phẩm,… Thành phần các chất trong tinh dầu bưởi thường gặp gồm limonene (chiếm khoảng 67% – 80%), nootkatone, linalool, octan-1-ol. Các chất này có công thức cấu tạo dạng khung như sau:
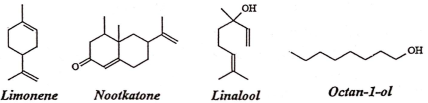
Hãy xác định công thức phân tử của các chất trên. Hãy cho biết các dẫn xuất hydrocarbon có trong dãy trên thuộc loại hợp chất nào?
(Xem giải) 2. Mẫu hóa chất A là hỗn hợp benzoic acid và phenol. Để xác định hàm lượng benzoic acid trong mẫu trên người ta tiến hành như sau: cân chính xác 10,00 gam A cho vào dung dịch NaHCO3 dư, lắc kỹ một thời gian, sau đó để yên rồi tách riêng phần dung dịch và phần hữu cơ không tan. Cho phần dung dịch vào phễu chiết, thêm dung dịch HCl dư, làm lạnh hỗn hợp và thêm tiếp 10 mL hexane (D = 0,66 g/mL) vào và lắc đều. Để yên phễu chiết để hỗn hợp phân thành 2 lớp, loại bỏ lớp dung dịch phía dưới chỉ chứa các chất vô cơ, lớp chất hữu cơ phía trên đem cân lại nặng 9,18 gam.
a. Viết các phương trình hóa học xảy ra.
b. Trong phép phân tích trên, có thể thay NaHCO3 bằng Na2CO3 được không? Vì sao?
c. Tính thành phần % theo khối lượng của benzoic acid trong hỗn hợp A.
Câu 6: (2,0 điểm)
(Xem giải) 1. Carbohydrate là những hợp chất hữu cơ thiên nhiên, có nhiều ứng dụng trong đời sống và sản xuất.
a. Vẽ các dạng công thức cấu tạo của glucose và cho biết dạng nào phản ứng được với thuốc thử Tollens, dạng nào phản ứng được với CH3OH/khí HCl? Viết phương trình hoá học của các phản ứng minh hoạ.
b. Amylose là một trong hai thành phần của tinh bột và tạo bởi các mắt xích là các gốc α-glucose liên kết với nhau bởi các liên kết α-1,4-glycoside, số mắt xích trong amylose khoảng từ 300 – 800. Biểu diễn công thức cấu tạo của amylose (các mắt xích giống nhau chỉ cần viết một mắt xích và đặt trong ngoặc vuông với chỉ số n bên ngoài và mắt xích khác nhau đặt ngoài ngoặc vuông).
(Xem giải) 2. Cây xanh có vai trò rất lớn với sự sống trên Trái đất. Cây xanh cung cấp lương thực, thực phẩm cho con người. Thông qua quá trình quang hợp, cây xanh hấp thụ khí CO2, giải phóng khí O2, làm giảm hiệu ứng nhà kính, giúp điều hòa khí hậu, bảo vệ môi trường.
Cellulose được tạo ra trong cây xanh bắt đầu từ quá trình quang hợp theo sơ đồ:
6CO2 + 6H2O → C6H12O6 (glucose) + 6O2 (1)
nC6H12O6 → (C6H10Os)n (cellulose) + H2O (2)
Cellulose là thành phần chính tạo nên màng tế bào thực vật, tạo nên bộ khung của cây cối. Thân cây, cành cây được dùng làm nguyên liệu để sản xuất đồ gỗ, sản xuất giấy.
a. Một khu đồi có diện tích 19440 m² trồng cây với mật độ 12 m²/cây, khi khai thác rừng, trung bình mỗi cây thu được 500 kg gỗ (chứa 50% cellulose về khối lượng). Ứng với quá trình tạo ra lượng cellulose ở khu đồi trên, hãy cho biết cây đã hấp thụ bao nhiêu m³ khí CO2 và giải phóng bao nhiêu m³ khí O2 (ở đkc)?
b. Toàn bộ lượng gỗ thu được từ khu đồi ở ý (a) đem chế biến và sản xuất thành vở học sinh (loại 200 trang, không tính bìa, kích thước mỗi trang là 210 mm x 297 mm) theo sơ đồ: Gỗ → Bột gỗ → Giấy → Vở học sinh
Biết: Giấy chứa 80% bột gỗ, khối lượng bột gỗ trong giấy bằng 75% so với khối lượng gỗ ban đầu, định lượng giấy là 70 g/m². Tính số quyển vở tối đa thu được.
Câu 7: (2,0 điểm)
(Xem giải) 1. Viết các phương trình phản ứng xảy ra (nếu có) khi cho CH3NH2(aq) tác dụng lần lượt với: (1) CH3COOH; (2) FeCl3; (3) Cu(OH)2, (4) Na2CO3.
(Xem giải) 2. Trong dung dịch, amino acid tồn tại ở dạng ion lưỡng cực, cation hay anion tùy thuộc vào pH của dung dịch. Giá trị pH mà tại đó nồng độ dạng ion lưỡng cực đạt giá trị lớn nhất gọi là điểm đẳng điện (ký hiệu là pI). Điểm đẳng điện của các amino acid được tính theo biểu thức: pI = (pKa1 + pKa2)/2 (với Ka1, Ka2 là hằng số phân li acid của các nhóm chức; pKa = -lgKa).
Đối với các diamino monocarboxylic hoặc monoamino dicarboxylic, pI là giá trị trung bình của hai giá trị pKa gần nhau. Cho pKa của các amino acid như sau:
| Amino acid | pKa1 | pKa2 | pKa3 |
| Alanine | 2,35 | 9,87 | – |
| Lysine | 2,18 | 8,95 | 10,53 |
| Aspartic acid | 2,10 | 3,86 | 9,82 |
a. Tính điểm đẳng điện của alanine, lysine, aspartic acid. Viết công thức dạng ion lưỡng cực của các amino acid trên tại điểm đẳng điện.
b. Các amino acid có các điểm đẳng điện khác nhau nến ở một pH xác định, chúng sẽ di chuyển về cathode hoặc anode với những vận tốc khác nhau. Dựa trên cơ sở này người ta xây dựng phương pháp điện di để phân tích và tinh chế các amino acid từ hỗn hợp của chúng. Hãy xác định các dạng tồn tại chủ yếu (dạng ion lưỡng cực, cation hay anion) của alanine và aspartic acid ở pH = 5,97. Từ đó cho biết có thể tách được 2 amino acid này bằng phương pháp điện di không?
Câu 8: (2,0 điểm)
(Xem giải) 1. Chất béo trong tự nhiên có thành phần chính là các triglyceride (triester của acid béo với glycerol) và một lượng nhỏ acid béo tự do. Để đánh giá lượng acid béo tự do có trong chất béo người ta sử dụng đại lượng chỉ số acid (là số mg KOH dùng để trung hoà lượng acid béo tự do có trong 1 gam chất béo). Chỉ số acid là một thông số quan trọng để đánh giá chất lượng của chất béo. Ví dụ: dầu ăn đạt tiêu chuẩn thường có chỉ số acid nhỏ hơn 4.
Một thí nghiệm xác định chỉ số acid của một loại chất béo được thực hiện như sau:
• Bước 1: Cân chính xác khoảng 2,500 gam mẫu chất béo vào bình tam giác (khối lượng mẫu càng lớn nếu chỉ số acid càng nhỏ).
• Bước 2: Thêm khoảng 50,00 mL hỗn hợp ethanol-diethyl ether (tỉ lệ thể tích 1 : 1) vào bình tam giác chứa mẫu. Lắc nhẹ hoặc đun nóng nhẹ trên bếp điện (dưới tủ hút) nếu cần để hòa tan hoàn toàn chất béo, thêm tiếp 2–3 giọt dung dịch chỉ thị phenolphthalein vào hỗn hợp.
• Bước 3: Nhỏ từ từ dung dịch KOH 0,010M từ burette vào bình tam giác, vừa nhỏ vừa lắc đều bình tam giác. Dùng chuẩn độ khi dung dịch trong bình chuyển sang màu hồng nhạt và giữ màu trong khoảng 30 giây. Thể tích của dung dịch KOH là 12,50 mL.
a. Giải thích tại sao trong bước 1 người ta sử dụng dung môi hỗn hợp ethanol-diethyl ether để hoà tan chất béo mà không sử dụng nước?
b. Viết phương trình phản ứng xảy ra ở bước 3.
c. Xác định chỉ số acid của chất béo trên.
(Xem giải) 2. Benzyl acetate có mùi thơm dễ chịu và là thành phần chính trong các loại tinh dầu từ hoa nhài. Benzyl acetate được sử dụng rộng rãi trong ngành công nghiệp nước hoa và mỹ phẩm. Một trong những phương pháp tổng hợp benzyl acetate đạt hiệu suất cao đã được các nhà khoa học nghiên cứu là sử dụng xúc tác nhựa trao đổi cation acid mạnh với tỉ lệ mol giữa acetic acid và benzyl alcohol là 1 : 1,125, trong thời gian 10 giờ ở 373K. Thực hiện thí nghiệm này, một học sinh đã điều chế được 22,5 gam benzyl acetate, hiệu suất của phản ứng đạt 80%. Tính thể tích acetic acid và benzyl alcohol học sinh đã sử dụng ban đầu.
Biết khối lượng riêng của acetic acid là 1,049 g/cm³ và benzyl alcohol là 1,044 g/cm³.
(Xem giải) Câu 9: (2,0 điểm). Từ X điều chế X8 theo sơ đồ phản ứng sau:
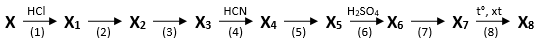
Biết: các chất X1, X2, X3, X4, X5, X6, X7, X8 là các chất hữu cơ; X8 là polymer được dùng để làm kính máy bay, kính xây dựng, kính bảo hiểm, bể cá; mỗi mũi tên là một phản ứng hoá học.
1. Viết phương trình hoá học của các phản ứng xảy ra theo sơ đồ trên.
2. Trình bày cơ chế của phản ứng (1) và phản ứng (4).
Câu 10: (2,0 điểm)
(Xem giải) 1. Dinitrogen tetroxide (không màu) bị phân huỷ thành nitrogen dioxide (màu nâu đỏ) theo phản ứng: N2O4(g) ⇋ 2NO2(g)
Ban đầu, trong bình phản ứng dung tích không đổi 1 Lít có chứa 0,6 mol N2O4. Thời gian đạt tới trạng thái cân bằng và nồng độ N2O4 ở các nhiệt độ khác nhau như sau:
| Nhiệt độ | Thời gian đạt tới trạng thái cân bằng (phút) | Nồng độ N2O4 ở trạng thái cân bằng (mol/L) |
| 0°C | 18 | 0,32 |
| 20°C | 8 | 0,25 |
a. Khi tăng nhiệt độ, màu sắc hỗn hợp khí trong bình thay đổi như thế nào? Giải thích.
b. Tính hằng số cân bằng Kc của phản ứng trên ở 20°C.
(Xem giải) 2. Trong công nghiệp sản xuất sulfuric acid, người ta dùng dung dịch H2SO4 98% để hấp thụ hoàn toàn SO3 tạo ra sản phẩm là oleum. Lấy 5,0 gam oleum sinh ra ở trên pha loãng với nước cất thu được 1000 mL dung dịch H2SO4 loãng (dung dịch X). Để xác định nồng độ H2SO4 trong X, người ta tiến hành chuẩn độ như sau:
• Bước 1: Rửa sạch burette loại 25 mL bằng nước cất, tráng lại bằng dung dịch chuẩn NaOH 0,1M rồi lắp burette lên giá đỡ, cho dung dịch chuẩn NaOH 0,1M vào burette, điều chỉnh dung dịch trong burette đến vạch 0.
• Bước 2: Hút chính xác 10,0 mL dung dịch X cho vào bình tam giác 250 mL. Thêm 3 – 4 giọt phenolphthalein, lắc đều.
• Bước 3: Mở khóa burette để dung dịch NaOH được nhỏ từ từ xuống bình tam giác, lắc đều cho đến khi dung dịch chuyển từ không màu sang màu hồng bền trong khoảng 30 giây thì dừng lại, ghi thể tích dung dịch NaOH đã dùng. Kết quả của 3 lần chuẩn độ như sau:
| Lần chuẩn độ | 1 | 2 | 3 |
| Vdd NaOH đã dùng (mL) | 11,7 | 11,8 | 11,7 |
a) Ở bước 1, tại sao sau khi rửa sạch burette bằng nước cất lại phải tráng lại bằng dung dịch NaOH chuẩn?
b) Vì sao cho chỉ thị phenolphthalein vào bình tam giác mà không cho vào burette?
c) Tính khối lượng dung dịch H2SO4 98% cần dùng để sản xuất được 10 tấn oleum ở trên.


Bình luận