[2025] Thi thử TN chuyên KHTN – Hà Nội (Lần 2)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 060
⇒ Đề thi, đáp án và giải chi tiết:
| 1D | 2C | 3B | 4D | 5B | 6C | 7B | 8B | 9D |
| 10C | 11D | 12B | 13D | 14B | 15C | 16A | 17A | 18C |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | Đ | Đ | S | S | 3 | 4 | 275 |
| (b) | S | Đ | S | S | 26 | 27 | 28 |
| (c) | S | Đ | Đ | Đ | 9,94 | 3 | 46,0 |
| (d) | S | S | S | Đ |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1: Cho các phương pháp sau: (1) đun nóng, (2) dùng dung dịch K2CO3, (3) dùng nhựa trao đổi ion, (4) dùng dung dịch Ca(OH)2. Số phương pháp có khả năng làm mềm nước có tính cứng tạm thời là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 2: Palmitic acid là một acid béo bão hòa phổ biến trong động vật và thực vật. Công thức của palmitic acid là
A. C17H33COOH. B. C17H35COOH. C. C15H31COOH. D. C17H31COOH.
(Xem giải) Câu 3: Insulin là hormon có tác dụng điều tiết lượng đường trong máu. Thủy phân một phần insulin thu được heptapeptide X mạch hở. Khi thủy phân không hoàn toàn X, thu được hỗn hợp chứa các peptide gồm Phe-Phe-Tyr, Pro-Lys-Thr, Tyr-Thr-Pro và Phe-Tyr-Thr. Nếu đánh số thứ từ đầu N là số 1, thì amino acid ở vị trí số 5 trong X có kí hiệu là
A. Thr. B. Pro. C. Tyr. D. Lys.
(Xem giải) Câu 4: Ở một số quốc gia, khoáng vật Trona là nguyên liệu chính để sản xuất soda. Thành phần hóa học chính của Trona là
A. 3NaF.AlF3. B. NaCl.KCl. C. NaNO3. D. Na2CO3.NaHCO3.2H2O.
(Xem giải) Câu 5: Thả một đinh sắt nặng m1 gam đã được đánh sạch bề mặt vào cốc chứa dung dịch CuSO4 màu xanh. Sau một thời gian thấy toàn bộ lượng Cu sinh ra đã bám vào “đinh sắt” (thực chất là phần đinh sắt chưa phản ứng). Lấy “đinh sắt” ra khỏi cốc dung dịch, sấy khô, đem cân được m2 gam. Cho các phát biểu sau:
(a) Phản ứng diễn ra trong cốc là: 2Fe(s) + 3Cu2+(aq) → 2Fe3+(aq) + 3Cu(s).
(b) Màu xanh của dung dịch CuSO4 nhạt dần.
(c) So sánh, thu được kết tủa m2 > m1.
(d) Nếu thay đinh sắt ban đầu bằng thanh kẽm thì màu xanh của dung dịch không thay đổi.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 6: Menthol là một hoạt chất được tìm thấy nhiều trong cây bạc hà. Menthol tạo ra cảm giác mát lạnh và có tác dụng kháng khuẩn, chống co thắt và làm giãn cơ. Công thức cấu tạo của Menthol như hình bên dưới.
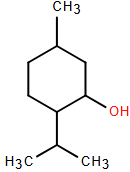
Những phát biểu nào sau đây đúng khi nói về Menthol?
(1) Menthol là alcohol đa chức.
(2) Công thức phân tử của Menthol có dạng CnH2n-1OH.
(3) Tên thay thế của Menthol là 2-isopropyl-5-methylcyclohexandiol.
(4) Menthol là alcohol thơm.
(5) Oxi hóa Menthol bằng CuO, đun nóng thu được một ketone.
A. (1) và (2). B. (2), (3) và (5). C. (2) và (5). D. (3), (4) và (5).
(Xem giải) Câu 7: Trong các chất dưới đây chất nào là amine bậc một?
A. CH3NHCH3. B. CH3CH2NH2. C. (CH3)3N. D. C2H5NHCH3.
(Xem giải) Câu 8: Cao su buna-S (hay còn gọi là cao su SBR) là loại cao su tổng hợp được sử dụng rất phổ biến. Ước tính 50% lốp xe được làm từ SBR. Thực hiện phản ứng đồng trùng hợp các chất nào dưới đây thu được sản phẩm là cao su buna-S?
A. CH2=CH-CH=CH2 và CH2=CH-Cl. B. CH2=CH-CH=CH2 và C6H5-CH=CH2.
C. CH2=CH-CH=CH2 và CH2=CH-CN. D. CH2=CH-CH=CH2 và sunfur.
(Xem giải) Câu 9: Khi cho muối X tác dụng với dung dịch NaOH dư sinh khí mùi khai, X tác dụng với dung dịch BaCl2 sinh ra kết tủa trắng không tan trong HNO3. Vậy X là muối nào trong số các muối sau?
A. (NH4)2CO3. B. (NH4)2SO3. C. NH4HSO3. D. (NH4)2SO4.
(Xem giải) Câu 10: Trong những năm 30 của thế kỉ XX, các nhà khoa học của hãng DuPont (Mỹ) đã thông báo phát minh ra một loại vật liệu “mỏng hơn tơ nhện, bền hơn thép và đẹp hơn lụa”. Theo thời gian, vật liệu này đã có mặt trong cuộc sống hàng ngày của con người, phổ biến trong các sản phẩm như lốp xe, dù, quần áo, tất… Một trong số vật liệu đó là tơ nylon-6 có ứng dụng dùng làm chỉ khâu phẫu thuật. Một hộp chỉ CARELON 7/10 có chứa 12 sợi chỉ, mỗi sợi chỉ nặng 0,1664 gam. Tơ nylon-6 được tổng hợp từ ε-aminocaproic acid theo phản ứng sau:
nNH2-[CH2]5-COOH → [-NH-(CH2)5-CO-]n + nH2O
Biết hiệu suất quá trình tổng hợp nylon-6 là 80%. Khối lượng ε-aminocaproic acid cần dùng để sản xuất 2 triệu hộp chỉ CARELON 7/10 gần nhất với giá trị nào sau đây?
A. 5137 kg. B. 7578 kg. C. 5787 kg. D. 5807 kg.
(Xem giải) Câu 11: Cho thế điện cực chuẩn của các cặp oxi hóa – khử Fe3+/Fe2+ và Cu2+/Cu lần lượt là 0,771V và 0,340V. Nhận định nào sau đây đúng?
A. Tính khử của Cu yếu hơn tính khử của ion Fe2+.
B. Tính oxi hóa của ion Cu2+ mạnh hơn tính oxi hóa của ion Fe3+.
C. Ở điều kiện chuẩn, ion Fe2+ có thể khử ion Cu2+ thành Cu.
D. Ở điều kiện chuẩn, ion Fe3+ có thể bị khử thành ion Fe2+ bởi kim loại Cu.
(Xem giải) Câu 12: Một pin Galvani được cấu tạo bởi hai cặp oxi hóa – khử sau:
(1) Ag+ + 1e → Ag E°Ag+/Ag = +0,799 V
(2) Ni2+ + 2e → Ni E°Ni2+/Ni = -0,257 V
Khi pin làm việc ở điều kiện chuẩn, nhận định nào sau đây là đúng?
A. Ag được tạo ra ở cực dương, Ni được tạo ra ở cực âm.
B. Ag được tạo ra ở cực dương, Ni2+ được tạo ra ở cực âm.
C. Ag+ được tạo ra ở cực âm và Ni được tạo ra ở cực dương.
D. Ag được tạo ra ở cực âm và Ni2+ được tạo ra ở cực dương.
(Xem giải) Câu 13: Thực hiện phản ứng sau: 2[Fe(CN)6]4- (X) + Cl2 → 2[Fe(CN)6]3- (Y) + 2Cl-. Phát biểu nào sau đây không đúng?
A. Phức X và Y có cùng phân tử khối.
B. Ion trung tâm của X và Y lần lượt là Fe2+ và Fe3+.
C. X và Y đều có dạng hình học bát diện.
D. Phản ứng chuyển X thành Y thuộc loại phản ứng thế phối tử.
(Xem giải) Câu 14: Ethylene là một trong những hóa chất quan trọng có nhiều ứng dụng trong đời sống.
Phản ứng hóa học của ehthylene với dung dịch Br2 như sau: CH2=CH2 + Br2 → CH2Br2 – CH2Br
Cơ chế của phản ứng trên xảy ra như sau:
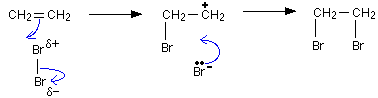
Nhận định nào sau đây không đúng?
A. Phản ứng trên thuộc loại phản ứng cộng.
B. Giai đoạn 1, liên kết đôi phản ứng với tác nhân Brδ- tạo thành phần tử mang điện dương.
C. Giai đoạn 2, phần tử mang điện dương kết hợp với anion Br− tạo thành sản phẩm.
D. Hiện tượng của phản ứng là dung dịch bromine bị nhạt màu.
(Xem giải) Câu 15: Tính chất vật lý nào sau đây của kim loại không phải do các electron tự do gây ra?
A. Tính dẻo. B. Ánh kim. C. Tính cứng. D. Tính dẫn điện và nhiệt.
(Xem giải) Câu 16: Chất hữu cơ X có công thức phân tử là C4H8O và không tham gia phản ứng tráng bạc. Cho X tác dụng với iodine trong dung dịch NaOH, thu được kết tủa màu vàng. Khử X bằng NaBH4 thu được chất hữu cơ Y. Tên gọi của chất Y là:
A. butan-2-ol. B. butan-2-one.
C. 2-methylpropanal. D. butan-1-ol.
(Xem giải) Câu 17: Thủy phân ester nào sau đây trong dung dịch NaOH thu được methyl alcohol?
A. CH3COOCH3. B. CH3COOC2H5. C. HCOOC2H5. D. CH3COOC3H7.
(Xem giải) Câu 18: Hợp chất X là dẫn xuất của benzene có công thức phân tử C8H10O2 và tác dụng với NaOH theo tỉ lệ mol 1 : 1. Mặt khác, khi cho X tác dụng với Na dư thì số mol H2 thu được đúng bằng số mol của X đã phản ứng. Khi tách một phân tử H2O từ X trong điều kiện thích hợp, tạo ra sản phẩm Y có thể trùng hợp tạo polymer. Số công thức cấu tạo phù hợp với X là:
A. 2. B. 3. C. 6. D. 7.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19: Tiến hành thí nghiệm sau:
• Bước 1: Rót vào ống nghiệm 1 và 2, mỗi ống khoảng 3 mL dung dịch H2SO4 loãng, sau đó cho vào mỗi ống một mẫu Zn giống nhau.
• Bước 2: Nhỏ thêm 2-3 giọt dung dịch CuSO4 vào ống 2. So sánh lượng bọt khí thoát ra ở 2 ống.
a. Ở cả hai ống nghiệm, Zn đều bị oxi hoá thành Zn2+.
b. Ống 1 chỉ xảy ra ăn mòn hoá học còn ống 2 chỉ xảy ra ăn mòn điện hoá học.
c. Sau bước 2, tốc độ bọt khí thoát ra ở hai ống là như nhau.
d. Ở ống 2, nếu thay dung dịch CuSO4 bằng dung dịch MgSO4 vẫn xuất hiện pin điện hóa.
(Xem giải) Câu 20: Cho hai chất hữu cơ mạch hở E và F đều chứa các nguyên tố C, H, O, đều có phân tử khối là 104 và không phải là đồng phân của nhau. Từ E và F thực hiện các phản ứng sau:
(1) E + NaOH (t°) → X + Y.
(2) F + 2NaOH (t°) → Z + T + H2O
(3) X + NaOH (CaO, t°) → CH4 + Na2CO3
(4) Z + H2SO4 → G + Na2SO4
Biết X, Y, Z, T, G, M là các chất hữu cơ, trong đó Y, T đều có chứa cùng một loại nhóm chức.
a. E và F đều là các hợp chất hữu cơ tạp chức.
b. Từ chất T có thể điều chế trực tiếp được acetic acid.
c. Trong phân tử Z không còn nguyên tử hydrogen.
d. Sản phẩm của phản ứng ester hóa giữa G với Y (xúc tác H2SO4 đặc), là các ester đa chức mạch hở.
(Xem giải) Câu 21: PETN (pentaerythritol tetranitrate, công thức hóa học: C(CH2ONO2)4) là một trong số những chất nổ mạnh nhất đã biết, nó nhạy nổ ma sát và nhạy nổ chấn động hơn TNT, không bao giờ sử dụng một mình làm thuốc dẫn nổ. PETN ban đầu được dùng làm thuốc dẫn nổ và thuốc nổ chính của đạn nhỏ, nay nó được dùng làm thuốc nổ sau trong kíp nổ, được dùng làm thuốc lõi của dây truyền nổ. PETN cũng được sử dụng y học như một thuốc giãn mạch trong điều trị bệnh tim. Những loại thuốc này hoạt động bằng cách giải phóng tín hiệu khí nitric oxide trong cơ thể. Thuốc tim Lentonitrat gần như là PETN tinh khiết. Năng lượng nổ của PETN là 5,8 MJ/kg.
a) Trong phản ứng phân hủy nổ của PETN, cứ 1 gam PETN tạo ra 0,784 L hơi (CO2, CO, N2, H2O) ở đkc.
b) Khi phân hủy nổ, 1 gam PETN tạo ra lượng nhiệt nhiều hơn lượng nhiệt tạo ra khi đốt cháy 1 gam butane (biết 30% năng lượng nổ của PETN chuyển thành nhiệt, còn lại là sóng xung kích; đốt cháy 1 mol butane tỏa ra nhiệt lượng 2875 kJ)
c) Để sản xuất 1 kg PETN từ pentaerythritol (C(CH2OH)4) và HNO3 đặc (H2SO4 đặc xúc tác), hiệu suất 80% cần 0,538 kg alcohol.
d) Thuốc tim Lentonitrat 7% chứa PETN và 7% sáp. Để sản xuất 100 gam thuốc Lentonitrat cần 7 gam PETN.
(Xem giải) Câu 22: Năm 1965, trong quá trình tổng hợp thuốc chống loét dạ dày, nhà hóa học James M. Schlatter (Mỹ) đã vô tình phát hiện một chất ngọt nhân tạo với tên thường gọi là “Aspartame” có cấu tạo như hình vẽ.
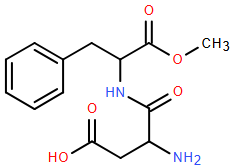
Aspartame ngọt hơn khoảng 200 lần so với đường ăn thông thường (sucrose) và được sử dụng trong đồ uống và thực phẩm dành cho người ăn kiêng vì có ít calo hơn đường ăn thông thường.
a. Aspartame là hợp chất hữu cơ tạp chức chứa đồng thời nhóm chức ester, amine, carboxylic acid và ketone.
b. Trong dung dịch, a mol Aspartame có thể phản ứng tối đa với 2a mol NaOH.
c. Công thức phân tử của Aspartame C14H18N2O5.
d. Liên kết -CO-NH- trong phân tử Aspartame được gọi là liên kết peptide.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23: Thực hiện thí nghiệm điện phân dung dịch CuSO4 với điện cực graphite (than chì). Cho các nhận định sau:
(1) Tại cathode xảy ra sự khử Cu2+ trước, sau đó mới đến sự khử của nước.
(2) Tại anode chỉ xảy ra sự oxi hóa của nước tạo khí hydrogen.
(3) Sau điện phân, khối lượng cathode tăng lên.
(4) Theo thời gian điện phân, pH của dung dịch giảm dần.
(5) Khi vừa bắt đầu điện phân, cả hai điện cực đều có khí thoát ra.
Có bao nhiêu nhận định đúng trong các nhận định trên?
(Xem giải) Câu 24: Cho các polymer: (1) tơ tằm, (2) sợi bông, (3) sợi đay, (4) cellulose triacetate, (5) tinh bột. Có bao nhiêu polymer thiên nhiên trong số các polymer trên?
(Xem giải) Câu 25: Sodium hydrogencarbonate được dùng để sản xuất thuốc giảm đau dạ dày. Giả sử 1 viên thuốc này nặng 1 gam chứa 35% sodium hydrogencarbonate về khối lượng. Vậy để sản xuất được 2 triệu viên thuốc loại này cần bao nhiêu m³ CO2 ở đkc. (Làm tròn kết quả đến hàng đơn vị). Biết hiệu suất của phản ứng NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl là 75%.
(Xem giải) Câu 26: Trong danh mục tiêu chuẩn chất lượng sản phẩm có chỉ tiêu về dư lượng chlorine không vượt quá 1 mg/L (ngưỡng cho phép). Phương pháp chuẩn độ iodine – thiosulfate được dùng để xác định dư lượng chlorine trong thực phẩm theo phương trình: Cl2 + 2KI → 2KCl + I2
Sản phẩm I2 tạo ra ở phản ứng trên được nhận biết bằng hồ tinh bột và bị khử bởi dung dịch chuẩn sodium thiosulfate theo phương trình: I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Dựa vào thể tích dung dịch Na2S2O3 phản ứng, tính được dư lượng chlorine trong dung dịch mẫu. Tiến hành chuẩn độ 100 ml dung dịch mẫu A bằng dung dịch Na2S2O3 0,01M, thấy thể tích Na2S2O3 trung bình sau 3 lần chuẩn độ là 2,8 mL. Vậy dư lượng chlorine có trong mẫu A bằng bao nhiêu mg/L? (Làm tròn kết quả đến hàng phần trăm)
(Xem giải) Câu 27: Cho sơ đồ phản ứng sau:
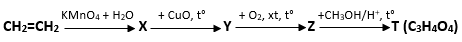
Biết X, Y, Z, T là các hợp chất hữu cơ. Cho các phát biểu sau:
(1) Chất T chỉ chứa một nhóm -CH3.
(2) Ở điều kiện thường, X và T hòa tan được Cu(OH)2 tạo thành dung dịch phức màu xanh lam.
(3) X, Z, T đều tác dụng với kim loại Na.
(4) T tác dụng được với Na, NaHCO3 và NaOH.
(5) Khi đun nóng, Y và T phản ứng được với Cu(OH)2 tạo kết tủa màu đỏ gạch.
(6) Trong công nghiệp, X là nguyên liệu để sản xuất PE
Số phát biểu đúng là bao nhiêu?
(Xem giải) Câu 28: Để xác định hàm lượng muối Fe(II) trong 1 mẫu dung dịch A có thể dùng dung dịch thuốc tím KMnO4, phương trình ion như sau: MnO4− + 5Fe2+ + 8H+ → Mn2+ + 5Fe3+ + 4H2O
– Lấy 25,00 mL dung dịch A cho vào bình định mức, thêm nước cất cho đủ 100 mL, dung dịch thu được gọi là dung dịch X.
– Lấy 10,00 mL dung dịch X chuyển vào bình tam giác sau đó thêm khoảng 5mL dung dịch H2SO4 2M.
– Tiến hành chuẩn độ 3 lần bằng dung dịch KMnO4 0,02M.
Kết quả thể tích KMnO4 sau 3 lần chuẩn độ lần lượt là 20,50 mL; 20,55 mL; 20,55 mL. Tính hàm lượng muối Fe2+ (g/L) trong dung dịch A với giả thiết lượng KMnO4 chỉ phản ứng với Fe2+. (Làm tròn kết quả đến hàng phần mười).


Bình luận