[2025] Thi thử TN liên trường Tiền Giang
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 143
⇒ Đề thi, đáp án và giải chi tiết:
| 1D | 2B | 3A | 4A | 5C | 6A | 7B | 8B | 9D |
| 10A | 11B | 12D | 13B | 14D | 15A | 16B | 17A | 18A |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | Đ | S | Đ | Đ | 885 | 2 | 232 |
| (b) | S | Đ | Đ | S | 26 | 27 | 28 |
| (c) | S | Đ | S | S | 124 | 0,03 | 123 |
| (d) | Đ | Đ | Đ | Đ |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1: Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hoá – khử của các kim loại sau:
| Cặp oxi hoá – khử | Li+/Li | Mg2+/Mg | Zn2+/Zn | Ag+/Ag |
| Thế điện cực chuẩn (V) | -3,040 | -2,356 | -0,762 | +0,799 |
Trong số các kim loại trên, kim loại có tính khử mạnh nhất là
A. Mg. B. Zn. C. Ag. D. Li.
(Xem giải) Câu 2: Sự xen phủ của hai orbital nào sau đây tạo ra liên kết pi (π)?
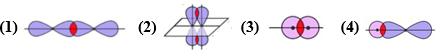
A. (1) B. (2) C. (3) D. (4)
(Xem giải) Câu 3: Khi cho 2 mL dung dịch HCl đặc vào 1 mL dung dịch CuSO4 0,5% thấy dung dịch chuyển từ màu xanh sang màu vàng. Biết phản ứng xảy ra trong thí nghiệm là
[Cu(H2O)6]2+(aq) + 4Cl-(aq) ⇋ [CuCl4]2-(aq) + 6H2O(l) (1)
màu xanh màu vàng
Cho các phát biểu sau:
a) Phản ứng (1) là phản ứng thay thế phối tử.
b) Màu phức chất của Cu(II) ở trên không phụ thuộc vào loại phối tử.
c) Nguyên tử trung tâm trong hai phức chất ở phản ứng (1) đều có cùng số oxi hóa.
d) Hai phức chất trong phản ứng (1) đều có cấu trúc bát diện.
e) Dung dịch thu được sau thí nghiệm trên chỉ chứa phức [CuCl4]2-(aq).
Số phát biểu đúng là
A. 2. B. 1. C. 3. D. 4.
(Xem giải) Câu 4: Khi đun nóng nhẹ, chất nào sau đây không phản ứng được với thuốc thử Tollens?
A. Saccharose. B. Fructose. C. Glucose. D. Acetaldehyde.
(Xem giải) Câu 5: Bỏ qua quá trình bay hơi của nước thì nồng độ CuSO4 trong dung dịch không thay đổi trong trường hợp nào sau đây?
A. Điện phân dung dịch CuSO4 với cathode là than chì, anode là kim loại Fe.
B. Điện phân dung dịch CuSO4 với cathode là kim loại Cu, anode là than chì.
C. Điện phân dung dịch CuSO4 với cathode là than chì, anode là kim loại Cu.
D. Điện phân dung dịch CuSO4 với cathode và anode đều là than chì.
(Xem giải) Câu 6: Hiện tượng phú dưỡng là sự tích tụ trong nước lượng lớn các chất dinh dưỡng bao gồm cả hợp chất của nguyên tố nào sau đây?
A. Nitrogen và phosphorus. B. Chlorine và oxygen.
C. Sodium và chlorine. D. Carbon và sulfur.
(Xem giải) Câu 7: Mùi tanh của cá là do các amine gây ra mà chủ yếu là trimethylamine. Khi chế biến món ăn, người ta thường sử dụng chất nào sau đây để khử mùi tanh của cá?
A. Muối ăn. B. Giấm ăn. C. Bột ngọt (mì chính). D. Đường ăn.
(Xem giải) Câu 8: Đặc điểm nào sau đây là chung cho cả chất giặt rửa tự nhiên, chất giặt rửa tổng hợp và xà phòng?
A. Đều dễ phân hủy sinh học nên ít gây ô nhiễm môi trường.
B. Trong phân tử đều có đầu ưa nước và đuôi dài kị nước.
C. Đều được sản xuất trong công nghiệp từ nguyên liệu là dầu mỏ.
D. Tính giặt rửa đều bị giảm khi sử dụng trong nước cứng.
(Xem giải) Câu 9: Khí X là hormon sinh trưởng của thực vật có tác dụng làm quả mau chín và nó được sinh ra từ một số quả chín như cà chua, chuối,… Khí X là chất nào sau đây?
A. Ethane. B. Methane. C. Acetylene. D. Ethylene.
(Xem giải) Câu 10: Người bị đau dạ dày do dư thừa acid thường có các triệu chứng ợ nóng, ợ chua, khó tiêu. Để làm giảm acid dư thừa và nhanh chóng làm dịu các triệu chứng này ta có thể dùng loại thuốc nào sau đây?
A. Yumangel có thành phần tá dược là Mg(OH)2 và Al(OH)3.
B. Thuốc giảm đau có thành phần tá dược là methylsalycilate (HO-C6H4COOCH3).
C. Aspirin có thành phần tá dược là acetylsalicylic acid (CH3COO-C6H5COOH).
D. Paracetamol là có thành phần tá dược là acetaminophen (HO-C6H4-NHCOCH3).
(Xem giải) Câu 11: Cơ chế phản ứng CH2=CH2 + HBr → CH3-CH2-Br xảy ra qua hai giai đoạn như sau:
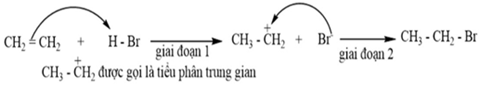
Để biểu diễn cơ chế phản ứng người ta thường dùng mũi tên cong chỉ sự dịch chuyển cặp electron. Tác nhân electrophile là tác nhân có ái lực với electron, thường là các tiểu phân mang điện tích dương hoặc có trung tâm mang một phần điện tích dương. Trong phân cắt dị li, liên kết hóa học bị phân cắt không đồng đều. Nguyên tử có độ âm điện lớn hơn thường chiếm cặp electron chung và trở thành tiểu phân mang điện tích âm, còn nguyên tử có độ âm điện nhỏ hơn thường trở thành tiểu phân mang điện tích dương. Giai đoạn (1) là giai đoạn chậm quyết định tốc độ phản ứng (cơ chế phản ứng). Phát biểu nào sau đây không đúng khi nói về cơ chế của phản ứng trên?
A. Phản ứng xảy ra theo cơ chế cộng electrophile.
B. Giai đoạn 1 có sự phá vỡ liên kết σ trong phân tử C2H4.
C. Sự phân cắt liên kết H – Br là phân cắt dị li.
D. Ở giai đoạn 2 có sự tạo thành liên kết σ.
(Xem giải) Câu 12: Trong sản xuất nông nghiệp, ngoài sử dụng phân bón hóa học thì người nông dân còn thường xuyên sử dụng các loại phân hữu cơ truyền thống như phân chuồng (chất thải động vật nuôi), phân xanh (hình thành từ cây, lá cây tươi được ủ hoặc vùi thẳng vào đất), phân rác (ủ rác thải hữu cơ như thân, lá các cây ngô, đậu, rau quả thừa, cỏ dại, bã thực vật, rơm rạ…). So với phân bón hóa học thì các loại phân này có chung nhược điểm là
A. làm cho đất khô cứng, kém tơi xốp.
B. giá thành cao.
C. dễ bị rửa trôi.
D. có hàm lượng dinh dưỡng không cao.
(Xem giải) Câu 13: Trong nọc độc của kiến đỏ hoặc ong có chứa formic acid. Khi bị kiến hoặc ong đốt (chích) thường gây nên hiện tượng đau và sưng tấy là do formic acid. Để giảm đau và sưng tấy khi bị kiến hoặc ong đốt (chích) người ta thường bôi lên vết đốt chất nào sau đây?
A. Cồn 98° (C2H5OH). B. Vôi tôi (Ca(OH)2).
C. Muối ăn (NaCl). D. Acetic acid (CH3COOH).
(Xem giải) Câu 14: Thạch nhũ được hình thành trong tự nhiên là do quá trình nào sau đây?
A. 2Ca(OH)2 + 2SO2 + O2 → 2CaSO4 + 2H2O.
B. CaO + CO2 → CaCO3.
C. Ca(OH)2 + CO2 → CaCO3 + H2O.
D. Ca(HCO3)2 ⇋ CaCO3 + CO2 + H2O.
(Xem giải) Câu 15: Isopropyl formate là một ester có trong cà phê Arabica (cà phê chè). Công thức của isopropyl formate là
A. HCOOCH(CH3)2. B. HCOOCH2CH2CH3.
C. HCOOCH2CH3. D. CH3COOCH2CH2CH3.
(Xem giải) Câu 16: So với kim loại K và Ca thì kim loại Cu có
A. độ dẫn điện thấp hơn. B. nhiệt độ nóng chảy cao hơn.
C. độ cứng thấp hơn. D. khối lượng riêng nhỏ hơn.
(Xem giải) Câu 17: Cho vào ống nghiệm 5 mL dung dịch CH3COONa 0,5M với vài giọt phenolphtalein thấy dung dịch có màu hồng nhạt. Sau đó đem ngâm ống nghiệm vào cốc nước nóng một thời gian thấy màu hồng của dung dịch đậm hơn. Biết trong dung dịch có cân bằng: CH3COONa + H2O ⇋ CH3COOH + NaOH (1). Cho các phát biểu sau:
(a) Dung dịch CH3COONa luôn có pH > 7.
(b) Ở phản ứng (1) giá trị ![]() > 0.
> 0.
(c) Trong phản ứng (1), theo thuyết Br∅nsted – Lowry thì CH3COO- là acid.
(d) Trong dung dịch CH3COONa luôn có cả CH3COOH và NaOH.
Số phát biểu đúng là:
A. 2. B. 3. C. 1. D. 4.
(Xem giải) Câu 18: Độ cứng của nước được xác định dựa trên tổng lượng Ca2+ và Mg2+ quy đổi về hàm lượng CaCO3 (mg/L) trong nước (Ví dụ một loại nước cứng có tổng nồng độ Ca2+ và Mg2+ là 0,0015 M thì có độ cứng bằng 150). Theo quy chuẩn về độ cứng thì nước mềm sẽ có độ cứng < 60 mg/L. Để làm mềm 100 m³ nước có độ cứng 120 thì cần tối thiểu m kg Na2CO3. Giá trị m gần với giá trị nào sau đây nhất?
A. 6,36. B. 9,54. C. 3,18. D. 12,72.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19: Acquy chì là một nguồn điện thứ cấp có nguyên tắc hoạt động tương tự pin điện hóa (quá trình oxi hóa và quá trình khử xảy ra tương tự ở các điện cực). Acquy chì được sử dụng phổ biến trong nhiều phương tiện giao thông như xe máy, ô tô. Acquy chì gồm một điện cực là kim loại Pb và điện cực còn lại là Pb có phủ PbO2 nhúng trong dung dịch H2SO4 nồng độ khoảng 40%. Phản ứng oxi hóa – khử xảy ra trong acquy chì như sau:
Pb(s) + PbO2(s) + 2H2SO4(aq) ⇋ 2PbSO4(s) + 2H2O(l)
Trong đó quá trình thuận là quá trình phóng điện, quá trình nghịch là quá trình nạp điện.
a) Việc thu gom và tái chế acquy chì thủ công sẽ gây ô nhiễm môi trường mà đặc biệt là ô nhiễm kim loại nặng.
b) Biết toàn bộ PbSO4 sinh ra đều bám lên các điện cực thì khi sử dụng (đấu nối acquy chì với thiết bị tiêu thụ điện) khối lượng cực âm và cực dương đều tăng với lượng bằng nhau.
c) Khi nạp điện, ở cực âm xảy ra quá trình khử PbSO4 thành PbO2 còn ở cực dương xảy ra quá trình oxi hóa PbSO4 thành Pb.
d) Trong acquy chì thì cực âm (anode) là điện cực Pb, còn cực dương (cathode) là điện cực Pb có phủ lớp PbO2.
(Xem giải) Câu 20: Cây xanh có vai trò rất lớn với sự sống trên Trái Đất. Khi có ánh sáng mặt trời, quá trình quang hợp ở cây xanh mới xảy ra và tạo thành cellulose, tinh bột theo các phương trình hóa học sau:
6CO2 + 6H2O → C6H12O6 (glucose) + 6O2 ![]() > 0 (1)
> 0 (1)
nC6H12O6 → (C6H10O5)n + nH2O (2)
a) Tinh bột và cellulose đều tạo ra từ glucose nên chúng có cấu trúc giống nhau.
b) Khi cây xanh tổng hợp ra 8,1 tấn cellulose thì đã cung cấp cho không khí một lượng oxygen tối thiểu là 9,6 tấn.
c) Trong quá trình quang hợp xảy ra phản ứng (1) là phản ứng hấp thu năng lượng.
d) Phản ứng quang hợp là một giai đoạn của chu trình chuyển hóa carbon trong tự nhiên.
(Xem giải) Câu 21: Vỏ tôm có thành phần hóa học chủ yếu là protein (khoảng 45,2%), khoáng (khoảng 21,5% chủ yếu gồm CaCO3, Ca3(PO4)2), chitil (khoảng 17,2%) và một số chất khác như lipide, chất màu, … Từ vỏ tôm người ta điều chế được glucosamin chlohydride theo sơ đồ sau:

Để nghiên cứu sự ảnh hưởng của nhiệt độ và nồng độ HCl acid đến hiệu suất khử khoáng. Một nhóm học sinh tiến hành thí nghiệm sau: Cân một lượng chính xác các mẫu vỏ tôm cho ngâm vào dung dịch HCl ở các nồng độ khác nhau và thực hiện ở các nhiệt độ khác nhau. Sau thời gian 12 giờ đem mẫu thu được xác định hàm lượng khoáng còn lại trong vỏ tôm và ghi kết quả thu được ở bảng sau:
| Nồng độ dung dịch HCl (%) | 2 | 3 | 4 | 5 |
| Hàm lượng khoáng còn lại ở 30°C (%) | 13,9 | 10,2 | 8,6 | 6,4 |
| Hàm lượng khoáng còn lại ở 50°C (%) | 5,8 | 3,3 | 0,6 | 0,5 |
| Hàm lượng khoáng còn lại ở 70°C (%) | 4,3 | 2,1 | 0,4 | 0,2 |
a) Trong quá trình khử khoáng đã xảy ra các phản ứng hóa học hòa tan muối CaCO3 và Ca3(PO4)2 bằng dung dịch HCl.
b) Với thời gian ngâm mẫu là 12 giờ, nồng độ HCl ≥ 4% và nhiệt độ ≥ 50°C thì hàm lượng khoáng còn lại nhỏ hơn 1%.
c) Khi ở nhiệt độ cao (50°C đến 70°C), thì hiệu suất khử khoáng không phụ thuộc vào nồng độ dung dịch HCl.
d) Giả thuyết phù hợp với thí nghiệm nghiên cứu trên là hiệu suất khử khoáng phụ thuộc đồng thời vào nồng độ HCl và nhiệt độ.
(Xem giải) Câu 22: Một nhóm học sinh nghiên cứu ảnh hưởng của môi trường đến khả năng ăn mòn và tốc độ ăn mòn của kim loại và đưa ra giả thuyết “Tốc độ ăn mòn kim loại phụ thuộc vào nồng độ ion trong môi trường, nếu môi trường có nồng độ ion càng lớn thì tốc độ ăn mòn càng nhanh”. Để chứng minh giả thuyết, nhóm học sinh tiến hành thí nghiệm sau: Lấy ba đinh sắt (làm bằng thép carbon) có thành phần và kích thước như nhau vào ba cốc (như hình vẽ): Cốc 1 chứa 100 mL nước cất, cốc 2 chứa 100 mL dung dịch NaCl 5% và cốc 3 chứa 100 mL dầu nhờn. Để 3 cốc đó trong không khí, sau 5 ngày thấy đinh sắt trong cốc 1 bị gỉ ít, trong cốc 2 bị gỉ nhiều, trong cốc 3 không bị gỉ.
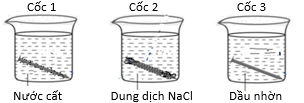
a) Ở cốc 3 đinh sắt không bị gỉ là do dầu nhờn không tạo ra dung dịch chất điện li.
b) Đinh sắt trong cốc 1 và 2 bị gỉ là do ăn mòn điện hóa trong đó chất oxi hóa là nước.
c) Đinh sắt trong cốc 2 bị gỉ nhiều hơn trong cốc 1 là do NaCl phản ứng với Fe.
d) Từ kết quả thí nghiệm chứng minh giả thuyết mà nhóm học sinh đưa ra là đúng.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23: Acetic acid là hóa chất được sử dụng rộng rãi để điều chế polymer, tổng hợp hương liệu,…. Từ nguồn khí than (CO) với H2 dư có thể tổng hợp được acetic acid theo quy trình:
CO + 2H2 (xt, t°) → CH3OH (1)
CO + CH3OH (xt, t°) → CH3COOH (2)
Với hiệu suất các phản ứng (1) và (2) lần lượt là 80% và 98%. Để sản xuất 1000 lít CH3COOH (d = 1,05 g/mL) thì cần tối thiểu bao nhiêu m³ khí CO ở điều kiện chuẩn? (kết quả làm tròn số đến hàng đơn vị)
(Xem giải) Câu 24: Giá trị pH của dung dịch các amino acid mà khi đặt trong điện trường amino acid đó không di chuyển về phía điện cực nào cả được cho ở bảng sau.
| Amino acid | Alanine (1) | Lysine (2) | Glutamic acid (3) |
| pH | 6,0 | 9,7 | 3,2 |
Khi đặt dung dịch hỗn hợp ba amino acid trên có pH = 6 trong điện trường thì chất nào bị dịch chuyển về cực âm dưới dạng ion?
(Xem giải) Câu 25: Quặng argentite (sau khi đã tuyển quặng) có hàm lượng Ag2S là 86,8% (còn lại là tạp chất trơ). Từ loại quặng này người ta tách lấy kim loại Ag theo các bước sau:
• Bước 1: Xử lí quặng này với dung dịch NaCN bằng phương pháp nghiền ướt xảy ra phản ứng sau:
(1) Ag2S + 4NaCN → 2Na[Ag(CN)2] + Na2S
(2) 2NaCN + 2Na2S + 2H2O + O2 → 2NaSCN + 4NaOH
• Bước 2: Cho bột kẽm (Zn) vào dung dịch thu được xảy ra phản ứng
2Na[Ag(CN)2] + Zn → Na2[Zn(CN)4] +2Ag
• Bước 3: Hòa tan hỗn hợp kim loại sau phản ứng trong H2SO4 loãng thu được kim loại Ag.
Biết các phản ứng xảy ra hoàn toàn, lượng Zn dùng dư 2% so với lượng cần thiết. Khi xử lí 1 tấn quặng argentite ở trên thì cần dùng bao nhiêu kg Zn? (kết quả làm tròn số đến hàng đơn vị)
(Xem giải) Câu 26: Khung vợt cầu lông cao cấp được làm từ vật liệu composite gồm hai thành phần chính là sợi carbon và nhựa epoxy. Cho các phát biểu về loại vật liệu composite trên:
1) Thành phần sợi carbon là vật liệu cốt.
2) Thành phần nhựa epoxy là vật liệu nền.
3) Nhẹ nhưng có độ bền cơ học thấp.
4) Bền với môi trường không khí và không bị gỉ.
5) Nhựa epoxy quyết định tính chất cơ lí của vật liệu.
Liệt kê các phát biểu đúng theo số thứ tự tăng dần (ví dụ 1234, 2345,…).
(Xem giải) Câu 27: Trong phòng thí nghiệm, một nhóm học sinh được yêu cầu xác định nồng độ của một dung dịch KMnO4. Nhóm học sinh đề xuất tiến hành xác định nồng độ dung dịch mẫu bằng dung dịch H2C2O4 0,1M trong môi trường H2SO4 loãng theo phản ứng:
5H2C2O4 + 2KMnO4 + 3H2SO4 → 10CO2 + 2MnSO4 + K2SO4 + 8H2O.
Nhóm học sinh tiến hành thí nghiệm theo các bước sau:
• Bước 1: Cho dung dịch KMnO4 cần xác định nồng độ cho vào burette và điều chỉnh đến điểm 0.
• Bước 2: Cho 5,0 mL dung dịch H2C2O4 0,1 M và 5,0 mL dung dịch H2SO4 2M vào bình tam giác, đun nóng trên bếp điện đến 70 – 80°C.
• Bước 3: Mở khóa burette cho dung dịch KMnO4 nhỏ chậm vào bình tam giác, lắc đều dung dịch. Tiếp tục làm như vậy tới khi dung dịch xuất hiện màu hồng nhạt bền trong khoảng 20-30 giây thì dừng lại. Tiến hành tương tự thêm 2 lần nữa. Kết quả 3 lần chuẩn độ thu được ở bảng sau:
| Thí nghiệm | Lần 1 | Lần 2 | Lần 3 |
| V(KMnO4) (mL) | 6,60 | 6,65 | 6,60 |
Từ kết quả thí nghiệm trên, nhóm học sinh xác định được nồng độ KMnO4 trong dung dịch bằng bao nhiêu mol/L? (Kết quả làm tròn số đến phần trăm)
(Xem giải) Câu 28: Trong công nghiệp, sodium hydrogencarbonate (baking soda) và sodium carbonate (soda) được sản xuất bằng phương pháp Solvay theo sơ đồ sau:
Trong quá trình Solvay xảy ra các phương trình hoá học sau:
(1) CaCO3(s) → CaO(s) + CO2(g)
(2) NaCl(aq) + NH3(aq) + CO2(aq) + H2O(l) ⇌ NaHCO3(s) + NH4Cl(aq)
(3) 2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(g)
(4) 2NH4Cl(aq) + CaO(s) → 2NH3(g) + CaCl2(aq) + H2O(l)
Cho các phát biểu về quy trình sản xuất bằng phương pháp solvay:
1) Nguyên liệu của quá trình sản xuất bằng phương pháp solvay là CaCO3, NaCl, H2O, NH3.
2) Do NaHCO3 ít tan hơn các chất khác trong dung dịch nên được tách ra bằng phương pháp kết tinh.
3) Ngoài sản phẩm NaHCO3, Na2CO3 thì chất thải ra khỏi quy trình sản xuất là CaCl2.
4) Do NH3 bị chuyển hóa thành NH4Cl nên một lượng lớn NH3 đã bị tiêu tốn trong quá trình sản xuất.
Liệt kê các phát biểu đúng theo số thứ tự tăng dần (ví dụ 1234, 234,…).


Từ ngày mai là Tỉnh Vĩnh Long rồi 🙁
Cũng gần thi rồi, chắc qua năm học sau mới đổi tên mới