[2025] Thi thử TN sở GDĐT Long An (Lần 1 – Đề 1)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 084
⇒ Đề thi, đáp án và giải chi tiết:
| 1A | 2A | 3D | 4C | 5B | 6B | 7C | 8A | 9B |
| 10A | 11A | 12C | 13D | 14B | 15A | 16A | 17D | 18C |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | Đ | Đ | Đ | Đ | 1200 | 133 | 2143 |
| (b) | S | S | S | S | 26 | 27 | 28 |
| (c) | Đ | S | Đ | S | 9 | 0,28 | 1792 |
| (d) | S | Đ | S | Đ |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Chất nào dưới đây là ester?
A. CH3COOCH3. B. C2H5COOH. C. CH3COC2H5. D. CH3CH2OH.
(Xem giải) Câu 2. “Chất béo là các triester (ester ba chức) của …(1)… và các …(2)…, gọi chung là các triglyceride.”. Nội dung phù hợp với các phần còn trống (1), (2) lần lượt là
A. glycerol, acid béo. B. glycerol, carboxylic acid.
C. glucose, acid béo. D. glucose, carboxylic acid.
(Xem giải) Câu 3. Công thức phân tử của maltose là
A. C12H24O12. B. C6H12O6. C. C6H10O5. D. C12H22O11.
(Xem giải) Câu 4. Chất nào dưới đây là amine bậc một?
A. CH3CH2OH. B. CH3NHCH3. C. CH3CH2NH2. D. CH3OCH3.
(Xem giải) Câu 5. Peptide mạch hở X được biểu diễn bằng công thức Ala-Gly-Val-Ala. Cho các phát biểu sau:
(a) X là tetrapeptide.
(b) Trong phân tử X có 4 liên kết peptide.
(c) X không bị thuỷ phân trong môi trường acid.
(d) X phản ứng được với Cu(OH)2 tạo màu tím buiret.
Số phát biểu đúng là
A. 3. B. 2. C. 1. D. 4.
(Xem giải) Câu 6. Ở pH = 6, các amino acid: glycine, alanine, glutamic acid và lysine chủ yếu tồn tại ở dạng như hình bên dưới.
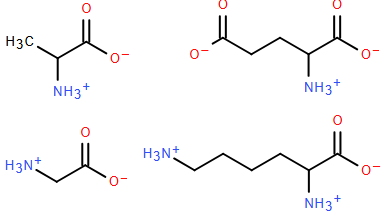
Đặt một điện trường vào mỗi dung dịch có pH = 6 chứa một trong các amino acid trên. Cho các nhận định sau:
(a) Glycine di chuyển về phía điện cực dương.
(b) Alanine hầu như không di chuyển về các điện cực.
(c) Glutamic acid di chuyển về phía điện cực âm.
(d) Lysine di chuyển về phía điện cực dương.
Trong các nhận định trên, có bao nhiêu nhận định đúng?
A. 2. B. 1. C. 3. D. 4.
(Xem giải) Câu 7. Poly(vinyl chloride) được điều chế bằng phản ứng trùng hợp monomer nào dưới đây?
A. CH2=CH‒CH3. B. CH2=CCl-CH=CH2.
C. CH2=CH‒Cl. D. CH2=CH2.
(Xem giải) Câu 8. Ở điều kiện chuẩn, dãy nào dưới đây sắp xếp theo chiều giảm dần tính khử của kim loại?
A. Fe, Cu, Ag. B. Fe, Ag, Cu. C. Ag, Cu, Fe. D. Ag, Fe, Cu.
(Xem giải) Câu 9. Ở điều kiện chuẩn, kim loại nào dưới đây không khử được ion H+ trong dung dịch HCl?
A. Fe. B. Cu. C. Zn. D. Mg.
(Xem giải) Câu 10. Dây chảy, thường làm bằng chì (lead, kí hiệu Pb), là một chi tiết trong cầu chì. Khi có sự cố xảy ra làm tăng nhiệt độ, dây chảy bị đứt và ngăn dòng điện, bảo vệ các thiết bị điện. Kim loại chì (lead) được sử dụng làm dây chảy trong cầu chì chủ yếu là do tính chất nào dưới đây?
A. Nhiệt độ nóng chảy tương đối thấp.
B. Khối lượng riêng tương đối nhỏ.
C. Độ cứng tương đối thấp.
D. Độ dẫn điện tương đối thấp.
(Xem giải) Câu 11. Trong công nghiệp, để tách kim loại Al khỏi hợp chất Al2O3 thì cần sử dụng phương pháp nào dưới đây?
A. Điện phân Al2O3 nóng chảy.
B. Điện phân dung dịch AlCl3.
C. Nung Al2O3 với khí CO ở nhiệt độ 600°C.
D. Cho kim loại Na tác dụng với dung dịch AlCl3.
(Xem giải) Câu 12. Nguyên tố Na thuộc nhóm IA. Kim loại Na được bảo quản bằng cách ngâm trong chất lỏng nào dưới đây?
A. Nước cất. B. Ethanol. C. Dầu hoả. D. Acetic acid.
(Xem giải) Câu 13. Đá vôi có thành phần chính là CaCO3. Tên gọi của CaCO3 là gì?
A. Sodium sulfate. B. Sodium carbonate.
C. Calcium sulfate. D. Calcium carbonate.
(Xem giải) Câu 14. Phương pháp nào dưới đây không làm mềm được nước có tính cứng tạm thời?
A. Đun sôi. B. Dùng vừa đủ dung dịch HCl.
C. Dùng vừa đủ Ca(OH)2. D. Dùng vừa đủ Na2CO3.
(Xem giải) Câu 15. Kết quả phân tích phổ khối lượng (MS) của một hydrocarbon X cho biết phân tử khối của nó là 58. X có công thức phân tử là
A. C4H10. B. C5H8. C. C6H6. D. C3H8.
(Xem giải) Câu 16. Propene tác dụng với dung dịch HBr tạo ra hai dẫn xuất bromo là CH3-CHBr-CH3 (sản phẩm chính) và CH3-CH2-CH2Br (rất ít). Giai đoạn (1) trong cơ chế phản ứng này có sự tạo thành các tiểu phân trung gian là carbocation I và carbocation II như sau:
CH3-CH=CH2 + H+ → (CH3)2CH+ (carbocation I)
CH3-CH=CH2 + H+ → CH3-CH2-CH2+ (carbocation II)
Trong giai đoạn (1) này, CH3‒CH=CH2 là chất phản ứng, H+ là tác nhân. Ở giai đoạn (2), ion Br‒ sẽ kết hợp với các tiểu phân trung gian tạo thành sản phẩm. Phát biểu nào dưới đây đúng?
A. Carbocation I bền hơn carbocation II.
B. Trong giai đoạn (1), khi phân cắt liên kết π, cặp electron được chia đều cho mỗi nguyên tử carbon.
C. Ở giai đoạn (2), ion Br‒ chỉ kết hợp với carbocation I mà không kết hợp được với carbocation II.
D. Ion H+ là tác nhân giàu electron, có khả năng nhường electron cho liên kết π.
(Xem giải) Câu 17. Điểm chớp cháy là nhiệt độ thấp nhất mà một chất lỏng hoặc vật liệu dễ bay hơi tạo thành lượng hơi đủ để bốc cháy trong không khí khi tiếp xúc nguồn lửa. Chất lỏng có điểm chớp cháy nhỏ hơn 37,8°C là chất lỏng dễ cháy. Nhiệt độ tự bốc cháy là nhiệt độ mà tại đó chất cháy tự bốc cháy mà không cần nguồn lửa. Nhiệt độ ngọn lửa là nhiệt độ cao nhất có thể tạo ra bởi chất cháy. Áp suất đều bằng áp suất khí quyển. Hexane là chất lỏng (khối lượng riêng 0,66 gam/cm³) nhẹ hơn nước. Hexane có điểm chớp cháy là ‒22°C, nhiệt độ tự bốc cháy là 259°C và nhiệt độ ngọn lửa là 2040°C. Cho các phát biểu dưới đây (ở áp suất khí quyển):
(a) Hexane là chất lỏng dễ cháy.
(b) Ở 100°C, hexane tự bốc cháy mà không cần nguồn lửa.
(c) Có thể dùng hexane để nấu chảy chì (lead, nhiệt độ nóng chảy là 328°C).
(d) Khi xảy ra đám cháy với lượng lớn hexane nên dùng H2O để dập tắt.
Trong các phát biểu trên, có bao nhiêu phát biểu đúng?
A. 4. B. 3. C. 1. D. 2.
(Xem giải) Câu 18. Đối với vùng đất phèn có pH thấp, khi trồng trọt không nên bón loại phân đạm nào dưới đây để tránh làm đất chua hơn?
A. KNO3. B. (NH2)2CO. C. (NH4)2SO4. D. (NH4)2HPO4.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. Một nhóm học sinh làm thí nghiệm để nghiên cứu sự phụ thuộc của thế điện cực vào nồng độ của ion kim loại. Giả thuyết mà nhóm học sinh này đặt ra là: “khi giảm nồng độ ion kim loại trong dung dịch thì thế điện cực cũng giảm”. Để kiểm chứng giả thuyết trên, nhóm học sinh tiến hành thí nghiệm như sau:
• Bước 1: chuẩn bị 5 cốc chứa dung dịch CuSO4 1M; 5 cốc chứa dung dịch ZnSO4 có nồng độ lần lượt là 1M; 0,5M; 0,1M; 0,05M; 0,01M; Các thanh điện cực Zn và Cu có kích thước như nhau; cầu muối; điện kế để đo sức điện động.
• Bước 2: Tiến hành lắp các dụng cụ theo sơ đồ như hình vẽ bên dưới.
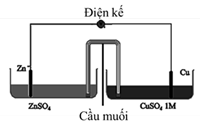
• Bước 3: Lần lượt thay các cốc chứa ZnSO4 có nồng độ khác nhau, tiến hành đo sức điện động của pin.
Kết quả thí nghiệm được học sinh thu thập được theo bảng sau:
| Nồng độ ZnSO4 | 1M | 0,5M | 0,1M | 0,05M | 0,01M |
| Sức điện động (V) | 1,102 | 1,109 | 1,130 | 1,138 | 1,159 |
a) Trong thí nghiệm trên, Zn là anode còn Cu là cathode.
b) Cần phải đồng thời thay đổi cả nồng độ ZnSO4 và CuSO4 mới kiểm định được giả thuyết.
c) Từ kết quả thí nghiệm, tính được thế điện cực của Zn2+/Zn khi nồng độ Zn2+ bằng 0,01M là ‒0,819V, biết E°Cu2+/Cu = +0,34V
d) Dựa vào kết quả thí nghiệm, có thể kết luận khi giảm nồng độ ion kim loại thì thế điện cực tăng.
(Xem giải) Câu 20. Khi có mặt enzyme lactococcus lactis, glucose lên men thành lactic acid theo phương trình hoá học: C6H12O6 → 2CH3‒CH(OH)‒COOH
Để nghiên cứu sự phụ thuộc của phản ứng lên men lactic bằng enzyme lactococcus lactis vào pH của môi trường, một nhóm học sinh nêu giả thuyết như sau: “nếu pH của môi trường càng cao thì hiệu suất phản ứng lên men lactic glucose bằng enzyme lactococcus lactis càng cao.” Từ đó nhóm học sinh tiến hành thí nghiệm sau:
• Bước 1: Chuẩn bị 5 cốc chứa 50 mL dung dịch glucose 10%, thêm hoá chất để ổn định pH của mỗi cốc lần lượt bằng 4, 5, 6, 7, 8. Hấp ở 110°C trong thời gian 20 phút để khử trùng môi trường rồi để nguội.
• Bước 2: Thêm vào mỗi cốc một lượng bằng nhau enzyme lactococcus lactis, đậy kín, để trong tủ ấm 48 giờ ở nhiệt độ 37°C.
• Bước 3: Phân tích mẫu (bằng phương pháp thích hợp) để xác định hiệu suất.
Nhóm học sinh ghi lại được biểu đồ liền quan giữa pH và hiệu suất phản ứng như hình bên dưới:
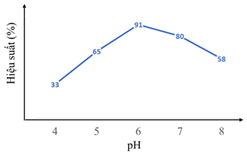
a) Nếu dùng enzyme khác, glucose có thể lên men tạo thành các sản phẩm khác.
b) Lactic acid và glucose đều thuộc loại carbohydate.
c) Kết quả thí nghiệm chứng minh giả thuyết của nhóm học sinh là đúng.
d) Trong các môi trường pH đã thử nghiệm, hiệu suất phản ứng đạt cao nhất ở pH = 6.
(Xem giải) Câu 21. Poly(ethylene terephtalate) (hay còn gọi là PET) là một loại polymer có nhiều ứng dụng trong công nghiệp và đời sống như làm vỏ chai, hộp, vải may quần áo, rèm cửa, vỏ máy móc, linh kiện điện tử, … PET được điều chế từ terephtalic acid và ethylene glycol theo phản ứng:
nHOOC-C6H4-COOH + nC2H4(OH)2 (xt, t°) → (-OC-C6H4-COO-CH2-CH2-O-)n + 2nH2O
a) Các mắt xích trong phân tử PET liên kết với nhau bởi nhóm chức ester.
b) Mỗi phân tử PET có phân tử khối là 192.
c) Phản ứng điều chế PET từ terephtalic acid và ethylene glycol là phản ứng trùng ngưng.
d) PET bền cả trong môi trường acid mạnh lẫn môi trường base mạnh.
(Xem giải) Câu 22. Nguyên tố copper (Cu) có cấu hình electron nguyên tử là [Ar] 3d10 4s1. Trong tự nhiên có nhiều dạng khoáng của copper như malachite (CuCO3.Cu(OH)2), chalcocit (Cu2S),…
Nước Schweizer có khả năng hoà tan cellulose được điều chế từ CuSO4 và dung dịch NH3 theo các phản ứng sau:
CuSO4 + 2NH3 + 2H2O → Cu(OH)2 + (NH4)2SO4
Cu(OH)2 + 4NH3 + 2H2O → [Cu(NH3)4(H2O)2](OH)2
Cu(OH)2 là chất rắn, màu xanh, không tan trong nước, còn [Cu(NH3)4(H2O)2](OH)2 tồn tại trong dung dịch dưới dạng ion [Cu(NH3)4(H2O)2]2+ và ion OH‒.
a) Copper là nguyên tố kim loại dãy chuyển tiếp thứ nhất.
b) Trong các hợp chất, copper chỉ thể hiện mức oxi hoá +2.
c) Nước Schweizer chứa phức của Cu2+ với các phối tử là NH3 và OH‒.
d) Khi cho từ từ NH3 vào dung dịch CuSO4 thì ban đầu có kết tủa màu xanh, sau đó kết tủa tan khi NH3 dư.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Poly(methylmethacrylate) (viết tắt PMMA ‒ còn gọi là plexiglass hay thuỷ tinh hữu cơ) là một loại vật liệu polymer được ứng dụng sản xuất kính ô tô, thiết bị y tế, đèn LED, … Quy trình hiện đại để sản xuất PMMA từ isobutylene (với các điều kiện thích hợp) như sau:
‒ Oxi hoá isobutylene thành methacrylic acid:
2CH2=C(CH3)2 + 3O2 → 2CH2=C(CH3)‒COOH + 2H2O
‒ Ester hoá methacrylic acid bằng CH3OH tạo thành methyl methacrylate:
CH2=C(CH3)‒COOH + CH3OH → CH2=C(CH3)‒COOCH3 + H2O
‒ Trùng hợp methyl methacrylate thành PMMA: nCH2=C(CH3)‒COOCH3 → [-CH2-C(CH3)(COOCH3)-]n
Hiệu suất toàn bộ quá trình điều chế là 70% (tính theo isobutylene). Để sản xuất 1,5 tấn PMMA thì cần dùng m kg isobutylene. Tính giá trị của m (lấy đến hàng đơn vị).
(Xem giải) Câu 24. Aspartic acid là một α‒amino acid thiên nhiên có công thức cấu tạo như bên dưới:
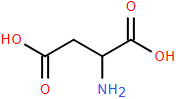
Hãy tính khối lượng mol (gam/mol) của aspartic acid.
(Xem giải) Câu 25. Cho các mệnh đề được đánh số thứ tự như sau:
(1) Khi đặt một hiệu điện thế vào hai đầu kim loại, các electron hoá trị tự do sẽ chuyển động thành dòng có hướng từ cực âm đến cực dương.
(2) Các cation trong tinh thể kim loại có thể trượt lên nhau mà không tách rời nhau do lực hút tĩnh điện giữa chúng với các electron hoá trị tự do.
(3) Các electron hoá trị tự do trong tinh thể kim loại phản xạ hầu hết những tia sáng mà mắt con người nhìn thấy được.
(4) Các electron ở vùng có nhiệt độ cao có động năng lớn sẽ di chuyển đến vùng có nhiệt độ thấp hơn trong tinh thể kim loại và truyền năng lượng cho các cation ở vùng này.
Hãy gán số thứ tự của các mệnh đề trên tương ứng với nguyên nhân gây ra lần lượt các tính chất: tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim của kim loại theo trình tự thành dãy bốn số (Ví dụ 4231).
(Xem giải) Câu 26. Tổng số đồng phân cấu tạo ester có công thức phân tử C5H10O2 là bao nhiêu?
(Xem giải) Câu 27. Túi gia nhiệt của lẩu tự sôi có thành phần là hỗn hợp gồm CaO, Mg, Al, Fe, NaCl. Khi đổ nước vào khay có túi gia nhiệt, CaO phản ứng nhanh và toả ra một lượng nhiệt lớn làm cho nước lẩu sôi. Phương trình phản ứng hoá học của CaO với H2O như sau:
CaO(s) + H2O(l) → Ca(OH)2(s)
90% nhiệt sinh ra do phản ứng trên dùng để đun sôi nước. Các kim loại Mg, Al, Fe cũng phản ứng chậm với nước và toả nhiệt để duy trì nhiệt độ của phần nước lẩu.
Cho bảng giá trị enthalpy tạo thành chuẩn của các chất sau:
| Chất | CaO(s) | H2O(l) | Ca(OH)2(s) |
| ‒635,5 | ‒285,8 | ‒986,1 |
Biết rằng để tăng nhiệt độ của 1 L nước lỏng lên 1°C cần cung cấp năng lượng 4,18 kJ. Một túi gia nhiệt của gói lẩu tự sôi chứa 84 gam CaO thì đun được tối đa V L nước từ 25°C lên 100°C. Tính giá trị của V (làm tròn đến hàng phần trăm).
(Xem giải) Câu 28. Hàm lượng sắt (iron) trong nước là số miligam nguyên tố sắt có trong 1 lít nước, đơn vị tính là mg/L. Để xác định hàm lượng sắt trong một mẫu nước giếng, một nhóm học sinh tiến hành thí nghiệm sau:
• Bước 1: Lấy 200 mL mẫu nước vào bình tam giác, thêm 1 mL dung dịch H2SO4 1M (xem như không làm thay đổi thể tích mẫu) rồi dẫn dư khí SO2 qua dung dịch hỗn hợp để khử toàn bộ Fe3+ thành Fe2+ theo phản ứng:
• Bước 2: Đun nhẹ bình chứa dung dịch mẫu ở nhiệt độ 60°C để đuổi hết khí SO2 dư ra khỏi dung dịch.
• Bước 3: Chuẩn độ 25,00 mL dung dịch mẫu bằng dung dịch KMnO4 0,02M.
Sau 5 lần chuẩn độ, thể tích trung bình của dung dịch KMnO4 là 8,00 mL. Hãy tính hàm lượng của sắt (đơn vị mg/L) trong mẫu nước giếng trên (lấy đến hàng đơn vị).


Bình luận