[2025] Thi thử TN trường Hải Hậu A – Nam Định
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 136
⇒ Đề thi, đáp án và giải chi tiết:
| 1B | 2A | 3B | 4C | 5C | 6C | 7A | 8A | 9B |
| 10D | 11B | 12C | 13B | 14B | 15B | 16A | 17B | 18C |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | S | S | Đ | Đ | 2314 | 134 | 4,6 |
| (b) | Đ | Đ | Đ | S | 26 | 27 | 28 |
| (c) | S | S | S | Đ | 5 | 62,5 | 275 |
| (d) | Đ | Đ | Đ | S |
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Chất nào trong các chất sau tan tốt trong nước ở điều kiện thường?
A. ethyl acetate. B. dimethylamine. C. aniline. D. Benzene.
(Xem giải) Câu 2. Xà phòng hóa hoàn toàn ester có có công thức hóa học CH3COOC2H5 trong dung dich KOH đun nóng, thu được sản phẩm gồm
A. CH3COOK và C2H5OH. B. CH3COONa và C2H5OH.
C. C2H5COOK và CH3OH. D. HCOOK và C3H7OH.
(Xem giải) Câu 3. Amino acid đầu N và amino acid đầu C trong công thức cấu tạo sau lần lượt là
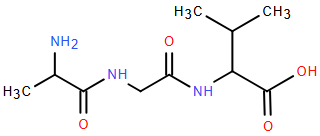
A. Glycine và Valine. B. Alanine và Valine.
C. Valine và Alanine. D. Alanine và Glycine.
(Xem giải) Câu 4. Thí nghiệm nào sau đây chỉ xảy ra ăn mòn hóa học?
A. Nhúng hợp kim Zn-Fe vào dung dịch H2SO4 loãng.
B. Để một vật bằng sắt tây (sắt được tráng thiếc) bị xây xước lớp thiếc trong không khí ẩm.
C. Nhúng thanh Cu vào dung dịch Fe2(SO4)3.
D. Dây đồng nối với dây thép để trong không khí ẩm.
(Xem giải) Câu 5. Điểm đẳng điện (pI) của amino acid là giá trị pH mà tại đó nồng độ ion lưỡng cực của amino acid đạt cực đại. Khi pH < pI thì amino acid đó tồn tại chủ yếu ở dạng cation, còn khi pH > pI thì amino acid đó tồn tại chủ yếu ở dạng anion. Khi đặt trong một điện trường, dạng anion sẽ di chuyển về cực (+), còn dạng cation sẽ di chuyển về cực (-). Tính chất này được gọi là tính điện di và được dùng để tách, tinh chế amino acid ra khỏi hỗn hợp của chúng. Cho các giá trị pI của các amino acid sau:
| Chất | H2NCH2COOH | HOOCCH2CH2CH(NH2)COOH | H2N[CH]4CH(NH2)COOH |
| pI | 6,0 | 3,2 | 9,7 |
Trong các giá trị pH cho dưới đây, giá trị nào là tối ưu nhất để tách ba chất trên ra khỏi dung dịch hỗn hợp của chúng?
A. pH = 9,7. B. pH = 14,0. C. pH = 6,0. D. pH = 3,2.
(Xem giải) Câu 6. Kim loại nào sau đây nhẹ nhất (có khối lượng riêng nhỏ nhất) trong tất cả các kim loại?
A. Rubidi B. Sodium C. Lithium D. Potassium
(Xem giải) Câu 7. Loại phân bón cần cho quá trình kiến tạo nên hoạt chất hình thành mầm hoa, đẻ nhánh, phân cành, đậu quả và phát triển bộ rễ; giúp cây chống được lạnh, nóng,… là
A. phân lân. B. phân bón vi lượng.
C. phân đạm. D. phân kali.
(Xem giải) Câu 8. Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp nhiệt luyện?
A. Fe B. Mg C. Al D. Na
(Xem giải) Câu 9. Số nguyên tử hydrogen có trong phân tử oleic acid là
A. 33. B. 34. C. 35. D. 36.
(Xem giải) Câu 10. Phân tử saccharose được tạo bởi
A. hai đơn vị fructose.
B. hai đơn vị glucose.
C. một đơn vị glucose và một đơn vị maltose.
D. một đơn vị glucose và một đơn vị fructose.
(Xem giải) Câu 11. Đồng vị 90Th232 là đồng vị chính và tồn tại lâu nhất của thorium trong tự nhiên. Đồng vị này trải qua một chuỗi phân rã phóng xạ, bao gồm x lần phát hạt α và y lần phát hạt β−, cuối cùng biến đổi thành hạt nhân bền 82Pb208. Phương trình tổng quát của quá trình phân rã: 90Th232 → 82Pb208 + x2He4 + y-1β0. Giá trị của y là
A. y = 5. B. y = 4. C. y = 8. D. y = 6.
(Xem giải) Câu 12. Polymer nào sau đây không thuộc loại chất dẻo?
A. Polystyrene. B. Poly(vinyl chloride).
C. Polybuta-1,3-diene. D. Poly(methyl methacrylate).
(Xem giải) Câu 13. Khi đun nóng ester của acetic acid trong dung dịch NaOH xảy ra phản ứng hoá học sau:
CH3COOR + NaOH → CH3COONa + ROH (∗)
Cơ chế của phản ứng xảy ra như sau:
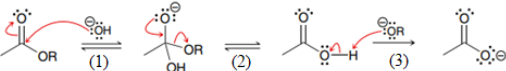
Nhận định nào sau đây không đúng?
A. Giai đoạn (3) là phản ứng acid-base theo bronsted – Lowry.
B. Giai đoạn (2) có sự thay thế nhóm OH bằng nhóm OR.
C. Giai đoạn (1) có sự phá vỡ liên kết π hình thành liên kết σ.
D. Phản ứng (∗) là phản ứng thuỷ phân ester trong môi trường kiềm.
(Xem giải) Câu 14. Chiết là phương pháp dùng một dung môi thích hợp hoà tan chất cần tách chuyển sang pha lỏng (gọi là dịch chiết) và chất này được tách ra khỏi hỗn hợp các chất còn lại. Tách lấy dịch chiết, giải phóng dung môi sẽ thu được
A. hợp chất khí. B. chất cần tách. C. các chất còn lại. D. hỗn hợp ban đầu.
(Xem giải) Câu 15. Hợp chất Y của calcium là thành phần chính của vỏ các loại ốc, sò,… Ngoài ra Y được sử dụng rộng rãi trong sản xuất vôi, xi măng, thủy tinh, chất phụ gia trong công nghiệp thực phẩm. Hợp chất Y là
A. Ca(OH)2. B. CaCO3. C. Ca3(PO4)2. D. CaO.
(Xem giải) Câu 16. Cấu hình electron nào sau đây là của nguyên tử kim loại sodium (Z = 11)?
A. 1s22s22p63s1. B. 1s22s22p63s23p5. C. 1s22s22p63s23p4. D. 1s22s22p6.
(Xem giải) Câu 17. Sức điện động chuẩn của các pin điện hóa: Zn–Cu là 1,1V; Cu–Ag là 0,46V. Biết thế điện cực chuẩn E°Ag+/Ag = +0,8V. Thế điện cực chuẩn E°Zn2+/Zn và E°Cu2+/Cu có giá trị lần lượt là
A. –1,46V và –0,34V. B. –0,76V và +0,34V.
C. –1,56V và +0,64V. D. +1,56V và +0,64V.
(Xem giải) Câu 18. Khi điện phân NaCl nóng chảy, ở anode xảy ra quá trình:
A. Oxi hoá ion Na+. B. Khử ion Cl-. C. Oxi hoá ion Cl-. D. Khử ion Na+.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. Tiến hành điều chế ethyl acetate trong phòng thí nghiệm theo các bước sau đây:
• Bước 1: Cho khoảng 5 mL ethanol và 5 mL acetic acid tuyệt đối vào ống nghiệm, lắc đều hỗn hợp.
• Bước 2: Thêm khoảng vài giọt dung dịch H2SO4 đặc, lắc nhẹ để các chất trộn đều với nhau.
• Bước 3: Đặt ống nghiệm vào cốc nước nóng (khoảng 60°C – 70°C) trong khoảng 5 phút, thỉnh thoảng lắc đều hỗn hợp. Sau đó lấy ống nghiệm ra khỏi cốc nước nóng, để nguội hỗn hợp rồi rót sang ống nghiệm khác chứa 10 mL dung dịch muối ăn bão hòa thì thấy chất lỏng trong ống nghiệm tách thành hai lớp, lớp trên có mùi thơm đặc trưng. Phản ứng xảy ra trong thí nghiệm theo phương trình hoá học sau:
CH3COOH + C2H5OH ⇋ CH3COOC2H5 + H2O (1); Kc = 4
Cho phổ IR của hai hợp chất hữu cơ trong phản ứng trên như hình dưới đây.
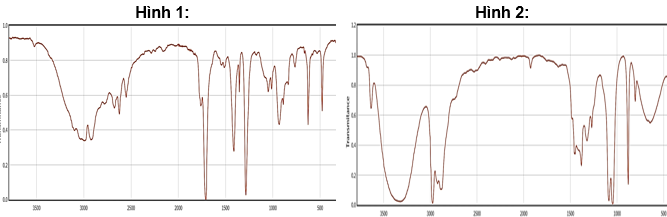
Cho biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng ngoại như sau:
| Liên kết | O–H (alcohol) | O–H (carboxylic acid) | C=O (ester, carboxylic acid) | C–O (ester) |
| Số sóng (cm-1) | 3650 – 3200 | 3300 – 2500 | 1780 – 1650 | 1300 – 1000 |
a) Dung dịch NaCl bão hoà có vai trò làm tăng hiệu suất phản ứng ester hóa.
b) Ban đầu, nếu cho 0,762 mol acetic acid tác dụng với 1 mol ethanol thì khi đạt đến trạng thái cân bằng, hiệu suất phản ứng ester hóa là 75%.
c) Phổ IR trong hình 1 là của C2H5OH, hình 2 là của CH3COOH.
d) Sulfuric acid đặc vừa là chất xúc tác, vừa có tác dụng hút nước, làm tăng hiệu suất tạo ester.
(Xem giải) Câu 20. Một học sinh tiến hành thí nghiệm nghiên cứu sự tạo thành phức chất, phản ứng của phức chất iron(III), ghi lại hiện tượng quan sát được và đưa ra những nhận định như sau:
– Bước 1: Hòa tan iron(III) sulfate vào ống nghiệm chứa nước thu được dung dịch màu vàng nâu. Sau một thời gian, thấy có kết tủa màu nâu đỏ trong ống nghiệm.
– Bước 2: Lọc bỏ kết tủa, thêm KSCN (potassium thiocyanate) vào nước lọc thấy dung dịch chuyển sang màu đỏ máu của các phức chất bát diện chứa từ 1 đến 6 phối tử SCN-.
– Bước 3: Thêm tiếp dung dịch KF dư vào ống nghiệm thấy dung dịch nhạt màu dần và mất màu do tạo phức chất [FeF6]3-.
a) Các phức chất được tạo thành ở bước 2 đều là phức chất trung tính, không mang điện tích.
b) Ở bước 2, xảy ra phản ứng thay thế phối tử H2O bằng phối tử SCN-.
c) Trong thí nghiệm trên, khi tạo phức với ion Fe3+, phối tử là anion tạo luôn ra phức chất có màu đậm hơn phối tử là phân tử trung hòa.
d) Ở bước 1 đã xảy ra quá trình hình thành và thủy phân phức chất aqua của ion Fe3+.
(Xem giải) Câu 21. Enzyme catalase là một protein có khả năng xúc tác cho phản ứng phân hủy hydrogen peroxide (H2O2). Hoạt tính xúc tác của enzyme càng cao thì phản ứng phân hủy H2O2 diễn ra càng nhanh. Hoạt tính xúc tác của enzyme phụ thuộc vào các yếu tố như nhiệt độ, pH,… Một nhóm học sinh tiến hành thí nghiệm ở nhiệt độ không đổi nhưng thay đổi pH của môi trường để xác định pH tối ưu của enzyme catalase. Kết quả thí nghiệm được ghi lại trong bảng sau:
| pH | 5 | 6 | 7 | 8 | 9 |
| Thời gian phân hủy (giây) | 150 | 120 | 60 | 90 | 120 |
a) Ở các giá trị pH nghiên cứu, hoạt tính xúc tác của enzyme catalase cao nhất tại pH = 7.
b) Theo số liệu thu được, phản ứng phân hủy H2O2 ở pH = 7 diễn ra nhanh hơn ở pH = 6.
c) Từ kết quả thí nghiệm, kết luận được hoạt tính xúc tác của enzyme catalase tăng khi pH tăng.
d) pH tối ưu của enzyme catalase là pH trung tính.
(Xem giải) Câu 22. Ở các cây cầu bê tông, cốt thép (thành phần chính là Fe) có thể bị ăn mòn. Quá trình ăn mòn này bắt đầu như sau:
(1) Fe(r) → Fe2+(aq) + 2e
(2) O2(k) + 2H2O(l) + 4e → 4OH-(aq)
Một pin điện đã được thiết lập để xảy ra các phản ứng như quá trình ăn mòn ở trên (ở 25°C). Cho thế điện cực chuẩn ở 25°C:
Fe2+(aq) + 2e ⇋ Fe(r) E° = – 0,44V
O2(k) + 2H2O(l) + 4e ⇋ 4OH-(aq) E° = 0,40V
a) Cho pin hoạt động trong 24h tại điều kiện chuẩn, tạo ra dòng điện không đổi 0,12A. Giả sử H2O và O2 dư trong suốt quá trình. Khối lượng Fe bị oxi hóa thành Fe2+ sau 24h pin hoạt động là 3 gam (làm tròn đến hàng đơn vị).
b) Cathode của pin là Fe.
c) Sức điện động của pin (E°pin) ở 25°C bằng 0,84V.
d) Phản ứng xảy ra khi pin hoạt động là 2Fe + O2 + 2H2O → 2Fe2+ + 4OH-
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Cho phương trình hóa học của các phản ứng được đánh số thứ tự từ 1 đến 4 dưới đây:
(1) 2NaCl → 2Na + Cl2
(2) Fe2O3 + 3CO → 2Fe + 3CO2
(3) Fe + CuSO4 → FeSO4 + Cu
(4) 4AgNO3 + 2H2O → 4Ag + O2 + 4HNO3
Gán số thứ tự phương trình hóa học của các phản ứng theo phương pháp tách kim loại: nhiệt luyện, thủy luyện, điện phân nóng chảy, điện phân dung dịch và sắp xếp theo trình tự thành dãy bốn số (ví dụ 1234, 4321…).
(Xem giải) Câu 24. Cho các nhận định sau:
(1) Aniline phản ứng với dung dịch Br2 thu được chất kết tủa trắng.
(2) CH3CH(NH2)CH3 là amine bậc hai.
(3) CH3CH2NH2 phản ứng với HNO2 ở nhiệt độ thường thu được chất khí không màu.
(4) Để khử mùi tanh của cá (thường do trimethylamine gây ra) có thể dùng giấm ăn.
Sắp xếp các nhận định đúng theo số thứ tự tăng dần (ví dụ 123, 1234…).
(Xem giải) Câu 25. Trong công nghiệp sản xuất sulfuric acid, người ta dùng dung dịch H2SO4 98% để hấp thụ hoàn toàn SO3 tạo ra sản phẩm là oleum (H2SO4.nSO3). Lấy 5,0 gam oleum sinh ra ở trên pha loãng với nước cất thu được 1000 mL dung dịch H2SO4 loãng (dung dịch X). Để xác định nồng độ H2SO4 trong X, người ta tiến hành chuẩn độ như sau:
– Bước 1: Rửa sạch burette loại 25 mL bằng nước cất, tráng lại bằng dung dịch chuẩn NaOH 0,1M rồi lắp burette lên giá đỡ, cho dung dịch chuẩn NaOH 0,1M vào burette, điều chỉnh dung dịch trong burette đến vạch 0.
– Bước 2: Hút chính xác 10,0 mL dung dịch X cho vào bình tam giác 250 mL. Thêm 3-4 giọt phenolphthalein, lắc đều.
– Bước 3: Mở khóa burette để dung dịch NaOH được nhỏ từ từ xuống bình tam giác, lắc đều cho đến khi dung dịch chuyển từ không màu sang màu hồng bền trong khoảng 30 giây thì dừng lại, ghi thể tích dung dịch NaOH đã dùng. Kết quả của 3 lần chuẩn độ như sau:
| Lần chuẩn độ | 1 | 2 | 3 |
| Thể tích dung dịch NaOH đã dùng (mL) | 11,7 | 11,8 | 11,7 |
Để sản xuất được 15 tấn oleum ở trên cần dùng m tấn dung dịch H2SO4 98%. Tính giá trị của m? (làm tròn đến hàng phần mười)
(Xem giải) Câu 26. Cho các chất: cellulose (1), saccharose (2), aniline (3), albumin (4), tristearin (5) và Gly-Ala-Val (6). Có bao nhiêu chất bị thủy phân trong môi trường acid ở điều kiện thích hợp?
(Xem giải) Câu 27. Duralumin được sử dụng rộng rãi làm vật liệu cho ngành hàng không và công nghiệp nhờ vào sự kết hợp giữa độ bền và trọng lượng nhẹ. Một loại duralumin có thành phần khối lượng các nguyên tố như sau:
| Nguyên tố | Al | Cu | Mg | Mn | Si và nguyên tố khác |
| Hàm lượng % | 93,4 | 4,4 | 1,5 | 0,6 | 0,1 |
Cần điện phân nóng chảy m kg MgCl2 với hiệu suất điện phân 95% để thu được Mg phục vụ cho quá trình sản xuất 1000 kg duralumin trên. Giá trị của m là bao nhiêu? (làm tròn đến hàng phần mười).
(Xem giải) Câu 28. Một loại chất béo có chứa tristearin, tripalmitin, stearic acid, palmitic acid. Thành phần % về khối lượng và hiệu suất phản ứng của các chất khi xà phòng hóa chất béo này bằng dung dịch NaOH như sau:
| Thành phần | Tristearin | Tripalmitin | Stearic acid | Palmitic acid | Tạp chất |
| % khối lượng | 53,400 | 32,240 | 1,136 | 1,536 | 11,688 |
| Hiệ̣u suất phản ứng với NaOH | 90% | 88% | 100% | 100% |
Một nhà máy cần sản xuất 3000 bánh xà phòng loại 100 gam (chứa 72% khối lượng muối sodium của các acid béo) bằng cách xà phòng hóa x kg chất béo nói trên với dung dịch NaOH. Biết trong quá trình đóng gói, lượng muối sodium của các acid béo bị hao hụt 4%. Tính giá trị của x? (làm tròn kết quả đến hàng đơn vị).


Bình luận