[2024 – 2025] Thi học sinh giỏi liên trường Quỳnh Lưu, Hoàng Mai – Nghệ An (Lần 1)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề 032-H12B năm 2024-2025
⇒ Thời gian làm bài: 150 phút
⇒ Bảng đáp án phần trắc nghiệm:
| Phần 1 | Phần 2 | 13 | 14 | 15 | 16 | ||
| 1B | 2B | 3A | (a) | S | S | S | Đ |
| 4D | 5B | 6B | (b) | S | Đ | Đ | S |
| 7B | 8B | 9B | (c) | Đ | Đ | S | Đ |
| 10D | 11D | 12B | (d) | Đ | Đ | Đ | Đ |
| Phần 3 | Câu 17 | 10 | Câu 18 | 1188 |
A. PHẦN TRẮC NGHIỆM (8,0 điểm)
PHẦN I (3,0 điểm): Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. X là ester tạo nên mùi thơm của dứa chín. Xà phòng hóa X bằng dung dịch NaOH thu được ethyl alcohol và sodium butyrate. Phát biểu nào sau đây là đúng?
A. Công thức cấu tạo của X là C2H5COOCH2CH2CH2CH3.
B. Trong mỗi phân tử X có 6 nguyên tử carbon.
C. X là ester không no, đơn chức, mạch hở.
D. X có phản ứng với thuốc thử Tollens.
(Xem giải) Câu 2. Hợp chất hữu cơ X mạch hở có công thức phân tử là C3H6O. X không có phản ứng iodoform, X không phản ứng với thuốc thử Tollens. Cho các phát biểu sau về X:
(a) Phổ MS của X xuất hiện tín hiệu có giá trị m/z lớn nhất là 58.
(b) X thuộc loại hợp chất carbonyl, phân tử có nhóm chức C=O.
(c) X là hợp chất không no.
(d) X có 2 đồng phân cấu tạo thỏa mãn.
Số phát biểu đúng là
A. 1. B. 3. C. 2. D. 4.
(Xem giải) Câu 3. Cho phenol vào ống nghiệm, thêm nước rồi lắc đều thấy trong ống nghiệm có vẩn đục màu trắng. Nhận định nào sau đây là không đúng?
A. Cho quỳ tím vào ống nghiệm, quỳ tím sẽ chuyển sang màu hồng.
B. Để yên ống nghiệm một thời gian thì hỗn hợp có hiện tượng phân lớp.
C. Thêm dung dịch NaOH loãng đến dư vào ống nghiệm và đun nhẹ thì thu được dung dịch trong suốt.
D. Xuất hiện vẩn đục trắng do phenol ít tan trong nước lạnh.
(Xem giải) Câu 4. Cho mô tả sự xen phủ các AO sau đây (theo phương nằm ngang)
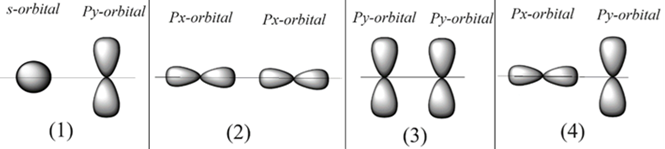
Trường hợp có thể tạo thành liên kết (xích ma) là
A. (3). B. (4). C. (1). D. (2).
(Xem giải) Câu 5. Hợp chất cinnamaldehyde có nhiều trong vỏ cây quế, nó tạo nên mùi thơm của quế. Cinnamaldehyde có công thức cấu tạo như hình dưới
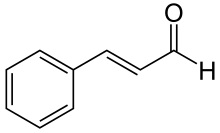
Phát biểu nào sau đây là không đúng ?
A. Khi để ngoài không khí, cinnamaldehyde bị oxi hóa làm cho quế mất dần mùi thơm.
B. Cinnamaldehyde có phản ứng iodoform.
C. Công thức phân tử của cinnamaldehyde là C9H8O.
D. Cinnamaldehyde có đồng phân hình học.
(Xem giải) Câu 6. Trong công nghiệp, ammonia chủ yếu được sản xuất theo quá trình Haber, ammonia được tách ra khỏi hỗn hợp nhờ quá trình
A. hóa hơi. B. ngưng tụ. C. kết tinh. D. chưng cất.
(Xem giải) Câu 7. Phát biểu nào sau đây không đúng khi nói về carbohydrate?
A. Cellulose không tan trong nước nhưng tan tốt trong dung dịch Schweizer.
B. Tinh bột và cellulose là đồng phân cấu tạo của nhau.
C. Saccharose có phản ứng với copper(II) hydroxide trong môi trường kiềm.
D. Glucose, fructose là monosaccharide có công thức phân tử C6H12O6.
(Xem giải) Câu 8. Carbon (₆C) tạo với hydrogen hợp chất dạng CHx. Tổng số electron có trong phân tử này là
A. 16. B. 10. C. 7. D. 8.
(Xem giải) Câu 9. Cho phản ứng thuận nghịch: X ⇋ Y. Phản ứng này đạt tới trạng thái cân bằng khi
A. nồng độ chất X bằng nồng độ chất Y.
B. tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
C. chất X phản ứng hoàn toàn.
D. tốc độ phản ứng bằng không.
(Xem giải) Câu 10. Phản ứng giữa bromite ion và bromide ion trong môi trường acid xảy ra như sau: BrO2- + 3Br- + 4H+ (t°) → 2Br2 + 2H2O.
Sau khoảng thời gian 10 giây, đo được thông số của Br-: ΔC/Δt = -1,5.10-2 (M.s-1)
Tốc độ trung bình của phản ứng trong khoảng thời gian nói trên là
A. 1,5.10-2 (M.s-1). B. 1,5.10-3 (M.s-1).
C. 5.10-4 (M.s-1). D. 5.10-3 (M.s-1).
(Xem giải) Câu 11. Cho các chất sau: KF, KCl, KBr, KI. Có bao nhiêu chất bị oxi hóa khi tác dụng với dung dịch sulfuric acid đặc?
A. 3. B. 4. C. 1. D. 2.
(Xem giải) Câu 12. Cho vào 2 ống nghiệm, mỗi ống 3-4 giọt dung dịch CuSO4 2% và 2-3 giọt dung dịch NaOH 10%, lắc nhẹ. Tiếp tục nhỏ 2-3 giọt glycerol (dư) vào ống nghiệm thứ nhất, 2-3 giọt ethanol (dư) vào ống nghiệm thứ 2. Lắc nhẹ cả 2 ống nghiệm. Phát biểu nào sau đây đúng?
A. Kết thúc thí nghiệm, ống thứ nhất thu được kết tủa, ống thứ hai thu được dung dịch trong suốt.
B. Kết thúc thí nghiệm, ống thứ nhất thu được dung dịch trong suốt, ống thứ hai thu được kết tủa.
C. Kết thúc thí nghiệm, cả 2 ống nghiệm đều thu được dung dịch trong suốt.
D. Kết thúc thí nghiệm, cả 2 ống nghiệm đều có kết tủa.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 13 đến câu 16. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 13. Nước là một chất có thể bay hơi và bị phân hủy theo các phương trình nhiệt học sau:
(1) H2O (l) → H2O (g) ΔH°₂₉₈ = 41,4 kJ.
(2) H2O (g) → H2 (g) + ½O2 (g) ![]() = 241,8 kJ.
= 241,8 kJ.
a) Khi 1 mol H2O (l) bay hơi thì môi trường xung quanh nhận được một năng lượng là 41,4 kJ.
b) H2O (l) kém bền hơn H2O (g).
c) Enthalpy tạo thành chuẩn của H2O (l) là -283,2 kJ/mol.
d) Phản ứng (1) và (2) đều là phản ứng thu nhiệt.
(Xem giải) Câu 14. Khi đun nóng hỗn hợp salicylic acid (2-hydroxylbenzoic acid) và alcohol X trong sulfuric acid đặc, thu được chất Y (chứa nhóm chức ester, có công thức phân tử C8H8O3) dùng làm thuốc giảm đau.
a) X là alcohol no, hở, hai chức.
b) 1 mol Y phản ứng tối đa với 2 mol NaOH trong dung dịch.
c) Y có tên gọi là methyl 2-hydroxybenzoate.
d) Phản ứng tạo chất Y thuộc loại phản ứng ester hóa.
(Xem giải) Câu 15. Để điều chế một lượng nhỏ khí chlorine trong phòng thí nghiệm, người ta sử dụng các dụng cụ, hóa chất và tiến hành điều chế theo sơ đồ thí nghiệm dưới đây.

a) HCl đóng vai trò chất oxi hóa trong phản ứng xảy ra ở thí nghiệm trên.
b) Bông tẩm dung dịch NaOH giúp ngăn khí chlorine tràn ra ngoài.
c) Thay đổi vị trí bình (1) và bình (2), độ tinh khiết của khí chlorine thu được sẽ không đổi.
d) Để điều chế cùng một lượng khí chlorine, thay MnO2 bằng KMnO4 sẽ tiết kiệm được HCl hơn.
(Xem giải) Câu 16. Linoleic acid (LA) có công thức cấu tạo như hình dưới, thuộc nhóm omega-n (n là số thứ tự vị trí của liên kết đôi đầu tiên tính từ đầu nhóm CH3) là một trong những axit béo có lợi cho sức khỏe tim mạch, ngăn ngừa các bệnh về tim, động mạch vành.
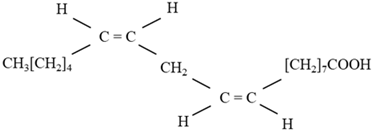
a) Trong phân tử linoleic acid có 2 liên kết đôi C=C ở các vị trí số 6 và 9 tính từ nhóm -CH3.
b) Linoleic acid có 3 đồng phân hình học cis-trans.
c) Công thức phân tử của linoleic acid là C18H32O2.
d) Linoleic acid thuộc loại omega-6.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 17 đến câu 18.
(Xem giải) Câu 17. Từ tinh dầu cây Hương nhu (Ocimum gratissimum) người ta tách được eugenol là hợp chất có vòng benzene. Ở điều kiện thường, nó là chất lỏng, màu vàng nhạt, mùi thơm dịu, được sử dụng nhiều trong y học. Kết quả phân tích nguyên tố trong eugenol như sau: %C = 73,17%; %H = 7,32%; còn lại là oxygen. Từ phổ MS của eugenol không thấy xuất hiện tín hiệu có giá trị m/z lớn hơn 200. Tổng số nguyên tử carbon một phân tử eugenol là bao nhiêu?
(Xem giải) Câu 18. Acetic acid là một hóa chất rất quan trọng trong cuộc sống và trong các ngành công nghiệp. Acetic acid được sử dụng rộng rãi để điều chế polymer, tổng hợp hương liệu. Có nhiều phương pháp để sản xuất acetic acid như lên men ethylic alcohol, oxy hóa alkane… Trong đó phương pháp tổng hợp từ nguồn khí than (giá thành rẻ) là một phương pháp đang được sử dụng rộng rãi. Phương pháp này xảy ra các phản ứng hóa học sau:
CO + 2H2 (t°, xt) → CH3OH (1)
CH3OH + CO (t°, xt) → CH3COOH (2)
Biết hiệu suất của phản ứng (1) và (2) lần lượt là 84% và 80%. Để sản xuất 1000 lít CH3COOH (D = 1,05 g/ml) thì cần dùng bao nhiêu m³ khí CO (đkc)? (Làm tròn kết quả đến hàng đơn vị)
B. PHẦN TỰ LUẬN (12,0 điểm)
Câu 1. (2,0 điểm):
(Xem giải) 1.1. Ở nước ta hiện nay, nhiệt điện vẫn chiếm vai trò nòng cốt, cung cấp hơn 60% tổng năng lượng điện cho đời sống và sản xuất. Có hai công nghệ sản xuất nhiệt điện là nhiệt điện khí và nhiệt điện than.
a) Một nhà máy nhiệt điện khí có sản lượng điện 10^6 kWh/ngày (1 kWh = 3600 kJ), sử dụng khí thiên nhiên hóa lỏng LNG (chứa 94% CH4, 6% C2H6 về thể tích) làm nhiên liệu. Tính khối lượng LNG (tấn) cần cung cấp cho nhà máy trong một ngày biết năng lượng tỏa ra khi đốt cháy 1 mol CH4 là 890 kJ; 1 mol C2H6 là 1560kJ, 64% nhiệt lượng tỏa ra của quá trình đốt cháy được chuyển hóa thành điện năng.
b) So với nhà máy nhiệt điện than (sử dụng than đá làm nhiên liệu) có cùng sản lượng thì điện khí LNG sẽ giảm được bao nhiêu % khí thải CO2? Biết rằng với nhiệt điện than chỉ 40% nhiệt lượng tỏa ra của quá trình đốt cháy được chuyển hóa thành điện năng, năng lượng tỏa ra khi đốt cháy 1 tấn than đá là 3.10^7 kJ.
(Xem giải) 1.2. Sodium fluoride (NaF) và carbon (C) được sử dụng trong nhiều ứng dụng công nghệ vật liệu khác nhau. Dựa vào đặc điểm liên kết hóa học, giải thích các tính chất sau của NaF và kim cương (một dạng thù hình của carbon).
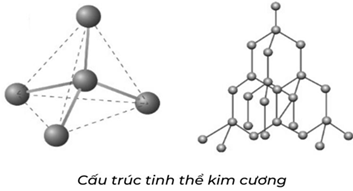
a) NaF có độ tan cao trong nước và dẫn điện khi tan trong nước.
b) Kim cương có độ cứng rất cao và không dẫn điện.
Câu 2. (1,0 điểm)
(Xem giải) 2.1. Tại sao trong phòng thí nghiệm để bảo quản dung dịch muối aluminum người ta thường thêm vào bình ít giọt dung dịch acid?
(Xem giải) 2.2. Tiến hành phân hủy sulfuryl chloride theo phản ứng: SO2Cl2 (g) → SO2(g) + Cl2(g)
Dữ liệu nồng độ theo thời gian được trình bày ở bảng sau:
| Thời gian (phút) | SO2Cl2 (mol/L) | SO2 (mol/L) | Cl2 (mol/L) |
| 1,00 | |||
| 30 | x | 0,39 | 0,39 |
| 50 | 0,35 | y | y |
a) Xác định giá trị x, y.
b) Tính tốc độ trung bình (M/phút) của phản ứng theo SO2Cl2 trong thời gian 20 phút (từ phút thứ 30 đến phút thứ 50)
Câu 3. (2,0 điểm):
(Xem giải) 3.1. Nhà máy nước Hoàng Mai dùng chlorine để khử trùng nước sinh hoạt với hàm lượng đúng tiêu chuẩn theo quy định của Bộ y tế là 0,5 g/m³. Nếu dân số thị xã Hoàng Mai là 115 nghìn người, mỗi người dùng 80 lít nước mỗi ngày, thì nhà máy cần dùng bao nhiêu kilogam chlorine mỗi ngày cho việc xử lý nước?
(Xem giải) 3.2. Tại sao khi dẫn liên tục cho tới dư luồng khí chlorine vào dung dịch potassium iodide (KI) 1M từ không màu sẽ chuyển sang màu vàng nâu, sau đó dung dịch trở lại không màu?
(Xem giải) 3.3. Một hồ chứa nước thải sinh hoạt bị nhiễm ammonium (NH4+), gây ra hiện tượng phú dưỡng. Nồng độ NH4+ là 30 mg/L. Hồ có thể tích 4000 m³. Để xử lý nước, người ta sử dụng nước vôi trong để chuyển hóa NH4+ thành khí NH3, sau đó sử dụng khí chlorine để oxi hóa NH3 thành N2. Biết có 90% lượng NH4+ được xử lý bằng nước vôi và 85% lượng NH3 được oxi hóa bằng Cl2.
a) Xác định khối lượng khí chlorine cần thiết để oxi hóa NH₃ thành N₂.
b) Theo quy chuẩn kỹ thuật quốc gia về nước thải sinh hoạt với nồng độ NH4+ không được vượt quá 5 mg/L Xác định nồng độ NH4+ trong hồ sau khi xử lý và cho biết sau quá trình xử lý, nồng độ NH4+ đã đạt tiêu chuẩn môi trường chưa?
Câu 4. (3,0 điểm):
(Xem giải) 4.1. Stilbene là hydrocarbon thơm có công thức phân tử C14H12, phân tử có 2 vòng benzene không có chung các nguyên tử carbon. Stilbene tác dụng được với bromine trong nước tạo ra dẫn xuất dibromo, tác dụng với HCl trong điều kiện thích hợp tạo thành dẫn xuất monochloro duy nhất.
a) Viết công thức cấu tạo của và cho biết stilbene có đồng phân hình học không? Nếu có, hãy viết công thức các đồng phân đó.
b) Viết các phương trình hóa học xảy ra khi cho stilbene lần lượt tác dụng với: Br2 (trong nước), HCl, dung dịch KMnO4 loãng (ở nhiệt độ thường).
(Xem giải) 4.2. Mẫu hóa chất A là hỗn hợp benzoic acid và phenol. Để xác định hàm lượng benzoic acid trong mẫu trên người ta cân chính xác 10,00 gam A cho vào dung dịch NaHCO3 dư, lắc kỹ một thời gian, sau đó để yên rồi tách riêng phần dung dịch và phần hữu cơ không tan. Cho phần dung dịch vào phễu chiết, thêm dung dịch HCl dư, làm lạnh hỗn hợp và thêm tiếp 10 mL hexane (D = 0,66 g/mL) vào và lắc đều. Để yên phễu chiết để hỗn hợp phân thành 2 lớp, loại bỏ lớp dung dịch phía dưới chỉ chứa các chất vô cơ, lớp chất hữu cơ phía trên đem cân lại nặng 9,18 gam.
a) Viết các phương trình hóa học xảy ra.
b) Trong phép phân tích trên, có thể thay NaHCO3 bằng Na2CO3 được không? Vì sao?
c) Tính thành phần % theo khối lượng của benzoic acid trong hỗn hợp A.
Câu 5. (2,0 điểm):
(Xem giải) 5.1. Khi đun nóng magnesium kim loại với khí nitrogen tạo thành hợp chất A màu xám nhạt. A phản ứng với nước sinh ra kết tủa B và khí C. Khí C phản ứng với sodium hypochlorite thu được chất lỏng D không màu (phân tử khối lớn hơn 20 amu). Khí C cũng có khả năng phản ứng với carbon dioxide thu được tinh thể E. Trong đất E biến đổi dần thành F. Xác định các chất và viết phương trình phản ứng.
(Xem giải) 5.2. Cho a mol chất X (C7H6O3, chứa vòng benzene) tác dụng tối đa với 3a mol NaOH trong dung dịch, thu được a mol muối Y; a mol muối Z và 2a mol H2O. Xác định các công thức cấu tạo có thể có của X thỏa mãn điều kiện trên?
(Xem giải) 5.3. Một nhà máy sản xuất cồn sinh học xử lý 2,00 tấn mùn cưa (chứa 50% cellulose) bằng acid và sử dụng enzyme cellulase để phân giải cellulose thành monosacchride. Lên men monosacchride bởi nấm men (saccharomyces cerevisiae) để chuyển hóa thành ethanol. Hiệu suất cả quá trình đạt 75%.
a) Viết phương trình hóa học xảy ra.
b) Sau quá trình trên thu được bao nhiêu tấn ethanol?
(Xem giải) Câu 6. (2,0 điểm):
Methyl butanoate có mùi thơm của trái cây nên thường được sử dụng trong công nghiệm sản xuất bánh kẹo, nước giải khát…. Trong phòng thí nghiệm, methyl butanoate được tổng hợp bằng cách đun nóng hỗn hợp gồm methanol, butanoic acid và sulfuric acid đặc trong bình cầu chịu nhiệt ở điều kiện thích hợp. Sau một thời gian thu được hỗn hợp E gồm alcohol, acid, ester và nước. Biết một số tính chất vật lí của các chất trong hỗn hợp E như sau:
| Chất | Khối lượng riêng ở 25°C (g.mL-1) | Độ tan ở 25°C (g/100g nước) | Nhiệt độ sôi (°C) |
| H2O | 1,00 | 100 | |
| CH3OH | 0,79 | ∞ | 78 |
| CH3CH2CH2COOH | 0,96 | ∞ | 163,5 |
| CH3CH2CH2COOCH3 | 0,89 | 1,4 | 102 |
a) Viết phương trình hóa học xảy ra.
b) Để yên bình cầu một thời gian, hỗn hợp bị phân thành 2 lớp. Hãy cho biết thành phần các chất trong mỗi lớp?
c) Để tách methyl butanoate ra khỏi hỗn hợp E, sử dụng phương pháp chiết hay phương pháp chưng cất sẽ phù hợp hơn? Vì sao?
d) Trong thực tế, người ta thường thêm vào hỗn hợp E dung dịch NaCl bão hòa. Hãy cho biết mục đích của việc làm này và nêu rõ vai trò của NaCl?

Bình luận