[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Bà Rịa Vũng Tàu
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 044-H12A năm 2024-2025
⇒ Thời gian làm bài: 90 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1C | 2B | 3B | 4A | 5B | 6A | 7C | 8B | 9A | 10C |
| 11B | 12C | 13C | 14D | 15D | 16B | 17C | 18D | 19D | 20A |
| 21B | 22D | 23B | 24B | 25B | 26B | 27D | 28D | 29C | 30D |
| 31B | 32D | 33B | 34A | 35A | 36B | 37D | 38D | 39D | 40C |
| 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | |
| (a) | Đ | S | Đ | Đ | S | S | S | Đ |
| (b) | Đ | Đ | S | Đ | Đ | S | Đ | S |
| (c) | S | S | Đ | Đ | Đ | S | Đ | Đ |
| (d) | S | Đ | S | S | Đ | S | S | Đ |
| 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 |
| 84 | 1235 | 3 | 7 | 3 | 0,85 | 12 | 400 |
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 40 (10 điểm). Mỗi câu hỏi thí sinh chỉ chọn 1 phương án.
(Xem giải) Câu 1: Cho các polymer sau đây: nylon-6,6, tơ olon, polyisoprene, poly(vinyl chloride), cao su buna, poly(urea-formaldehyde). Số polymer được điều chế bằng phản ứng trùng ngưng là
A. 3. B. 5. C. 2. D. 4.
(Xem giải) Câu 2: Thí nghiệm nào sau đây thu được muối iron (II)?
A. Đốt dây Fe dư trong khí Cl2.
B. Cho bột Fe dư vào dung dịch KHSO4.
C. Cho bột Fe3O4 vào dung dịch H2SO4 đặc, nóng, dư.
D. Cho bột Mg dư vào dung dịch FeCl3.
(Xem giải) Câu 3: Cho các amine: CH3NHCH3 (X1); (CH3)3N (X2); CH3CH2NH2 (X3), với các giá trị nhiệt độ sôi của chúng (được sắp xếp ngẫu nhiên) là 3°C; 7°C; 17°C. Phát biểu nào sau đây sai?
A. Nhiệt độ sôi của X2 là 3°C.
B. X1 có nhiệt độ sôi cao hơn X3 do tạo được liên kết hydrogen bền hơn.
C. X3 tan tốt trong nước do tạo được liên kết hydrogen với nước.
D. Tên thay thế của X1 là N-methylmethanamine.
(Xem giải) Câu 4: Cho các cân bằng sau:
(1) 2SO2(g) + O2(g) ⇋ 2SO3(g)
(2) H2(g) + I2(g) ⇋ 2HI(g)
(3) N2(g) + 3H2(g) ⇋ 2NH3(g)
(4) H2O(g) + C(s) ⇋ H2(g) + CO(g)
Số cân bằng không bị chuyển dịch khi tăng áp suất khí của hệ là
A. 1. B. 2. C. 4. D. 3.
(Xem giải) Câu 5: Trong quá trình chuyển hóa lipid trong cơ thể (thành phần chính là triglyceride), các triglyceride được thủy phân thành các chất nhỏ hơn là glycerol và các acid béo, sau đó các chất này được sử dụng cho nhiều mục đích khác nhau trong cơ thể. Triglyceride X có công thức cấu tạo như hình sau:
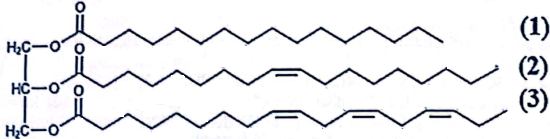
Cho các phát biểu sau:
(a) X có gốc hydrocarbon lớn, do đó khi để lâu ngoài không khí không bị oxi hóa bởi oxygen.
(b) Công thức phân tử của X là C57H98O6.
(c) Acid béo có gốc kí hiệu (3) thuộc loại acid béo omega-3.
(d) Đun nóng X với dung dịch NaOH đặc hoặc KOH đặc, thu được sản phẩm có tính chất giặt rửa.
(e) Các gốc acid béo không no trong phân tử X đều có cấu hình dạng cis-.
(g) Trong điều kiện thích hợp, X có thể phản ứng với hydrogen tạo thành chất béo chứa gốc acid béo no.
Số phát biểu đúng là
A. 5. B. 4. C. 3. D. 2.
(Xem giải) Câu 6: Để phân biệt ba hợp chất: HCHO, CH3CHO, CH3COCH3, một học sinh tiến hành thí nghiệm thu được kết quả như sau:
| Thuốc thử | 1 | 2 | 3 |
| Tollens | ✓ | ✕ | ✓ |
| I2/NaOH | ✕ | ✓ | ✓ |
(Ghi chú: ✓: có phản ứng; ✕: không phản ứng). Ba chất (1), (2), (3) lần lượt là
A. HCHO, CH3COCH3, CH3CHO. B. CH3CHO, HCHO, CH3COCH3.
C. CH3CHO, CH3COCH3, HCHO. D. HCHO, CH3CHO, CH3COCH3.
(Xem giải) Câu 7: Stilbene (kí hiệu là S) là hydrocarbon thơm có công thức phân tử C14H12, phân tử có 2 vòng benzene không có chung các nguyên tử carbon. Khi cho S tác dụng với HBr thu được chất có một cấu tạo duy nhất. Phát biểu nào sau đây đúng?
A. S không có đồng phân hình học.
B. S có phản ứng thế với dung dịch AgNO3 trong NH3.
C. Khi oxi hóa S bằng dung dịch KMnO4/H2SO4, đun nóng thu được benzoic acid.
D. Trong phân tử S, hai vòng benzene liên kết với nhau qua nhóm CH2.
(Xem giải) Câu 8: Trong phòng thí nghiệm, phản ứng xà phòng hóa chất béo được một nhóm học sinh tiến hành như sau:
Bước 1: Cho vào bát sứ 2 mL dầu ăn và 5 mL dung dịch NaOH.
Bước 2: Đun hỗn hợp sôi nhẹ và liên tục khuấy đều.
Bước 3: Sau 10 phút, ngừng đun, để nguội. Thêm 5 mL dung dịch NaCl bão hòa vào, khuấy nhẹ. Để yên và quan sát.
Kết thúc thí nghiệm, nhóm học sinh đó đã ghi lại những phát biểu:
(1) Thay dầu ăn bằng mỡ động vật thì phản ứng vẫn xảy ra tương tự.
(2) Dung dịch NaCl bão hòa dẫn nhiệt tốt nên được dùng để tăng hiệu suất phản ứng xà phòng hóa chất béo.
(3) Có thể thay dung dịch NaCl bão hòa bằng dung dịch CaCl2 bão hòa cũng có tác dụng tương tự.
(4) Liên tục khuấy đều để tăng khả năng tiếp xúc của chất béo với oxygen trong không khí, giúp phản ứng xảy ra nhanh hơn.
Số phát biểu đúng là
A. 2. B. 1. C. 4. D. 3.
(Xem giải) Câu 9: Cho luồng khí CO dư qua hỗn hợp các oxide CuO, Fe2O3, Al2O3, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn thu được gồm
A. Cu, Fe, Al2O3, MgO. B. Cu, Fe, Al, Mg.
C. Cu, FeO, Al2O3, MgO. D. Cu, Fe, Al, MgO.
(Xem giải) Câu 10: Phương trình hóa học nào dưới đây viết không đúng sản phẩm chính của phản ứng?
A. C6H5CH3 + Br2 (t°, Fe, 1 : 1) → p-CH3C6H4Br + HBr
B. CH3CH2CH2CH3 + Cl2 (askt, 1 : 1) → CH3CH2CHClCH3 + HCl
C. CH3-CH2-C≡CH + H2O (t°, HgSO4) → CH3CH2CH2CHO
D. CH3CH2CH=CH2 + HCl → CH3CH2CHClCH3
(Xem giải) Câu 11: Trong một bình kín có cân bằng hóa học sau: 2NO2(g) ⇋ N2O4(g). Tỉ khối hơi của hỗn hợp khí trong bình so với H2 ở nhiệt độ T1 bằng 27,6 và ở nhiệt độ T2 bằng 34,5. Biết T1 > T2. Phát biểu nào sau đây về cân bằng trên là đúng?
A. Khi giảm nhiệt độ, áp suất chung của hệ cân bằng tăng.
B. Phản ứng thuận là phản ứng tỏa nhiệt.
C. Khi tăng nhiệt độ, áp suất chung của hệ cân bằng giảm.
D. Phản ứng nghịch là phản ứng tỏa nhiệt.
(Xem giải) Câu 12: Cho ester X có công thức phân tử C8H8O2 (chứa vòng benzene). Phát biểu đúng là
A. Trong phân tử của X có độ bất bão hòa k bằng 4 (k bằng tổng số liên kết π và số vòng).
B. Phần trăm khối lượng carbon trong X bằng khoảng 60,59%.
C. Có 6 công thức cấu tạo phù hợp với X.
D. Có 3 ester của X phản ứng với dung dịch NaOH tạo thành alcohol.
(Xem giải) Câu 13: Noredrenaline là hormone quan trọng được sử dụng khá phổ biến trong y học nhờ chức năng cấp cứu tim mạch. Noredrenaline có công thức cấu tạo như sau:
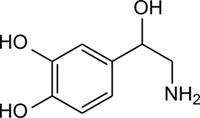
Khối lượng phân tử (theo đơn vị amu) của Noredrenaline là
A. 153. B. 155. C. 169. D. 168.
(Xem giải) Câu 14: Cho các chất: CaO, NH4Cl, Ca(H2PO4)2, NaCl, Ca(OH)2, (NH4)2SO4. Có bao nhiêu chất được sử dụng để khử chua đất nông nghiệp?
A. 1. B. 4. C. 3. D. 2.
(Xem giải) Câu 15: Trong phòng thí nghiệm, ethyl acetate được điều chế từ acetic acid và ethanol, xúc tác H2SO4 đặc, theo mô hình thí nghiệm sau:
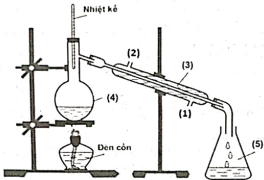
Biết nhiệt độ trong bình cầu (4) giữ ở mức 65-70°C, nhiệt độ trong ống sinh hàn (3) duy trì ở 25°C. Sau thí nghiệm, tiến hành phân tách sản phẩm. Ghi phổ hồng ngoại của acetic acid, ethanol và ethyl acetate. Cho biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng ngoại như sau:
| Liên kết | O-H (alcohol) | O-H (carboxylic acid) | C=O (ester, carboxylic acid) |
| Số sóng (cm-1) | 3650 – 3200 | 3300 – 2500 | 1780 – 1650 |
Phát biểu nào sau đây không đúng?
A. Chất lỏng trong bình hứng (5) có ethyl acetate.
B. Dựa vào phổ hồng ngoại, có thể phân biệt được acetic acid, ethanol và ethyl acetate.
C. Vai trò của ống sinh hàn (3) để ngưng tụ hơi, nước vào ở (1) và nước ra ở (2).
D. Nhiệt độ phản ứng ở bình cầu (4) càng cao thì phản ứng điều chế ethyl acetate xảy ra càng nhanh.
(Xem giải) Câu 16: Tiến hành sản xuất 1 triệu chai rượu vang 13,8° dung tích 750 mL bằng phương pháp lên men rượu với nguyên liệu là m tấn quả nho tươi (chứa 15% glucose về khối lượng). Biết khối lượng riêng của ethyl alcohol là 0,8 g/mL. Giả thiết trong thành phần quả nho tươi chỉ có glucose bị lên men rượu; hiệu suất toàn bộ quá trình sản xuất là 60%. Giá trị của m là
A. 1500. B. 1800. C. 3000. D. 2000.
(Xem giải) Câu 17: Sự phụ thuộc của độ tan khí ammonia trong nước vào nhiệt độ được mô tả ở hình dưới đây. Một nhóm học sinh quan sát đồ thị và ghi lại các phát biểu sau, phát biểu nào không đúng?

A. Ở nhiệt độ thường, khí ammonia tan nhiều trong nước.
B. Ở 30°C, độ tan của ammonia khoảng 40 gam NH3/100 gam nước.
C. Ở nhiệt độ cao hơn, ammonia bị phân hủy tạo N2 và H2 nhiều hơn dẫn đến độ tan giảm.
D. Ở 70°C độ tan của ammonia đã giảm khoảng 75% so với 30°C.
(Xem giải) Câu 18: Ở điều kiện chuẩn, cho bột Cu dư vào dung dịch Fe2(SO4)3 tới khi phản ứng hoàn toàn, thu được chất rắn X và dung dịch Y. Biết E°Fe2+/Fe = -0,44V; E°Cu2+/Cu = +0,34V; E°Fe3+/Fe2+ = +0,771V. Phát biểu nào sau đây sai?
A. Cu có tính khử mạnh hơn Fe2+ ở điều kiện chuẩn.
B. Trong điều kiện Fe2(SO4)3 dư thì Y gồm ba muối.
C. Y gồm hai chất tan là CuSO4 và FeSO4.
D. X gồm hai kim loại.
(Xem giải) Câu 19: Trong pin nhiên liệu hydrogen, H2 có vai trò tương tự như kim loại mạnh hơn trong pin Galvani. Quá trình nào sau đây diễn ra ở điện cực dương khi pin nhiên liệu hydrogen hoạt động?
A. H2 → 2H+ + 2e. B. 2H2 + O2 → 2H2O.
C. 2H+ + 2e → H2. D. O2 + 4H+ + 4e → 2H2O.
(Xem giải) Câu 20: Sau khi nung chảy 36 gam magnesium (nhiệt độ nóng chảy: 651°C) với 62,1 gam chì (nhiệt độ nóng chảy: 327°C) trong chân không sẽ thu được một hợp kim Mg-Pb, trong đó có chứa hợp chất X. Biết hợp chất X có phần trăm khối lượng của magnesium là 18,8% và nhiệt độ nóng chảy 680°C. Phần trăm khối lượng của X trong hợp kim là
A. 77,98%. B. 70,64%. C. 81,20%. D. 36,70%.
(Xem giải) Câu 21: Cho biết: E°Fe2+/Fe = -0,44V; E°Cu2+/Cu = +0,34V. Sức điện động chuẩn của pin điện hóa Fe-Cu là
A. 0,100V. B. 0,78V. C. 0,920V. D. 1,660V.
(Xem giải) Câu 22: Trong quả bồ kết có saponin. Chất này có tính chất giặt rửa. Cho 20 quả bồ kết vào nồi và thêm 1 lít nước, đun sôi nhỏ lửa khoảng 30 phút tới khi được dung dịch có màu nâu sẫm. Cho các phát biểu sau:
(1) Dung dịch thu được có tính chất giặt rửa và được gọi là chất giặt rửa tự nhiên.
(2) Khi tiếp xúc với nước, saponin tạo ra lớp bọt nhẹ tương tự xà phòng.
(3) Thành phần chính của chất giặt rửa tự nhiên tương tự với chất giặt rửa tổng hợp.
(4) Đặc điểm chung của các chất giặt rửa là phân tử luôn có phần ưa nước và phần kị nước giống như các muối của acid béo trong xà phòng.
(5) Quy trình chế tạo nước giặt rửa từ quả bồ kết là phương pháp chiết lỏng – lỏng.
Số phát biểu đúng là
A. 2. B. 5. C. 4. D. 3.
(Xem giải) Câu 23: Cho các chất: phenol, tristearin, glycerol, saccharose (được kí hiệu ngẫu nhiên là X, Y, Z, T) với các tính chất vật lý được ghi trong bảng sau:
| Chất | X | Y | Z | T |
| Nhiệt độ nóng chảy °C | 185 | 43 | 54 – 73 | 18 |
| Tính tan trong nước ở 25°C | Tan tốt | Ít tan | Không tan | Tan tốt |
Nhận xét nào sau đây sai?
A. Y tan nhiều trong nước nóng. B. T có phản ứng thủy phân.
C. Thủy phân Z thu được glycerol. D. X có chứa một liên kết glycoside.
(Xem giải) Câu 24: Sodium azide (NaN3) là một hợp chất dễ bị phân huỷ. Hỗn hợp chất rắn gồm NaN3, KNO3 và SiO2 được sử dụng để nhanh chóng tạo ra một lượng đủ lớn khí nitrogen trong các túi khí an toàn trên ô tô. Khi bị va đập mạnh, các chất trên sẽ nhanh chóng phản ứng tạo ra khí nitrogen, làm căng đầy túi khí an toàn. Các phản ứng xảy ra được biểu diễn theo các sơ đồ sau:
NaN3 → Na + N2
Na + KNO3 → K2O + Na2O + N2
K2O + Na2O + SiO2 → K2SiO3 + Na2SiO3
Nếu lấy 52 gam NaN3 (các hoá chất khác coi như đã lấy đủ) thì tạo ra được bao nhiêu lít khí nitrogen (đkc) cho túi khí an toàn?
A. 39,6640. B. 31,7312. C. 29,7480. D. 21,8152.
(Xem giải) Câu 25: Trong phản ứng sau đây: NH3(aq) + H2O(l) ⇋ NH4+(aq) + OH- (aq); những chất đóng vai trò là base theo thuyết Bronsted – Lowry là
A. H2O và NH4+. B. NH3 và OH-. C. H2O và OH-. D. NH3 và NH4+.
(Xem giải) Câu 26: Khí X không màu có mùi đặc trưng, khi cháy trong khí oxygen tạo nên khí Y không màu, không mùi. Khí Y có thể tác dụng với lithium (Li) kim loại ở nhiệt độ thường tạo ra chất rắn Z. Hoà tan chất rắn Z vào nước được chất X và dung dịch E. Khí X tác dụng với khí F trong điều kiện thích hợp tạo ra chất rắn G. Chất rắn G tác dụng với dung dịch HCl dư thấy sủi bọt khí. Phát biểu nào sau đây đúng?
A. Khí Y có thể làm mất màu dung dịch Br2.
B. Chất G tác dụng với nước vôi trong, đun nóng nhẹ tạo thành kết tủa trắng và khí X.
C. Dung dịch E làm quì tím hóa đỏ.
D. Khí F là chất khử được sử dụng trong luyện kim.
(Xem giải) Câu 27: Cho sơ đồ phản ứng sau, các chất phản ứng theo đúng tỉ lệ mol:
(1) X + H2O (enzyme) → Y
(2) 2Y + Cu(OH)2 → T + 2H2O
(3) X + 3nHNO3 (H2SO4 đặc) → Z + 3nH2O
(4) Y (enzyme) → 2Q
Biết rằng các chất X, Y, T, Q đều chứa nhóm –OH, chất Z có tính nổ mạnh, nhạy với va đập, ma sát và nhiệt. Cho các phát biểu sau:
(a) Phản ứng (1) có thể thay enzyme bằng dung dịch H2SO4 70%, đun nóng.
(b) Phản ứng (2) chứng tỏ chất Y có tính chất của một polyalcohol.
(c) Chất Q có thể tham gia phản ứng trùng ngưng.
(d) Chất X là polymer tự nhiên.
(e) Chất X không tan trong nước lạnh, tan một phần trong nước nóng.
Số phát biểu đúng là
A. 5. B. 2. C. 3. D. 4.
(Xem giải) Câu 28: Cho cấu tạo của một đoạn mạch trong phân tử polymer X như sau: …-CH2-CH2-CH2-CH2-… Tên của X là
A. polybutene. B. polymethylene. C. polyethane. D. polyethylene.
(Xem giải) Câu 29: Cho sơ đồ chuyển hóa:
![]()
Trong sơ đồ trên, các chất X, Y, Z lần lượt là
A. maltose, ammonium gluconate, gluconic acid.
B. fructose, ammonium gluconate, gluconic acid.
C. glucose, ammonium gluconate, gluconic acid.
D. saccharose, ammonium gluconate, gluconic acid.
(Xem giải) Câu 30: Cho chất hữu cơ E có công thức phân tử C9H8O4, E thỏa mãn sơ đồ phản ứng theo đúng tỉ lệ mol như sau:
(1) E + 3NaOH → 2X + Y + H2O
(2) 2X + H2SO4 → Na2SO4 + 2Z
(3) Z + 2[Ag(NH3)2]OH → T + 2Ag + 2NH3 + H2O
(4) Y + HCl → F + NaCl.
Phát biểu nào sau đây sai?
A. Chất F tác dụng với kim loại Na thu được số mol H2 bằng số mol F.
B. Chất T tác dụng được với dung dịch HCl và dung dịch NaOH.
C. Dung dịch chất Y tác dụng được với khí CO2.
D. Chất E chứa đồng thời nhóm chức acid (-COOH) và chức ester (-COO-).
(Xem giải) Câu 31: Hỗn hợp X gồm ethylene và propylene với tỉ lệ mol tương ứng là 3 : 2. Hydrate hóa hoàn toàn X (xúc tác acid, t°C) thu được ba chất hữu cơ, trong đó dẫn xuất có nhóm -OH đính vào carbon bậc II chiếm 28% tổng số mol. Phần trăm số mol propylene cộng nước tạo sản phẩm ưu tiên theo quy tắc Markovnikov là
A. 40. B. 70. C. 30. D. 60.
(Xem giải) Câu 32: Thực hiện các thí nghiệm sau:
(1) Đốt dây nhôm trong bình khí oxygen.
(2) Cho đinh thép sạch vào dung dịch H2SO4 loãng.
(3) Cho thanh sắt vào dung dịch CuSO4.
(4) Nối dây nhôm với dây đồng rồi để trong không khí ẩm.
Số thí nghiệm có xảy ra ăn mòn điện hóa học là
A. 4. B. 2. C. 1. D. 3.
(Xem giải) Câu 33: Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy?
A. Zn. B. Al. C. Cu. D. Fe.
(Xem giải) Câu 34: Cho bảng số liệu sau:
| Chất | Nước (H2O) | Hydrogen sulfide (H2S) |
| Nhiệt độ sôi (°C) ở 1 atm | 100,0 | -60,7 |
Phát biểu nào sau đây sai?
A. Liên kết O-H trong phân tử H2O phân cực kém hơn liên kết S-H trong phân tử H2S.
B. Số liên kết trong phân tử H2O bằng số liên kết trong phân tử H2S.
C. Trong phân tử H2O và phân tử H2S chỉ có các liên kết cộng hóa trị.
D. Do có liên kết hydrogen giữa các phân tử nên nước có nhiệt độ sôi cao hơn hydrogen sulfide.
(Xem giải) Câu 35: Hydrogen sulfide (H2S) là một chất khí không màu, mùi trứng thối, độc. Theo tài liệu của Cơ quan Quản lí an toàn và sức khoẻ nghề nghiệp Hoa Kỳ, nồng độ H2S khoảng 100 ppm gây kích thích màng phổi. Nồng độ khoảng 400 – 700 ppm, H2S gây nguy hiểm đến tính mạng chỉ trong 30 phút. Nồng độ trên 800 ppm gây mất ý thức và làm tử vong ngay lập tức. Xác định nồng độ của H2S theo ppm và đánh giá mức độ độc hại trong một gian phòng trống có kích thước rộng 4,0m – cao 2,8m – dài 5,0m, bị nhiễm 8,5 gam khí H2S (ở 25°C và áp suất bằng 1 bar) biết nồng độ ppm (parts per million) là thành phần phần triệu về thể tích của HS trong không khí.
A. 110,67 ppm; có nguy cơ gây kích thích màng phổi.
B. 123,95 ppm; có nguy cơ gây kích thích màng phổi.
C. 1239,5 ppm; gây mất ý thức và làm tử vong ngay lập tức.
D. 495,80 ppm; có nguy cơ gây hại đến tính mạng.
(Xem giải) Câu 36: Hình ảnh dưới đây mô tả một đoạn cấu tạo trong phân tử chất nào?
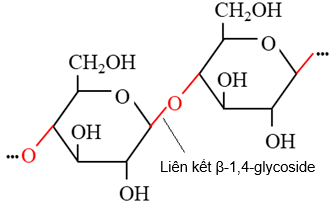
A. Maltose. B. Cellulose. C. Amylose. D. Amylopectin.
(Xem giải) Câu 37: Hợp chất X là đồng đẳng của benzene. Trong phân tử X, phần trăm khối lượng carbon bằng 90,57%. Khi phản ứng với bromine (tỉ lệ mol 1 : 1, xúc tác bột sắt, đun nóng), X tạo ra một sản phẩm hữu cơ duy nhất. Tên của X là
A. 1,3,5-trimethylbenzene. B. 1,3-dimethylbenzene.
C. ethylbenzene. D. 1,4-dimethylbenzene.
(Xem giải) Câu 38: Để bảo vệ vỏ tàu biển làm bằng thép theo phương pháp điện hóa, người ta thường gắn vào vỏ tàu (phần ngâm dưới nước) những tấm kim loại nào sau đây?
A. Sn. B. Pb. C. Cu. D. Zn.
(Xem giải) Câu 39: Trong pin Galvani X-Y có phản ứng chung là: X(s) + Y2+(aq) → Y(s) + X2+(aq). Quá trình xảy ra tại anode (hay cực âm) của pin là
A. X2+(aq) + 2e → X(s). B. Y2+(aq) + 2e → Y(s).
C. Y(s) → Y2+(aq) + 2e. D. X(s) → X2+(aq) + 2e.
(Xem giải) Câu 40: Cho các chất: keratin, ethylamine, hemoglobin, aniline (được kí hiệu ngẫu nhiên là X, Y, Z, T) với kết quả thí nghiệm như sau:
| Mẫu thử | Thuốc thử | Hiện tượng |
| X | Dung dịch phenolphthalein | Dung dịch màu hồng |
| Y | H2O | Vẩn đục |
| Z | H2O | Không tan |
| T | H2O | Tan tạo dung dịch keo |
Cho các phát biểu sau:
(1) Chất X tác dụng với nitrous acid ở nhiệt độ thường tạo thành ethanol và giải phóng khí N2.
(2) Chất Y là aniline xuất hiện peak của ion phân tử [M+] có giá trị m/z = 93 trên phổ MS.
(3) Chất Z là một loại protein dạng hình cầu.
(4) Chất T là một loại protein, có chức năng vận chuyển oxygen từ phổi đến các cơ quan khác nhau của cơ thể.
Số phát biểu không đúng là
A. 2. B. 1. C. 3. D. 4.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 41 đến câu 48. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 41: Thủy phân hoàn toàn peptide X mạch hở, thu được muối Y, Z của các α-aminoacid (no, mạch hở, chỉ chứa một nhóm amino) theo phản ứng:
X + 11NaOH → 3Y + 4Z + 5H2O
a) X chứa 7 nguyên tử N trong phân tử.
b) Z chứa 2 gốc carboxylate.
c) Y có công thức dạng H2N-R-COOH.
d) X chứa 13 nguyên tử O trong phân tử.
(Xem giải) Câu 42: Sodium được sản xuất trong công nghiệp bằng cách điện phân muối ăn ở trạng thái nóng chảy ở nhiệt độ khoảng 800°C. Sơ đồ bình điện phân được mô tả như hình sau:
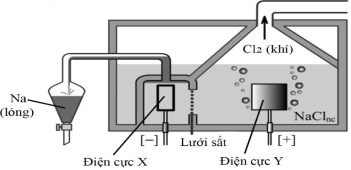
a) Trong quá trình sản xuất sodium, người ta sử dụng điện cực X làm bằng than chì, điện cực Y làm bằng kim loại Fe.
b) Hệ thống ống dẫn sodium và bình thu sodium nóng chảy luôn được đặt trong môi trường khí trơ.
c) Hệ thống thu kim loại sodium được lắp đặt phía trên bề mặt bình điện phân do sodium thu được ở thể lỏng.
d) Với một quy mô sản xuất ở mức trung bình, người ta dùng cường độ dòng điện là 9000 A thì sau 1,0 giờ sản xuất được xấp xỉ 6,18 kg sodium (hiệu suất tổng thể của cả quá trình đạt 80%, cho hằng số Faraday F = 96500 C/mol)
(Xem giải) Câu 43: Các nghiên cứu sâu hơn về cấu tạo cho biết glucose có một dạng mạch hở và hai dạng mạch vòng (α-glucose và β-glucose) chuyển hóa qua lại lẫn nhau như hình dưới:
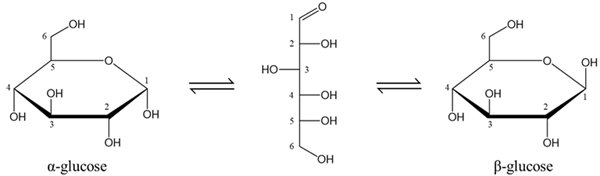
a) Ở dạng mạch hở, phân tử glucose có năm nhóm hydroxy và một nhóm aldehyde, với công thức cấu tạo là HOCH2[CHOH]4CH=O.
b) Nhóm -OH ở vị trí carbon số 6 trong glucose dạng mạch vòng gọi là –OH hemiacetal.
c) Nhóm -OH hemiacetal của glucose tác dụng với methanol khi có mặt của HCl khan tạo thành methyl glucoside, chứng tỏ glucose có cấu tạo mạch vòng.
d) Hai dạng α-glucose và β-glucose phản ứng trực tiếp với thuốc thử Tollens (đun nóng) tạo thành ammonium gluconate.
(Xem giải) Câu 44: Lysine (kí hiệu HB) là một trong những amino acid thiết yếu có nhiều trong thịt, sữa, cá, trứng nhưng lại có rất ít trong bánh mì và gạo.
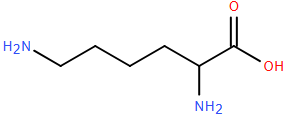
Lysine ở dạng H3B2+ có hằng số phân li acid pKa1 = 2,18; pKa2 = 8,95; pKa3 = 10,53.
a) Dung dịch lysine làm quì tím hóa xanh.
b) Trong dung dịch có pH = 2, đặt trong một điện trường, lysine sẽ di chuyển về cực âm.
c) Trong dung dịch có pH = 5,5 thì lysine tồn tại chủ yếu ở dạng +H3N-[CH2]-CH(NH3+)-COO-.
d) Trong dung dịch có pH = 9,7 thì lysine tồn tại chủ yếu ở dạng H2N-[CH2]4-CH(NH3+)-COO-.
(Xem giải) Câu 45: Trong công nghiệp hiện nay, PVC được sản xuất từ ethylene và chlorine, người ta thực hiện quy trình sản xuất khép kín ứng với các phản ứng (1), (2), (3), (4). Quy trình được mô tả theo sơ đồ sau:
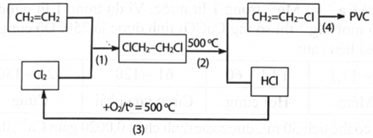
a) Các phản ứng (1), (2), (3), (4) đều là phản ứng oxi hóa khử.
b) Quy trình khép kín này giúp hạn chế chất thải ra môi trường và làm tăng hiệu suất của quá trình sản xuất.
c) Phản ứng (1) thuộc loại phản ứng cộng, phản ứng (2) thuộc loại phản ứng tách.
d) Dùng 1,152 tấn chlorine phản ứng thì thu được khoảng 2,0 tấn PVC biết lượng chlorine bị thất thoát là 1,40%
(Xem giải) Câu 46: Một học sinh tiến hành 2 thí nghiệm:
– Thí nghiệm 1: chuẩn độ dung dịch HCl bằng dung dịch NaOH.
– Thí nghiệm 2: chuẩn độ dung dịch CH3COOH bằng dung dịch NaOH.
Hóa chất: dung dịch HCl và dung dịch CH3COOH (cùng nồng độ mol/L); dung dịch NaOH 0,10M; chất chỉ thị acid-base phù hợp.
Dụng cụ: pipette, burette, bình tam giác.
Các bước tiến hành:
Bước 1: Dùng pipette lấy 10,0 mL dung dịch acid cho vào bình tam giác, nhỏ thêm 2 đến 3 giọt chất chỉ thị vào, lắc đều.
Bước 2: Lấy dung dịch NaOH 0,10M vào burette (loại 25 mL) và điều chỉnh dung dịch trong burette ở mức 0.
Bước 3: Mở khoá burette, nhỏ từ từ dung dịch NaOH vào bình tam giác đựng mẫu acid (lắc đều bình trong quá trình chuẩn độ), đến khi dung dịch chuyển màu đột ngột thì dừng lại, ghi thể tích dung dịch NaOH 0,10M trong burette đã dùng.
a) Để tránh sai số, cần tráng rửa dụng cụ trước khi tiến hành thí nghiệm như sau
| Dụng cụ | Dung dịch tráng lần 1 | Dung dịch tráng lần 2 |
| Pipette | nước cất | dung dịch acid cần chuẩn độ |
| Burette | nước cất | dung dịch NaOH |
| Bình tam giác | nước cất | dung dịch acid cần chuẩn độ |
b) Ở bước 1, sau khi cho mẫu acid vào bình tam giác, ở đầu pipette vẫn còn đọng lại 1 lượng nhỏ dung dịch. Để tránh thất thoát mẫu, ta dùng quả bóp cao su để đẩy hết phần thừa này vào bình tam giác.
c) Do [H+] của dung dịch CH3COOH nhỏ hơn [H+] của dung dịch HCl, nên để đạt đến điểm tương đương, ở thí nghiệm 2 cần ít dung dịch NaOH hơn ở thí nghiệm 1.
d) Với cả hai thí nghiệm, để xác định đúng điểm tương đương, chất chỉ thị acid-base phù hợp là methyl da cam (chuyển từ màu đỏ sang màu vàng khi pH tăng từ 3,1 đến 4,4).
(Xem giải) Câu 47: Phân tích nguyên tố hợp chất hữu cơ E cho kết quả phần trăm khối lượng carbon, hydrogen và oxygen lần lượt là 54,55%; 9,09% và 36,36%. Dựa vào phương pháp phân tích khối phổ (MS) xác định được phân tử khối của E là 88. Thuỷ phân hoàn toàn E trong dung dịch NaOH, thu được muối của carboxylic acid X và chất Y. Chất Y có nhiệt độ sôi (64,7°C) nhỏ hơn nhiệt độ sôi của ethanol (78,3°C) (nhiệt độ sôi đều đo ở áp suất 1 atm).
a) Dung dịch muối tạo bởi carboxylic acid X và NaOH có môi trường trung tính.
b) Nhiệt độ sôi của E, X và Y được sắp xếp theo thứ tự như sau: X > E > Y.
c) Chất E có thể được điều chế trực tiếp từ phản ứng ester hóa giữa chất Y với propanoic acid.
d) Trong công nghiệp, chất Y được phổi trộn với xăng RON 92 để tạo ra xăng sinh học.
(Xem giải) Câu 48: Cho hai chất hữu cơ mạch hở E, F có cùng công thức đơn giản nhất là C3H4O2. Các chất E, F, X, Z tham gia phản ứng theo đúng tỉ lệ mol như sơ đồ dưới đây:
(1) E + NaOH → X + Y
(2) F + NaOH → Z + T
(3) X + HCI → J + NaCl
(4) Z + HCl → G + NaCl
Biết: X, Y, Z, T, J, G là các chất hữu cơ, trong đó T đa chức; MT > 88 và ME < MF < 146.
a) J làm quì tím hóa đỏ.
b) Nung nóng chất rắn Z với hỗn hợp với tôi xút thu được khí ethylene.
c) E và F đều tạo kết tủa khi cho tác dụng với dung dịch AgNO3 trong NH3 dư.
d) Có 2 công thức cấu tạo thỏa mãn với chất F.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 49 đến câu 56.
(Xem giải) Câu 49: Một mẫu nước thải của nhà máy sản xuất có pH = 3. Để thải ra ngoài môi trường thì cần phải tăng pH lên từ 5,8 đến 8,6 (theo đúng qui định), nhà máy phải dùng vôi sống thải vào nước thải. Để nâng pH của 3 m³ nước thải từ 3 lên 7 cần dùng m gam vôi sống. Tính giá trị m. (Bỏ qua sự thủy phân của các muối, kết quả làm tròn đến hàng đơn vị)
(Xem giải) Câu 50: NH4HCO3 được dùng làm bột nở, còn gọi là bột khai, giúp bánh nở xốp, mềm. Khi đun nóng NH4HCO3 xảy ra phản ứng theo phương trình sau:
NH4HCO3(s) → NH3(g) + CO2(g) + H2O(g)
Cho biết nhiệt tạo thành chuẩn (kJ/mol) của các chất như sau:
| Chất | NH4HCO3(s) | NH3(g) | CO2(g) | H2O(g) |
| -849,4 | -46,11 | -393,5 | -241,82 |
(1) Phản ứng nhiệt phân muối NH4HCO3 thu nhiệt từ môi trường.
(2) Phản ứng làm nhiệt độ môi trường xung quanh hệ giảm xuống.
(3) Phải bảo quản ở nơi thoáng mát, tránh nhiệt độ cao.
(4) Nếu dùng 15 gam NH4HCO3 thì nhiệt lượng mà môi trường hấp thụ là 33,592 kJ.
(5) Biến thiên enthalpy chuẩn của phản ứng là +167,97 kJ.
Liệt kê các phát biểu đúng theo số thứ tự tăng dần.
(Xem giải) Câu 51: Biết thế điện cực chuẩn của các cặp oxi hóa – khử như sau:
| E°Ca2+/Ca | E°Mg2+/Mg | E°Al3+/Al | E°Zn2+/Zn | E°Fe2+/Fe | E°Cu2+/Cu | E°Ag+/Ag |
| -2,84V | -2,358V | -1,66V | -0,76V | -0,44V | +0,34V | +0,8V |
Cho kim loại X (hóa trị n) vào dung dịch FeSO4. Sau khi phản ứng xảy ra hoàn toàn, đem cân thấy khối lượng kim loại tăng.
(1) E°Xn+/X > -0,44V.
(2) Có thể thay thế FeSO4 bằng Fe(NO3)2 hoặc FeS.
(3) Nếu X là Cu thì sau khi phản ứng xảy ra hoàn toàn, đem cân thấy khối lượng kim loại giảm.
(4) Trong dãy kim loại: Al, Zn, Ag, Mg, Ba, có 2 kim loại có thể là kim loại X.
Có bao nhiêu phát biểu sai?
(Xem giải) Câu 52: Một quả cầu làm bằng sắt (iron) có bán kính 5 cm cần được mạ đồng (copper) để tăng khả năng chống ăn mòn và nâng cao thẩm mỹ. Lớp mạ phải đồng nhất và có độ dày là 2 μm. Người ta dùng phương pháp điện phần lượng dư dung dịch CuSO4 với cathode là quả cầu sắt và anode làm bằng đồng, cường độ dòng điện bằng I = 5A, hiệu suất của cả quá trình mạ là 80% . Thời gian cần thiết để mạ xong quả cầu trên là bao nhiêu phút, biết khối lượng riêng của Cu là 8,96 g/cm³, công thức tính thể tích hình cầu V = 4πr³/3 (Kết quả làm tròn đến hàng đơn vị; hằng số Faraday F = 96500 C/mol).
(Xem giải) Câu 53: Enzyme tripsine chủ yếu xúc tác cho phản ứng thủy phân liên kết peptide tạo bởi nhóm carboxyl của amino acid mà gốc R có tính base. Thủy phân peptide Val-Lys-Ala-Gly-Lys-Gly-Val-Lys-Gly-Lys-Val-Gly với xúc tác là enzyme tripsine thì có thể thu được tối đa bao nhiêu dipeptide?
(Xem giải) Câu 54: Carbon monoxide thay thế oxygen trong hemoglobin đã bị oxi hoá theo phản ứng:
HbO2(aq) + CO(aq) ⇋ HbCO(aq) + O2(aq)
Tại nhiệt độ trung bình trong cơ thể, hằng số cân bằng của phản ứng trên là Kc = 170.
Giả sử một hỗn hợp không khí bị ô nhiễm carbon monoxide ở mức 0,1% (theo thể tích). Coi không khí chứa 20,0% oxygen về thể tích; tỉ lệ oxygen và carbon monoxide hoà tan trong máu giống với tỉ lệ của chúng trong không khí. Cho biết tỉ lệ về nồng độ HbCO so với HbO2 trong máu là bao nhiêu? (Kết quả làm tròn đến hàng phần trăm)
(Xem giải) Câu 55: Kết quả phân tích thành phần của một muối sulfate ngậm nước (X) của kim loại M thu được kết quả như sau:
| Nguyên tố | M | O | S | H |
| Phần trăm về khối lượng | 23,26% | 55,81% | 18,60% | 2,325% |
Trong thành phần của X, nước chiếm 20,93% về khối lượng. Số nguyên tử trong một phân tử X là bao nhiêu?
(Xem giải) Câu 56: Một loại chất béo trung tính có chứa 89% tristearin về khối lượng (phần còn lại là tạp chất không phải ester). Để sản xuất 5000 bánh xà phòng cần dùng tối thiểu x kg loại chất béo trên cho phản ứng với dung dịch NaOH, đun nóng. Biết rằng trong mỗi bánh xà phòng nặng 100 gam và có chứa 73,44% muối sodium stearate. Tính giá trị của x. (Kết quả làm tròn đến hàng đơn vị).


Bình luận