[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Đồng Nai
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 058-H12B năm 2024-2025
⇒ Thời gian làm bài: 180 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1A | 2C | 3A | 4A | 5C | 6B | 7B | 8D | 9D |
| 10C | 11A | 12A | 13C | 14D | 15A | 16A | 17B | 18B |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
| (a) | Đ | Đ | S | S | 24,8 | 111 | 2018 |
| (b) | S | Đ | Đ | Đ | 26 | 27 | 28 |
| (c) | S | S | S | S | 230 | 39 | 5 |
| (d) | S | S | S | S |
I. PHẦN TRẮC NGHIỆM: (10,0 điểm)
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Trong quá trình điện phân, ở cực âm, chất nào có tính oxi hoá ..(1).. được ưu tiên điện phân trước. Ở cực dương, chất nào có tính khử ..(2).. được ưu tiên điện phân trước. Điện phân có nhiều ứng dụng quan trọng trong thực tiễn, như sản xuất kim loại ..(3).. bằng phương pháp điện phân hợp chất nóng chảy, mạ điện, ..(4).. bằng phương pháp điện phân dung dịch. Nội dung phù hợp trong các ô trống (1), (2), (3), (4) lần lượt là
A. mạnh hơn; mạnh hơn; mạnh; tinh chế kim loại.
B. yếu hơn; yếu hơn; mạnh; tinh chế kim loại.
C. mạnh hơn; mạnh hơn; yếu; tinh chế kim loại.
D. yếu hơn; mạnh hơn; yếu; tinh chế kim loại.
(Xem giải) Câu 2. Trong các chất sau: NaF, K2O, HCl, BaCl2, NH4NO3, NH4Cl, Al2O3, FeSO4, Sn(NO3)2, AgNO3, có tối đa bao nhiêu chất là hợp chất ion đơn nguyên tử?
A. 6. B. 8. C. 4. D. 10.
(Xem giải) Câu 3. Cho các yếu tố: (1) nhiệt độ; (2) áp suất; (3) nồng độ; (4) chất xúc tác. Yếu tố nào ảnh hưởng đến chuyển dịch cân bằng của phản ứng: N2(g) + 3H2(g) ⇋ 2NH3(g), ![]() < 0?
< 0?
A. (1), (2), (3). B. (1), (2), (3), (4).
C. (2), (3), (4). D. (1), (3), (4).
(Xem giải) Câu 4. Phương trình nào sau đây thể hiện đúng sự điện li của NaCl trong nước?
A. NaCl(s) → Na+(aq) + Cl-(aq). B. NaCl(l) → Na+(aq) + Cl-(aq).
C. NaCl(aq) → Na+(aq) + Cl-(aq). D. NaCl(aq) ⇌ Na+(aq) + Cl-(aq).
(Xem giải) Câu 5. Chọn phát biểu đúng
A. CH3CH2OH và CH3COOH không thể phân biệt được dựa vào phổ IR.
B. Benzene, acetylene, divinyl có cùng công thức đơn giản nhất.
C. Phenol dễ tham gia phản ứng thế hydrogen ở vòng benzene hơn toluene.
D. CH3CHO phản ứng với HCN là phản ứng thế.
(Xem giải) Câu 6. Số đồng phân cấu tạo amine bậc ba của C5H13N là bao nhiêu?
A. 8. B. 3. C. 5. D. 6.
(Xem giải) Câu 7. Trùng hợp monomer nào sau đây tạo polymer có tính đàn hồi dùng sản xuất cao su?
A. Vinyl chloride. B. Isoprene. C. Styrene. D. Acrylonitrile.
(Xem giải) Câu 8. Đồ thị hình bên dưới mô tả sự phụ thuộc giá trị nhiệt độ sôi vào số nguyên tử carbon của bốn loại hợp chất alkane, alcohol, aldehyde và carboxylic acid.
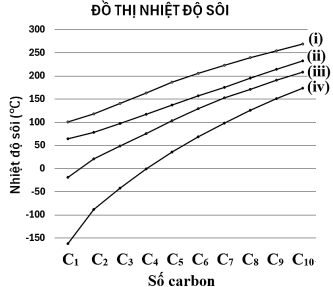
Đồ thị (i), (ii), (iii), (iv) lần lượt tương ứng với các loại hợp chất là:
A. Alkane, alcohol, aldehyde, carboxylic acid.
B. Alcohol, carboxylic acid, aldehyde, alkane.
C. Carboxylic acid, aldehyde, alcohol, alkane.
D. Carboxylic acid, alcohol, aldehyde, alkane.
(Xem giải) Câu 9. X tồn tại ở dạng ion lưỡng cực vì thế X ở thể rắn ở nhiệt độ phòng, dễ tan trong nước. X là chất nào sau đây?
A. Tristearin. B. Phenol. C. Aniline. D. Alanine.
(Xem giải) Câu 10. Pyrite được biết như là “khoáng sản vàng” và được gọi là “vàng của kẻ ngốc” vì nó trông giống vàng đối với mắt thường. Nhiều bộ phim các thợ đào vàng thường dùng răng để phân biệt “vàng của kẻ ngốc” hay vàng thật: nếu là vàng thật thì răng của họ sẽ làm nó bị lõm vào, còn nếu là “vàng của kẻ ngốc” thì sẽ vỡ vì tính giòn của nó. Đặc điểm của vàng thật mà những người khai thác quặng dùng để phán đoán là
A. tính ánh kim. B. mùi vị. C. tính dẻo. D. tính giòn.
(Xem giải) Câu 11. Khi tồn tại ở dạng mạch vòng, các carbohydrate có vị ngọt và có nhóm -OH hemiacetal hoặc -OH hemiketal trong phân tử được gọi là đường khử; ngược lại khi phân tử các chất này không có nhóm -OH hemiacetal hoặc -OH hemiketal, chúng được gọi là đường không có tính khử. Trong các đường saccharose, maltose, glucose, fructose, đường không có tính khử là
A. saccharose. B. glucose. C. maltose. D. fructose.
(Xem giải) Câu 12. Vật làm bằng gang, thép bị ăn mòn trong không khí ẩm. Cho các phát biểu sau về quá trình này:
(a) Dạng ăn mòn hoá học là chủ yếu, do sắt dễ dàng phản ứng với oxygen trong không khí.
(b) Ở cực carbon xảy ra quá trình khử oxygen.
(c) Oxygen đóng vai trò là chất oxi hoá.
(d) Tại anode, Fe bị oxi hoá thành Fe2+, Fe2+ bị oxi hoá tiếp thành Fe3+.
(e) Carbon đóng vai trò là cực âm (anode), sắt là cực dương (cathode) khi sự ăn mòn xảy ra.
Các phát biểu đúng là
A. (b), (c), (d). B. (a), (c), (d). C. (a), (b), (e). D. (a), (d), (e).
(Xem giải) Câu 13. Cho hai phương trình hoá học sau:
N2(g) + O2(g) → 2NO(g) ![]() = 180 kJ (1)
= 180 kJ (1)
2NO(g) + O2(g) → 2NO2(g) ![]() = -114 kJ (2)
= -114 kJ (2)
Năng lượng liên kết trong phân tử O2, N2 lần lượt là 498 kJ/mol và 946 kJ/mol. Cho các phát biểu:
(a) Phản ứng (1) là phản ứng thu nhiệt, phản ứng (2) là phản ứng toả nhiệt.
(b) Phản ứng (2) tạo NO2 từ NO, là quá trình thuận lợi về mặt năng lượng. Điều này cũng phù hợp với thực tế là khí NO (không màu) nhanh chóng bị oxi hoá thành khí NO2 (màu nâu đỏ).
(c) Enthalpy tạo thành chuẩn của NO2 là 66 kJ/mol.
(d) Từ giá trị biến thiên enthalpy chuẩn của phản ứng (1), tính được năng lượng liên kết trong phân tử NO ở cùng điều kiện là 632 kJ/mol.
Số phát biểu đúng là:
A. 2. B. 4. C. 3. D. 1.
(Xem giải) Thông tin chung cho các câu hỏi 14, 15
Dạng carbocation được hình thành trong một thời gian ngắn khi một nguyên tử carbon trong một hợp chất chỉ có 3 liên kết thay vì là 4. Do vậy, nguyên tử carbon mang điện dương. Có bốn loại carbocation khác nhau được gọi là methyl, primary (bậc một), secondary (bậc hai), và tertiary (bậc ba), phụ thuộc vào sự sắp xếp của các nhóm alkyl trong phân tử. Các nhóm alkyl chứa carbon và hydrogen liên kết với nhau, thường được kí hiệu là R1, R2 và R3. Các ví dụ về các loại như sau:
Cho các carbocation sau:
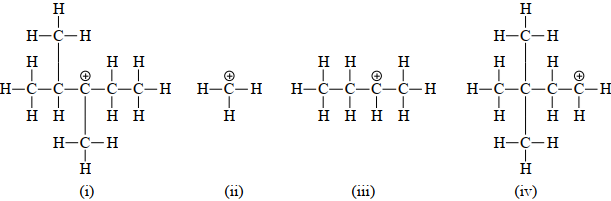
Câu 14. Loại carbocation nào được biểu diễn ở hình (i)?
A. Methyl. B. Primary. C. Secondary. D. Tertiary.
Câu 15. Càng nhiều nhóm alkyl liên kết với carbon mang điện dương thì carbocation càng bền. Thứ tự độ bền tăng dần của bốn carbocation trên là
A. (ii), (iv), (iii), (i). B. (i), (iii), (iv), (ii).
C. (ii), (iii), (iv), (i). D. (i), (iv), (iii), (ii).
(Xem giải) Thông tin chung cho các câu hỏi 16, 17, 18
Bọ rùa “pháo thủ” là một loài côn trùng thuộc loại bọ cánh cứng đất, tên khoa học là Carabidae. Sở dĩ chúng có biệt danh như vậy là bởi mỗi khi cảm thấy bị đe dọa hay đi săn mồi, Carabidae sẽ phun ra một loạt “đại bác” – vốn là các hóa chất rất độc hại từ phía chóp bụng kèm theo một tiếng nổ nhẹ. Ước tính, trong vòng một giây, số viên “đại bác” được khai hỏa của bọ rùa có thể lên tới 368 – 735 viên. Đặc biệt hơn, bọ rùa “pháo thủ” sản xuất “đại bác” ngay trong các tuyến thuộc khoang bụng của mình. Cụ thể, chúng có hai khoang đựng hydrogen peroxide và hydroquinone dạng lỏng. Hai hóa chất này sẽ được bọ rùa tiết ra, hòa lẫn trong một khoang riêng, với chất xúc tác bao gồm các enzyme như peroxidise và catalase.

Đó là thời điểm tất cả hòa trộn và tạo thành những viên “đại bác” p-benzoquinone (C6H4O2) có sức nóng lên tới 100°C và vận tốc gần 10 m/s. Không chỉ vậy mà chất này còn vô cùng độc hại. Nếu người dính phải “đại bác” của bọ rùa, nạn nhân có thể bị bỏng rát, còn những loài côn trùng nhỏ như kiến, mối.. thì chắc chắn tử nạn nếu trúng phải đòn tấn công này.
Phản ứng xảy ra khi phóng “đại bác” như sau: C6H6O2 (aq) + H2O2 (aq) → C6H4O2 (aq) + 2H2O (l) (1)
Tiến hành thí nghiệm cho 5,00.10^-4 mL dung dịch C6H6O2 3,29 mol/L tác dụng với lượng dư H2O2 như phản ứng (1) nhận thấy lượng nhiệt toả ra làm 1,00.10^-3 mL nước tăng từ 20°C đến 100°C. Biết mối quan hệ giữa nhiệt lượng, nhiệt dung riêng và nhiệt độ như sau: q = m × C × ΔT. Nhiệt dung riêng của nước bằng 4,18 J/g.K và khối lượng riêng của nước: 1,00 g/mL.
Câu 16. Chọn phát biểu đúng
A. Phản ứng (1) là phản ứng oxi hoá – khử, H2O2 chất oxi hoá.
B. Phản ứng (1) là phản ứng oxi hoá – khử, H2O2 chất khử.
C. Phản ứng (1) là phản ứng trao đổi, H2O2 là chất xúc tác.
D. Phản ứng (1) là phản ứng trao đổi, H2O2 là dung môi.
Câu 17. Cho các công thức:
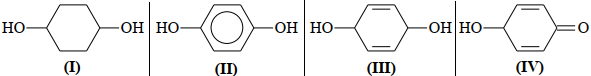
Công thức của hydroquinone ứng với
A. (I). B. (II). C. (III). D. (IV).
Câu 18. Dựa vào kết quả thí nghiệm tính được hiệu ứng nhiệt của phản ứng (1) là x kJ/mol. x gần nhất với
A. -550. B. -202. C. -302. D. +550.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 19. Một học sinh đã thực hiện một thí nghiệm để xác định tốc độ phản ứng giữa hydrochloric acid (HCl) và đá cẩm thạch (thành phần chính là calcium carbonate, còn lại tạp chất không tan, không tác dụng với acid). Phản ứng giữa hai chất này được biểu diễn bằng phương trình hoá học:
2HCl (aq) + CaCO3(s) → CaCl2(aq) + H2O(l) + CO2(g) ![]() < 0
< 0
• Thí nghiệm 1: Cho các viên đá cẩm thạch (kích thước hạt khoảng 1 mm) tác dụng với dung dịch HCl. Thời gian bắt đầu tính khi các viên đá cẩm thạch được thả vào acid và miếng bông gòn được chèn vào. Bông gòn ngăn không cho dung dịch phun ra. Khối lượng của bình và thành phần trong bình được ghi lại sau mỗi 30 giây. Kết quả thí nghiệm được biểu diễn như hình (b).
Hình (a): Cách thiết lập thí nghiệm
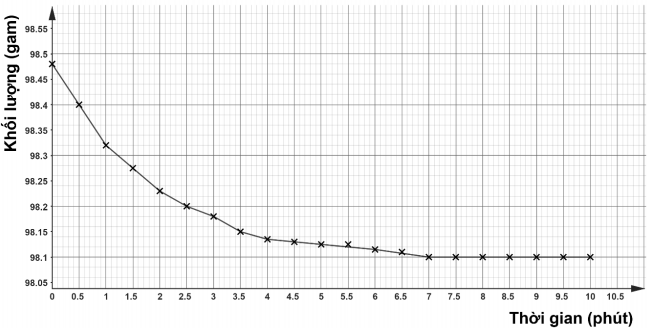
Hình (b): Đồ thị khối lượng của bình và thành phần trong bình theo thời gian.
• Thí nghiệm 2: Tiến hành giống hoàn toàn ở thí nghiệm 1, sự khác biệt duy nhất là những viên đá cẩm thạnh ở thí nghiệm 2 được nghiền nhỏ thành dạng bột mịn so với thí nghiệm 1. Khối lượng của bình và thành phần trong bình được ghi lại sau mỗi 30 giây.
Học sinh đã đề xuất những giả thuyết sau đây để giải thích hình dạng của đồ thị hình (b)
(I) Ở mốc 7 phút, một hoặc cả hai chất tham gia phản ứng đã hết.
(II) Khối lượng tiếp tục giảm khi chất rắn đang hoà tan; dung dịch có khối lượng nhỏ hơn chất rắn.
(III) Tốc độ phản ứng ban đầu là nhanh nhất vì nồng độ của acid tại thời điểm này lớn nhất.
(IV) Trong quá trình phản ứng thì tốc độ phản ứng giảm vì dung dịch lạnh dần.
a) Để giải thích hình dạng đồ thị hình (b), các đề xuất giả thuyết đúng là (I) và (III).
b) Nếu từ kết quả ở thí nghiệm 2, vẽ một đồ thị biểu thị kết quả thì đồ thị mới này có độ dốc thấp hơn và thẳng hơn khi khối lượng cao hơn 98,10 gam.
c) Khối lượng calcium carbonate có trong đá cẩm thạch đem tiến hành thí nghiệm là 98,10 gam.
d) Nếu thay dung dịch HCl ở thí nghiệm 1 bằng dung dịch CH3COOH cùng nồng độ thì kết quả thí nghiệm ghi nhận hoàn toàn giống nhau vì các acid trong thí nghiệm đều là đơn acid.
(Xem giải) Câu 20. HNO3 là hợp chất cộng hoá trị, có hai đề xuất về công thức Lewis của phân tử HNO3 như hình dưới:
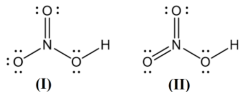
Kết quả nghiên cứu cho biết giá trị độ dài các liên kết giữa nguyên tử N và O (liên kết NO) trong phân tử HNO3 là 1,406Å; 1,211Å và 1,199Å.
Nitric acid (HNO3) là một hóa chất được sử dụng nhiều để sản xuất phân bón, hoá chất, … Trong công nghiệp HNO3 được sản xuất bằng nhiều cách như:
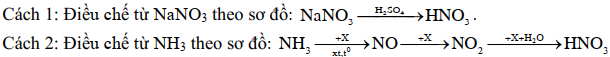
a) Công thức (I) phù hợp hơn công thức (II) vì nguyên tử N chỉ có 4 orbital hoá trị, do đó chỉ có thể tạo tối đa 4 liên kết cộng hoá trị. Theo công thức (I), N có hoá trị là IV và số oxi hoá là +5.
b) Công thức (II) không phù hợp với dữ liệu do có hai loại liên kết giữa N và O không tương đương nhau trong phân tử HNO3 (2 liên kết đôi, 1 liên kết đơn theo kiểu ghép đôi electron hoá trị).
c) Phản ứng điều chế HNO3 bằng cách 1 xảy ra được do H2SO4 có tính oxi hoá mạnh hơn HNO3.
d) Ba phản ứng ở cách 2 dùng giải thích trên phương diện hoá học câu ca dao:
“Lúa chiêm lấp ló đầu bờ
Hễ nghe tiếng sấm phất cờ mà lên”.
(Xem giải) Câu 21. Benzyl benzoate (BnBzO) được bán dưới tên thương mại Scabanca cùng với một số những tên khác, là một loại dược phẩm và thuốc diệt côn trùng.
a) BnBzO là ester của phenol và acid hữu cơ, BnBzO có công thức là C6H5COOC6H5.
b) Phản ứng thuỷ phân BnBzO trong dung dịch sulfuric acid xảy ra phản ứng thuận nghịch.
c) Nếu dùng BnBzO làm thuốc điều trị ghẻ thì BnBzO được dùng ở dạng dung dịch với nước do BnBzO tan nhiều trong nước ở nhiệt độ phòng.
d) Khi đun nóng, BnBzO khi tác dụng với dung dịch NaOH dư thu được hai muối và nước.
(Xem giải) Câu 22. Giá trị pH mà khi đó amino acid có nồng độ ion lưỡng cực là cực đại được gọi là điểm đẳng điện (kí hiệu là pI). Khi pH < pI thì amino acid đó tồn tại chủ yếu ở dạng cation, còn khi pH > pI thì amino acid đó tồn tại chủ yếu ở dạng anion. Khi đặt trong một điện trường dạng anion sẽ di chuyến về cực (+) còn dạng cation sẽ di chuyển về cực (-). Tính chất này được gọi là tính điện di và được dùng để tách, tinh chế amino acid ra khỏi hỗn hợp của chúng. Cho các giá trị pI của các chất sau:
H2NCH2COOH (X) có pI = 6,0
HOOCCH2CH2CH(NH2)COOH (Y) có pI = 3,2
H2N[CH2]4CH(NH2)COOH (Z) có pI = 9,7
a) (X), (Y), (Z) có tên gọi lần lượt là: glycine, gluconic acid, lysine.
b) Nếu chỉ dùng thêm dung dịch phenolphthalein thì không thể phân biệt được dung dịch bão hoà chứa từng chất (X), (Y), (Z).
c) Giá trị pH=9,7 là giá trị pH lớn nhất để tách chất (X), (Y), (Z) ra khỏi dung dịch hỗn hợp của chúng dưới tác dụng của điện trường.
d) Khi thuỷ phân tripeptide thu được hỗn hợp (X), (Y), (Z), số đồng phân tripeptide là 12.
PHẦN III: Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
(Xem giải) Câu 23. Trong phòng thí nghiệm trimesic acid (hay 1,3,5-benzenetricarboxylic acid) được điều chế bằng cách đun mesitylene (hay 1,3,5-trimethylbenzene) với dung dịch KMnO4 trong môi trường H2SO4 dư theo sơ đồ sau:
mesitylene + KMnO4 + H2SO4 (t°) → trimesic acid + K2SO4 + MnSO4 + H2O
Nếu hệ số cân bằng của mesitylene là 1 thì tổng hệ số cân bằng của phản ứng xảy ra là bao nhiêu?
(Xem giải) Câu 24. Cho 40,0 gam copper(II) oxide tác dụng vừa đủ với dung dịch H2SO4 40,0% ở nhiệt độ cao thu được dung dịch X. Làm lạnh dung dịch X đến 20°C thu được m gam CuSO4.5H2O kết tinh. Tìm giá trị của m. Chỉ làm tròn kết quả ở phép tính cuối cùng, làm tròn đến hàng đơn vị. Biết độ tan của copper(II) sulfate ở 20°C là 20,9 gam.
(Xem giải) Câu 25. Terephthalic acid (hay 1,4-benzenedicarboxylic acid) là chất rắn màu trắng, là nguyên liệu chính trong quá trình sản xuất sợi polyester, nhựa tổng hợp, các sản phẩm sơn cách điện, nhựa, chất hóa dẻo,… Tơ Sorona® được điều chế từ PTT (poly(trimethylene terephthalate)). Tơ này được sử dụng rộng rãi trong công nghiệp dệt, đặc biệt để sản xuất các loại đồ bơi. Poly(trimethylene terephthalate) được tổng hợp từ phản ứng trùng ngưng của terephthalic acid và propane-1,3-diol. Một đoạn mạch poly(trimethylene terephthalate) có khối lượng là 415708 (amu). Số mắc xích trung bình có trong đoạn mạch poly(trimethylene terephthalate) là bao nhiêu?
(Xem giải) Câu 26. Hợp chất X có công thức C9H16O4. Từ X thực hiện các phản ứng (theo đúng tỉ lệ mol):
(1) X + 2NaOH → X1 + X2 + H2O
(2) X1 + H2SO4 → X3 + Na2SO4
(3) nX3 + nX4 → nylon-6,6 + 2nH2O
(4) 2X2 + X3 ⇌ X5 + 2H2O
Tính khối lượng phân tử X5 theo đơn vị amu.
(Xem giải) Câu 27. Cho các phát biểu sau:
(1) Chất giặt rửa tổng hợp được sản xuất bằng cách đun nóng dầu, mỡ động vật, thực vật với dung dịch kiềm.
(2) Xà phòng là hỗn hợp muối sodium hoặc potassium của acid béo, không nên dùng xà phòng trong nước cứng vì tạo ra muối kết tủa.
(3) Trái với xà phòng, có thể sử dụng chất giặt rửa tổng hợp với cả nước cứng, do chất giặt rửa tổng hợp không tạo muối khó tan với Ca2+, Mg2+.
(4) Các chất giặt rửa đều có khả năng hoạt động bề mặt cao, có tác dụng làm giảm sức căng bề mặt chất bẩn, giúp vải sợi dễ thấm ướt.
(5) Nhược điểm của xà phòng so với chất giặt rửa tổng hợp là xà phòng khó bị phân huỷ sinh học hơn, do đó gây ô nhiễm môi trường.
(6) Chất giặt rửa thường được cấu tạo gồm hai phần, một phần ưa nước và một phần kị nước.
(7) Chất giặt rửa tổng hợp tương tự với xà phòng ở phần kị nước, còn phần ưa nước là các nhóm khác nhau.
(8) Từ nguồn nguyên liệu dầu mỏ, có thể sản xuất được cả xà phòng và chất giặt rửa tổng hợp.
(9) Nước bồ kết là chất giặt rửa tự nhiên, không phải chất giặt rửa tổng hợp, cũng không phải là xà phòng.
Tính tổng các số thứ tự của những phát biểu đúng.
(Xem giải) Câu 28. Cho thế điện cực chuẩn của kim loại: E°Ca2+/Ca = -2,868V; E°Na+/Na = -2,710V; E°Mg2+/Mg = -2,372V; E°Mn2+/Mn = -1,185V; E°Fe2+/Fe = -0,440V, E°Cd2+/Cd = -0,400V; E°Cu2+/Cu = +0,340V; E°Ag+/Ag = 0,800V. Số kim loại trong các cặp oxi hoá – khử trên khử được Ag+ trong dung dịch thành kim loại ở điều kiện chuẩn là bao nhiêu?
II. PHẦN TỰ LUẬN: (10,0 điểm)
(Xem giải) Câu I (2,0 điểm): Phân tích hợp chất hữu cơ X mạch hở được kết quả như sau: %C = 46,75%; %H = 7,36%; %N = 18,18%; %O = 27,71% theo khối lượng.
a) Dựa vào phép phân tích quang phổ MS xác định được phân tử khối của X bằng 231. Tìm công thức phân tử của X.
b) Biết 1,0 mol X tác dụng vừa đủ với dung dịch chứa 3,0 mol HCl chỉ tạo dung dịch chứa muối của α-amino acid (có dạng ClH3N-R-COOH). Xác định công thức cấu tạo của X.
(Xem giải) Câu II (2,0 điểm): Glucose (còn gọi là đường) là nguồn năng lượng chính nuôi cơ thể, được chuyển hóa từ các loại thực phẩm mà chúng ta cung cấp cho bản thân mỗi ngày. Một bệnh nhân A bị bệnh tiểu đường có hàm lượng glucose trong máu cao (đường huyết cao), được bác sĩ khuyên hạn chế ăn đường.
a) Người bệnh nhân A cho rằng cơm không phải là glucose nên khi ăn ít hay nhiều cơm đều không ảnh hưởng đến lượng đường huyết, còn đường kính (saccharose) là đường vì thế ăn nhiều đường kính thì làm lượng đường huyết tăng nên cần hạn chế ăn đường kính. Theo em điều này có phù hợp với lời khuyên của bác sĩ không? Vì sao?
b) Hàm lượng chất glucose có trong mẫu dược phẩm có thể được xác định bằng phương pháp chuẩn độ với iodine như sau: Cho V mL dung dịch chứa glucose vào V1 mL nước iodine (0,1M), lắc cho đến khiphản ứng hoàn toàn. Sau đó, thêm vào dung dịch sau phản ứng vài giọt dung dịch X, rồi vừa lắc vừa nhỏ từ từ dung dịch sodium thiosulfate (0,1M, Na2S2O3) có nồng độ xác định vào dung dịch ở trên đến khi mất màu xanh thì dừng lại. Ghi thể tích dung dịch sodium thiosulfate đã tiêu tốn.
Biết rằng:
– Glucose phản ứng với nước iodine tương tự như với nước bromine.
– Phản ứng giữa iodine với sodium thiosulfate tạo sodium iodide và sodium tetrathionate (Na2S4O6).
– Xem trong dược phẩm không có hoá chất nào tham gia các phản ứng trên.
b1) Viết phương trình hoá học của phản ứng giữa glucose và iodine.
b2) Dự đoán X và cho biết vai trò của X trong thí nghiệm trên.
b3) Trình bày nguyên tắc xác định hàm lượng glucose trong thí nghiệm trên.
b4) Với V = 10, V1 = 70 và tiến hành thí nghiệm ba lần thu được kết quả như sau:
| Lần chuẩn độ | Lần 1 | Lần 2 | Lần 3 |
| Thể tích dung dịch Na2S2O3 0,1M | 29,9 | 30,0 | 30,1 |
Tính nồng độ glucose có trong mẫu thử.
Câu III (2,0 điểm).
(Xem giải) Câu III.1. Một nguyên tố X có khả năng tạo nhiều acidic oxide. Các muối 1, 2 là muối của sodium và acid có chứa oxygen của X. Thành phần % khối lượng các nguyên tố trong một số muối của X được ghi trong bảng sau:
| Muối | Phần trăm khối lượng (%) | ||
| Sodium (Na) | Nguyên tố X | Oxygen (O) | |
| 1 | 32,3944 | 21,8310 | 45,0704 |
| 2 | 20,7207 | 27,9279 | 50,4505 |
Xác định công thức của các muối trên.
(Xem giải) Câu III.2.
– Bậc phản ứng là một khái niệm quan trọng trong hóa học, giúp xác định mức độ phụ thuộc của tốc độ phản ứng vào nồng độ các chất tham gia phản ứng. Việc xác định bậc phản ứng có thể được thực hiện thông qua nhiều phương pháp khác nhau, bao gồm phương pháp thực nghiệm và phương pháp suy luận từ cơ chế phản ứng.
– Bậc phản ứng đối với một chất phản ứng trong một phương trình động học là số mũ của nồng độ chất đó trong phương trình tốc độ. Tổng bậc của phản ứng là tổng của các bậc đối với từng chất phản ứng.
– Phương trình tốc độ của một phản ứng tổng quát có dạng: ![]() (với: v là tốc độ phản ứng; k là hằng số tốc độ; CA và CB là nồng độ các chất phản ứng; m và n là bậc phản ứng đối với từng chất).
(với: v là tốc độ phản ứng; k là hằng số tốc độ; CA và CB là nồng độ các chất phản ứng; m và n là bậc phản ứng đối với từng chất).
– Một học sinh tiến hành thí nghiệm xác định tốc độ phản ứng giữa ClO2 và OH- thu được những kết quả sau:
| Nồng độ ClO2 (mol/L) | Nồng độ OH- (mol/L) | v (mol/L.s) | |
| Lần 1 | 0,0500 | 0,1000 | 5,75×10-2 |
| Lần 2 | 0,1000 | 0,1000 | 2,30×10-1 |
| Lần 3 | 0,1000 | 0,0500 | 1,15×10-1 |
| Lần 4 | 0,1800 | 0,0500 | x |
Biết phương trình phản ứng xảy là: 2ClO2(aq) + 2OH-(aq) → ClO3-(aq) + ClO2-(aq) + H2O(l)
a) Xác định tổng bậc của phản ứng
b) Xác định hằng số tốc độ.
c) Xác định giá trị của x trong bảng trên.
(Xem giải) Câu IV (2,0 điểm): Dung dịch NaOH thường được dùng làm dung dịch chuẩn trong phương pháp chuẩn độ acid-base và được pha từ hóa chất rắn NaOH. Một quy trình chuẩn bị dung dịch NaOH được thực hiệnnhư sau: cân 0,4 g NaOH rắn và pha vào nước cất thành 1,0 L dung dịch NaOH. Để dung dịch vừa pha trong bình kín. Nồng độ của dung dịch NaOH vừa pha được xác định bằng phép chuẩn độ với dung dịch đơn acid mạnh (đã biết nồng độ chính xác), sử dụng chỉ thị là dung dịch phenolphthalein.
a) Giải thích tại sao cần để dung dịch NaOH vừa pha trong bình kín.
b) Dụng cụ sử dụng cho chuẩn độ gồm: bình tam giác-250 mL, burette-25 mL, cốc-50 mL, pipette-10 mL và các dụng cụ cần thiết khác.
b1) Cho biết những dụng cụ nào ở trên được dùng để đo thể tích chính xác?
b2) Cho biết burette đựng dung dịch gì trong phép chuẩn độ ở trên?
b3) Một học sinh đã đề xuất ba vị trí để đọc thể tích trên burette như hình bên. Theo em, trong đề xuất của học sinh trên, vị trí nào đúng? Vì sao?
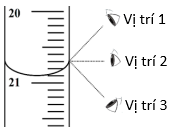
c) Trong một phép chuẩn độ, tại thời điểm dung dịch trong bình tam giác đổi màu ổn định trong vòng 30 giây, thể tích đọc được trên burette là 10,01 mL và có một giọt dung dịch còn treo ở đầu dưới của burette. Một học sinh cho rằng cần lấy giọt dung dịch này vào bình tam giác. Một học sinh khác lại cho rằng nên bỏ giọt dung dịch này.
c1) So sánh ảnh hưởng của hai cách làm này đến nồng độ NaOH được tính từ kết quả phép chuẩn độ trên.
c2) Vì sao khi chuẩn độ người ta thường không tiến hành thí nghiệm một lần mà thường là nhiều lần?
(Xem giải) Câu V (2,0 điểm): Vào năm 1780, Luigi Galvani phát hiện ra rằng khi hai kim loại khác nhau (ví dụ đồng và kẽm) được kết nối và sau đó cả hai cùng chạm vào hai phần khác nhau của dây thần kinh của một con ếch, thì chân con ếch co rút. Ông gọi đây là “điện động vật”. Một pin Galvani được tạo nên từ hai cặp oxi hoá – khử khác nhau ví dụ Sn2+/Sn và Zn2+/Zn. Biết: E°Sn2+/Sn = -0,13V; E°Zn2+/Zn = -0,76V.
a) Mô tả cấu tạo Pin X được tạo nên khi ghép nối với nhau hai điện cực chuẩn trên. Hãy vẽ sơ đồ cấu tạo của pin X và chỉ rõ điện cực dương, điện cực âm và chiều di chuyển của dòng điện.
b) Tính sức điện động chuẩn của pin X.
c) Thực tế khi nồng độ của các muối thay đổi thì thế điện cực của các điện cực cũng thay đổi dẫn đến sức điện động của pin cũng thay đổi theo. Giá trị của thế điện cực kim loại ở điều kiện không chuẩn phụ thuộc vào nồng độ của cation kim loại ở điện cực theo phương trình Nernst:
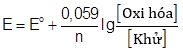
(với n là số electron trao đổi ở điện cực). Hãy tính tỉ lệ nồng độ của Zn2+ so với nồng độ Sn2+ ở điện cực khi pin X hết điện.
d) Một học sinh nêu giả thuyết: “Có thể tạo được pin Galvani từ hai điện cực của cùng một cặp oxi hoá – khử Zn2+/Zn”. Hãy trình bày quan điểm của em về giả thuyết trên.

Bình luận