Thi ĐGNL chuyên biệt 2025 – ĐHSP TP Hồ Chí Minh
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Thời gian làm bài: 90 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1D | 2B | 3C | 4D | 5B | 6D | 7A | 8A | 9A | 10D |
| 11B | 12B | 13C | 14A | 15A | 16A | 17D | 18B | 19B | 20C |
| Câu | Phương án đúng | Câu | Phương án đúng | Câu | Trả lời | Câu | Trả lời |
| 21 | 3, 4 | 26 | C | 31 | 2, 3, 4 | 36 | 2, 3, 4 |
| 22 | 3, 4 | 27 | C | 32 | 1, 4 | 37 | 6,6 |
| 23 | 3 | 28 | A | 33 | 32,4 | 38 | 277,9 |
| 24 | 2, 3 | 29 | – | 34 | 1, 2, 4 | 39 | 3, 4 |
| 25 | 1, 2 | 30 | A | 35 | 202 | 40 | 5 |
Thí sinh lựa chọn một phương án đúng theo yêu cầu từ câu 1 đến câu 20.
(Xem giải) Câu 1: Mọi vật thể đều được tạo nên từ các nguyên tử. Trong đa số các nguyên tử, hạt nhân chứa các loại hạt nào?
A. Neutron, photon. B. Electron, neutron.
C. Proton, photon. D. Proton, neutron.
(Xem giải) Câu 2: Khi hoà tan sodium carbonate (Na2CO3) vào nước, quá trình sau đây xảy ra: CO32- + H2O ⇌ HCO3- + OH-. Theo thuyết Brønsted – Lowry, ion CO32– đóng vai trò gì trong quá trình trên?
A. Acid. B. Base. C. Chất lưỡng tính. D. Muối.
(Xem giải) Câu 3: Trong tự nhiên, nguyên tố nitrogen tồn tại ở dạng nào?
A. Chủ yếu tồn tại dạng nguyên tử. B. Chỉ tồn tại trong các hợp chất.
C. Cả dạng đơn chất và hợp chất. D. Chủ yếu tồn tại dạng NOx trong không khí.
(Xem giải) Câu 4: Hợp chất có công thức cấu tạo nào sau đây là alcohol?
A. CH3COCH3. B. CH3COOH. C. C6H5OH. D. CH3CH2OH.
(Xem giải) Câu 5: Hợp chất X có công thức cấu tạo là CH3COOC2H5. Tên gọi của chất X là gì?
A. Methyl propionate. B. Ethyl acetate. C. Ethyl propionate. D. Methyl acetate.
(Xem giải) Câu 6: Phản ứng hoá học nào dưới đây là phản ứng oxi hoá-khử?
A. CaCO3(s) → CaO(s) + CO2(g).
B. FeCl3(aq) + 3AgNO3(aq) → Fe(NO3)3(aq) + 3AgCl(s).
C. CuSO4(aq) + 2NaOH(aq) → Cu(OH)2(s) + Na2SO4(aq).
D. SO2(g) + 2H2S(g) → 3S(s) + 2H2O(l).
(Xem giải) Câu 7: Trong cơn giông khi có sấm sét, khí nitrogen (N2) và khí oxygen (O2) trong không khí có thể phản ứng trực tiếp với nhau tạo thành hợp chất nào?
A. NO. B. NO2. C. N2O. D. N2O5.
(Xem giải) Câu 8: Hợp chất X phản ứng với thuốc thử Tollens (dung dịch AgNO3 trong NH3 dư) tạo thành lớp bạc (Ag) sáng bóng bám trên bề mặt ống nghiệm. Chất X thuộc loại hợp chất nào dưới đây?
A. Aldehyde. B. Alkyne. C. Phenol. D. Alcohol.
(Xem giải) Câu 9: Thuỷ phân hoàn toàn saccharose (C12H22O11) trong môi trường acid, thu được sản phẩm nào?
A. Glucose và fructose. B. Chỉ có fructose.
C. Chỉ có glucose. D. Glucose và maltose.
(Xem giải) Câu 10: Số oxi hoá của nguyên tử hydrogen trong phân tử H2 là bao nhiêu?
A. –2. B. +2. C. +1. D. 0.
(Xem giải) Câu 11: Phương trình hoá học nào dưới đây biểu diễn phản ứng giữa khí ammonia (NH3) và khí hydrogen chloride (HCl) ở điều kiện thường?
A. NH3(g) + HCl(g) → NH2Cl(s) + H2(g).
B. NH3(g) + HCl(g) → NH4Cl(s).
C. 2NH3(g) + 2HCl(g) → N2(g) + Cl2(g) + 4H2(g).
D. NH3(g) + 3HCl(g) → NCl3(s) + 3H2(g).
(Xem giải) Câu 12: Nung vôi là quá trình nhiệt phân đá vôi (có thành phần chính là calcium carbonate) để sản xuất vôi sống. Phương trình hoá học nào mô tả đúng phản ứng của quá trình trên?
A. Ca(HCO3)2(s) (t°) → CaCO3(s) + CO2(g) + H2O(g).
B. CaCO3(s) (t°) → CaO(s) + CO2(g).
C. CaO(s) + CO2(g) (t°) → CaCO3(s).
D. CaCO3(s) + CO2(g) + H2O(g) (t°) → Ca(HCO3)2(s).
(Xem giải) Câu 13: Phản ứng ester hoá điều chế ethyl pentanoate được biểu diễn bằng sơ đồ:
X + Y ⇌ ethyl pentanoate + H2O
Biết rằng ethyl pentanoate có công thức cấu tạo là CH3CH2CH2CH2COOCH2CH3. X và Y là các chất nào?
A. Ethene và pentan-1-ol. B. Ethane và pentanoic acid.
C. Ethanol và pentanoic acid. D. Ethanoic acid và pentan-1-ol.
(Xem giải) Câu 14: Polypropylene (được tổng hợp từ propylene, CH2=CH-CH3) là một chất dẻo phổ biến, dùng để sản xuất các bao bì, túi nhựa. Công thức cấu tạo nào dưới đây là của polypropylene?
A. [-CH2-CH(CH3)-]n. B. (-CH2=CH-CH3-)n. C. (-CH2-CH-CH3-)n. D. [-CH2=CH(CH3)-]n.
(Xem giải) Câu 15: Trong nguyên tử, khối lượng một hạt electron và một hạt proton lần lượt là 9,11×10^-28 gam và 1,673×10^-24 gam. Hỏi khối lượng của một hạt proton gấp bao nhiêu lần khối lượng một hạt electron?
A. Khoảng 1836 lần. B. Khoảng 5,4 lần.
C. Khoảng 1,8×10-53 lần. D. Khoảng 0,0005 lần.
(Xem giải) Câu 16: Phổ khối lượng có thể được sử dụng để xác định hàm lượng các đồng vị bền của một nguyên tố. Phổ khối lượng của neon (Ne) được biểu diễn như hình bên.
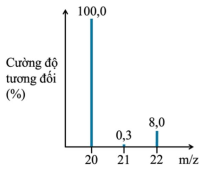
Dựa vào phổ khối lượng, hãy cho biết nguyên tử khối trung bình của Ne là bao nhiêu?
A. 20,15. B. 21,82. C. 34,64. D. 21,00.
(Xem giải) Câu 17: Bảng dưới đây cho biết các thông số vật lí của một số đơn chất halogen ở điều kiện áp suất thường:
| Đơn chất halogen | Nhiệt độ nóng chảy (ºC) | Nhiệt độ sôi (ºC) |
| Fluorine (F2) | -220 | -188 |
| Chlorine (Cl2) | -101 | -35 |
| Bromine (Br2) | -7 | 59 |
| Iodine (I2) | 114 | 184 |
Phương án nào dưới đây là đúng?
A. Do tạo được liên kết hydrogen giữa các phân tử, nên F2 có nhiệt độ nóng chảy và nhiệt độ sôi thấp nhất.
B. Do khối lượng phân tử và năng lượng liên kết trong phân tử tăng dần từ F2 đến I2, nên nhiệt độ nóng chảy và nhiệt độ sôi của các đơn chất halogen tăng dần.
C. Do tương tác van der Waals giảm dần từ F2 đến I2, nên nhiệt độ nóng chảy và nhiệt độ sôi của các đơn chất halogen tăng dần.
D. Do khối lượng, kích thước phân tử và số lượng electron trong các phân tử tăng từ F2 đến I2, nhiệt độ nóng chảy và nhiệt độ sôi của các đơn chất halogen tăng dần.
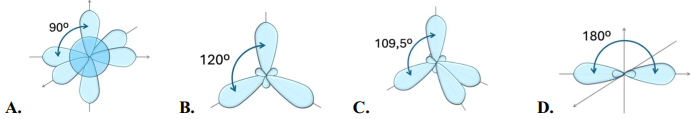
(Xem giải) Câu 18: Hình nào dưới đây biểu diễn hình dạng các orbital lai hoá sp²?
(Xem giải) Câu 19: Phản ứng chlorine hoá methane (CH4) xảy ra theo phương trình hoá học sau:
CH4(g) + Cl2(g) (chiếu sáng hoặc đun nóng) → CH3Cl(g) + HCl(g)
Biết rằng phản ứng này đã được chứng minh là xảy ra theo cơ chế gốc tự do. Trong sản phẩm của phản ứng, một lượng nhỏ ethane (C2H6) đã được phát hiện. Theo đó, mỗi phân tử C2H6 được hình thành là do đâu?
A. Do sự kết hợp của hai tiểu phân H3C−.
B. Do sự kết hợp của hai tiểu phân H3C•.
C. Do sự kết hợp giữa một tiểu phân H3C− và một tiểu phân H3C+.
D. Do sự kết hợp của hai phân tử CH3Cl đồng thời giải phóng phân tử Cl2.
(Xem giải) Câu 20: Cho phức chất có cấu tạo như hình bên.
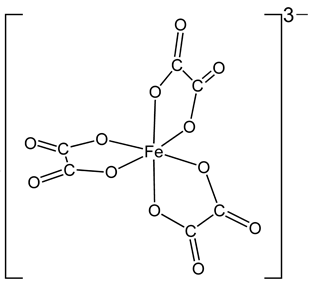
Số phối tử của phức chất và số phối trí của nhân trung tâm lần lượt là bao nhiêu?
A. 6, 6. B. 3, 3. C. 3, 6. D. 6, 3.
Thí sinh chọn các phương án đúng theo yêu cầu từ câu 21 đến câu 25 (nếu chọn duy nhất một phương án mà phương án đó là phương án đúng sẽ được tính một nửa số điểm của câu hỏi. Nếu chọn tất cả các phương án đúng sẽ đạt điểm tối đa của câu hỏi).
(Xem giải) Câu 21: Tiến hành thí nghiệm theo các bước sau:
– Rót dung dịch sodium chloride (NaCl) bão hòa vào cốc 1, cốc 2, cốc 3; dầu nhờn (bản chất là hỗn hợp các hydrocarbon) vào cốc 4.
– Cho một đinh thép vào cốc 1 và cốc 4, cho đinh thép được quấn bởi dây kẽm (Zn) vào cốc 2, cho đinh thép được quấn bởi dây đồng (Cu) vào cốc 3 (các đinh thép là thép carbon thường và đã được làm sạch bề mặt).
Các bước được minh hoạ như hình vẽ dưới đây:
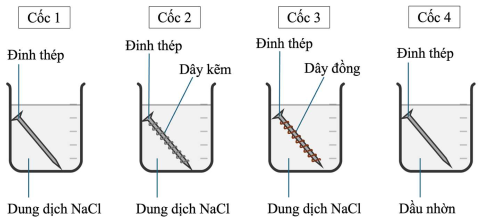
Dự đoán hiện tượng nào dưới đây phù hợp với lí thuyết về sự ăn mòn kim loại khi để 4 cốc trong không khí sau 5 ngày?
1. Ở cốc 1, đinh thép bị ăn mòn, xuất hiện lớp kim loại bám lên bề mặt đinh thép.
2. Ở cốc 2, đinh thép bị ăn mòn hầu như hoàn toàn, dây kẽm không bị ăn mòn.
3. Ở cốc 3, đinh thép bị ăn mòn và dây đồng hầu như không bị ăn mòn.
4. Ở cốc 4, đinh thép hầu như không bị ăn mòn.
(Xem giải) Câu 22: Một ống nghiệm chứa chất lỏng X. Biết rằng X có thể là hexane hoặc hex-1-yne. Cách làm nào dưới đây xác định được chất X?
1. Cho X vào dung dịch bromine (Br2), nếu dung dịch Br2 nhạt màu thì chứng tỏ chất lỏng là hexane.
2. Cho X vào ống nghiệm chứa 2 mL dung dịch copper(II) sulfate (CuSO4), nếu X nổi lên trên thì chứng tỏ X là hex-1-yne.
3. Cho X vào ống nghiệm chứa dung dịch silver nitrate (AgNO3) trong ammonia (NH3) dư, nếu thấy xuất hiện kết tủa thì chứng tỏ X là hex-1-yne.
4. Cho X vào ống nghiệm chứa dung dịch potassium permanganate (KMnO4), nếu màu tím của dung dịch nhạt dần và xuất hiện kết tủa nâu đen thì chứng tỏ X là hex-1-yne.
(Xem giải) Câu 23: Khi tìm hiểu về các yếu tố ảnh hưởng đến tốc độ phản ứng, để trả lời cho câu hỏi “Nồng độ chất tham gia ảnh hưởng đến tốc độ phản ứng như thế nào?”, học sinh đã tiến hành thí nghiệm theo các bước:
Bước 1: Chuẩn bị 2 cốc thuỷ tinh 250 mL được đánh dấu A và B.
Bước 2: Rót 50 mL dung dịch hydrochloric acid (HCl) 1 M vào cốc A; 50 mL dung dịch HCl 2 M vào cốc B.
Bước 3: Cho 1 gam bột kẽm (Zn) vào mỗi cốc. Quan sát hiện tượng xảy ra ở 2 cốc.
Phát biểu nào sau đây đúng?
1. “Tốc độ phản ứng không phụ thuộc vào nồng độ chất tham gia” có thể là một giả thuyết tương ứng với câu hỏi trên.
2. Ở bước 3, nếu sử dụng bột đồng (Cu) thay cho bột Zn thì thí nghiệm vẫn phù hợp để trả lời câu hỏi trên.
3. Nếu trong cùng một khoảng thời gian (khi Zn chưa tan hết ở cả 2 cốc) lượng khí thoát ra ở cốc nào nhiều hơn thì có thể kết luận tốc độ phản ứng ở cốc đó lớn hơn cốc còn lại.
4. Ở bước 3, nếu cho 1 gam Zn dạng viên vào cốc A, 1 gam bột Zn vào cốc B thì có thể cho thấy được tốc độ phản ứng phụ thuộc vào nồng độ.
(Xem giải) Câu 24: Một học sinh thực hiện thí nghiệm chuẩn độ để xác định nồng độ dung dịch hydrochloric acid (HCl) bằng dung dịch chuẩn sodium hydroxide (NaOH) 0,100 M với chất chỉ thị methyl orange (MO). Biết rằng MO sẽ có màu đỏ trong môi trường có pH < 3,2, màu vàng trong môi trường có pH > 4,4, và màu cam trong khoảng pH từ 3,2 đến 4,4. Để thực hiện chuẩn độ, học sinh này đã cho dung dịch NaOH 0,100 M (trên burette) nhỏ từ từ vào bình tam giác chứa sẵn 10,00 mL dung dịch HCl và 3 giọt dung dịch MO, đến khi dung dịch vừa chuyển sang màu cam thì dừng chuẩn độ. Biết rằng nếu dung dịch chỉ chứa sodium chloride (NaCl) thì có pH bằng 7.
Phát biểu nào sau đây đúng?
1. Có thể cho chất chỉ thị MO vào dung dịch NaOH trong burette thay vì cho vào bình tam giác.
2. Trước khi cho dung dịch NaOH vào burette, cần tráng burette bằng chính dung dịch này.
3. Nồng độ thực tế của dung dịch HCl sẽ lớn hơn nồng độ tính được từ kết quả thí nghiệm trên.
4. Nếu thể tích dung dịch NaOH 0,100 M đã dùng trong 3 lần chuẩn độ lần lượt là 12,90 mL, 13,00 mL, 13,00 mL thì nồng độ dung dịch HCl xác định được trong thí nghiệm này là 0,389 M.
5. Nếu sử dụng dung dịch phenolphthalein thay cho chỉ thị MO trong thí nghiệm trên thì học sinh cần chuẩn độ đến khi dung dịch trong bình tam giác vừa mới mất màu hồng.
(Xem giải) Câu 25: Để xác định tên của một mẫu muối sodium halide (NaX, với X là nguyên tố halogen), người ta pha lượng muối này vào nước cất, khuấy đều, thu được dung dịch A. Nhỏ dung dịch silver nitrate (AgNO3) dư vào dung dịch A thấy không xuất hiện kết tủa. Phát biểu nào sau đây đúng?
1. Có thể kết luận X là nguyên tố fluorine.
2. Nhằm tiết kiệm hoá chất, có thể dùng một vài giọt dung dịch A và một vài giọt dung dịch AgNO3 vẫn thu được kết quả phù hợp.
3. Có thể dùng thí nghiệm màu ngọn lửa để xác định tên mẫu muối trên.
4. Có thể thay nước cất bằng nước khoáng đóng chai đã được khử trùng hoàn toàn để thực hiện thí nghiệm trên.
5. Dung dịch A sậm màu, dễ phân huỷ dưới ánh sáng trong quá trình làm thí nghiệm.
(Xem giải) Dựa vào dữ liệu dưới đây, thí sinh lựa chọn một phương án đúng theo yêu cầu của câu 26 và câu 27.
Chất hữu cơ A và B là đồng phân của nhau. Trong đó, chất A là một ester có tên là vinyl acetate. Trùng hợp chất A thu được polymer X, là một loại keo dán thông dụng cho các vật liệu xốp như gỗ, giấy và vải. Chất hữu cơ B bền trong dung dịch sulfuric acid loãng nóng, B có thể phản ứng với thuốc thử Tollens (dung dịch AgNO3 trong NH3 dư). Ngoài ra, khi cho B tác dụng với dung dịch iodine (I2) trong môi trường kiềm thấy xuất hiện kết tủa vàng.
Câu 26: Mỗi mắt xích trong polymer X có bao nhiêu nguyên tử carbon?
A. 2. B. 3. C. 4. D. 5.
Câu 27: Có bao nhiêu phát biểu đúng khi nói về chất B?
(a) Khử hoàn toàn chất B bằng LiAlH4 thu được chất hữu cơ có thể hoà tan copper(II) hydroxide (Cu(OH)2) tạo dung dịch màu xanh lam.
(b) Chất B phản ứng với thuốc thử Tollens tạo kết tủa Ag với tỉ lệ mol B : Ag = 1 : 2.
(c) Kết tủa vàng là hợp chất hữu cơ có phần trăm khối lượng carbon nhỏ hơn 10%.
(d) 1 mol chất B tác dụng được tối đa với 2 mol hydrogen cyanide (HCN).
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Dựa vào dữ liệu dưới đây, thí sinh lựa chọn một phương án đúng theo yêu cầu từ câu 28 đến câu 30.
Nitrogen là nguyên tố dinh dưỡng quan trọng cho sinh vật, tuy nhiên hàm lượng nitrogen cao có thể gây ô nhiễm nước. Một nghiên cứu xác định hàm lượng ion ammonium (NH4+) trong nước bề mặt ở Đồng bằng Sông Cửu Long và so sánh với tiêu chuẩn (hàm lượng NH4+ < 3 mg.L–1) theo nguyên tắc sau:
– Chuẩn bị mẫu thử bằng cách pha loãng mẫu nước 10 lần.
– Ion NH4+ được chuyển thành indophenol qua các phản ứng:
NH4+ + ClO- → NH2Cl + H2O; NH2Cl (dẫn xuất phenol) → Indophenol (dung dịch A)
Cường độ màu (đậm/nhạt) của dung dịch A tỉ lệ thuận với lượng indophenol trong dung dịch. Khi đó máy đo cường độ màu có thể tính toán được hàm lượng indophenol, từ đó tính được hàm lượng NH4+ trong mẫu đo. Kết quả cho thấy hàm lượng ion NH4+ trong mẫu thử là 1,44 mg.L–1.
– Các phản ứng cần thực hiện ở điều kiện pH trong khoảng từ 4 đến 13. Thiết bị chỉ đo được mẫu nước có hàm lượng NH4+ nằm trong khoảng từ 0,26 đến 10,30 mg.L–1.
(Tham khảo G.-J. Wilbers, M. Becker, L. T. Nga, Z. Sebesvári, and F. G. Renaud,
“Spatial and temporal variability of surface water pollution in the Mekong Delta, Vietnam,”
Science of the Total Environment, vol. 485–486, pp. 653–665, Jul. 2014,
doi: 10.1016/j.scitotenv.2014.03.049)
Câu 28: Trước khi tiến hành đo cường độ màu, để kiểm tra pH người ta nhúng giấy quỳ tím vào mẫu thử, nhận thấy quỳ tím không đổi màu. Kết luận nào sau đây là đúng?
A. pH của mẫu thử phù hợp để tiến hành đo.
B. pH của mẫu thử chưa phù hợp, cần lấy mẫu thử ở vị trí khác.
C. pH của mẫu thử chưa phù hợp, cần điều chỉnh bằng acid hoặc kiềm.
D. Chưa thể kết luận gì vì bước này không có ý nghĩa trong phép đo.
Câu 29: Từ kết quả thí nghiệm, một số phát biểu được đưa ra như sau:
(a) Hàm lượng nguyên tố nitrogen cao trong nước có thể dẫn đến hiện tượng phú dưỡng, làm tăng nồng độ oxygen (O2) hoà tan trong nước và gây ô nhiễm.
(b) Hàm lượng nguyên tố nitrogen tồn tại ở dạng NH4+ trong mẫu thử trên là 1,12 mg.L–1.
(c) Kết quả trên chứng tỏ lượng NH4+ trong nước có nguồn gốc từ phân bón trên các đồng ruộng lân cận.
(d) Kết quả trên khẳng định được nitrogen trong nước không tồn tại ở dạng nitrate (NO3-).
Phát biểu nào là đúng?
A. (a) và (b). B. (b). C. (a), (c), và (d). D. (b) và (d).
Câu 30: Cho các phát biểu sau đây:
(a) Mục đích của thí nghiệm là để kiểm tra hàm lượng ion NH4+ trong nước bề mặt có nằm ngoài tiêu chuẩn cho phép hay không.
(b) Hàm lượng NH4+ trong mẫu nước ban đầu là 1,44 mg.L–1.
(c) Nồng độ NH4+ trong mẫu thử càng lớn thì cường độ màu của dung dịch A càng yếu.
(d) Việc pha loãng nhằm tránh NH4+ chuyển thành ammonia (NH3) khi tiếp xúc với kiềm.
(e) Có thể kết luận rằng mẫu nước này không bị ô nhiễm NH4+.
Có bao nhiêu phát biểu đúng trong các phát biểu trên?
A. 1. B. 2. C. 3. D. 5.
Thí sinh điền đáp án hoặc ký hiệu số của phương án vào ô trống theo yêu cầu từ câu 31 đến câu 40.
(Xem giải) Câu 31: Một mẫu nước được thử nghiệm định tính để xác định sự có mặt của một số ion. Mẫu nước được cho vào 4 ống nghiệm, sau đó nhỏ mỗi loại thuốc thử vào mỗi ống nghiệm và ghi nhận hiện tượng như bảng dưới đây:
| Ống | Thuốc thử | Hiện tượng |
| 1 | Sodium carbonate (Na2CO3) | Xuất hiện kết tủa |
| 2 | Barium chloride (BaCl2) | Xuất hiện kết tủa |
| 3 | Sodium hydroxide (NaOH) | Xuất hiện kết tủa |
| 4 | Nitric acid (HNO3) | Sủi bọt khí |
Mẫu nước trên có thể chứa những ion nào trong số các ion sau đây: (1) H+; (2) Ca2+; (3) SO42-; (4) HCO3-; (5) CO32-? (Điền đáp án là các kí hiệu số tương ứng với ion).
(Xem giải) Câu 32: Khi đốt than trong điều kiện thiếu oxygen (O2), khí carbon dioxide (CO2) sinh ra có thể phản ứng với carbon theo phản ứng thuận nghịch sau: CO2(g) + C(s) ⇌ 2CO(g)
Khi phản ứng trên đạt trạng thái cân bằng, các tác động nào dưới đây làm cân bằng chuyển dịch theo chiều thuận? (Liệt kê phát biểu đúng theo kí hiệu số).
(1) Tăng nồng độ khí CO2. (2) Tăng áp suất hệ bằng cách nén khí.
(3) Cho thêm carbon. (4) Giảm nồng độ khí carbon monoxide (CO).
(Xem giải) Câu 33: Một học sinh cần điều chế một lượng nhỏ khí acetylene từ calcium carbide để thực hiện thử nghiệm tính chất. Nhãn trên lọ calcium carbide có trong phòng thí nghiệm ghi các thông tin như sau:
Calcium carbide CaC2 64,10 g/mol
Độ tinh khiết: 99%
Chất dễ cháy, nguy hiểm
Học sinh này cần thu 12,4 mL khí acetylene ở điều kiện chuẩn để thực hiện thí nghiệm. Nếu xem hiệu suất phản ứng là 100%, học sinh này cần sử dụng tối thiểu x mg calcium carbide. Xác định giá trị của x (làm tròn đến một chữ số thập phân).
(Xem giải) Câu 34: Methanol (CH3OH) được tổng hợp từ khí hydrogen (H2) và carbon monoxide (CO) theo phản ứng sau:
2H2(g) + CO(g) ⇌ CH3OH(g)
Trong một khảo sát, ban đầu H2 và CO được nạp vào bình phản ứng theo tỉ lệ mol 2 : 1, nhiệt độ phản ứng là 473K, áp suất 100 bar và có mặt chất xúc tác Cu-Zn-Al2O3. Sau 300 giây, nồng độ CH3OH là 1,8 mol.L–1. Cho các phát biểu sau:
(1) Tốc độ trung bình của phản ứng tạo thành CH3OH trong thời gian trên là 6,0×10^–3 molL–1s–1.
(2) Nếu thực hiện phản ứng ở nhiệt độ là 373K thì tốc độ của phản ứng sẽ thấp hơn so với trường hợp trên.
(3) Trong phản ứng này, chất xúc tác làm cân bằng dịch chuyển theo chiều thuận.
(4) Thực hiện phản ứng ở áp suất cao để tăng tốc độ phản ứng.
Liệt kê phát biểu đúng theo kí hiệu số.
(Xem giải) Câu 35: Dichlorodiphenyltrichloroethane (DDT) là một trong những loại thuốc trừ sâu rẻ và hiệu quả cao, tuy nhiên nhiều nghiên cứu đã chỉ ra rằng DDT là chất có độc tính cao và phân huỷ rất chậm trong đất, do đó đã bị cấm sử dụng. Một nghiên cứu thiết lập mối quan hệ giữa nồng độ DDT trong đất với thời gian như sau:
C – C0 = –0,0018t – 1,6162
Trong đó: C và C0 lần lượt là hàm lượng lúc sau và hàm lượng ban đầu của DDT trong đất (đơn vị tính là µg.g–1), t là thời gian (đơn vị tính bằng ngày).
Người ta xác định được trong 20 g một mẫu đất nông nghiệp có lượng DDT là 41,6 µg. Dựa trên dữ liệu của các nghiên cứu trên, sau bao nhiêu ngày hàm lượng DDT trong mẫu đất trên sẽ giảm còn 0,1 µg.g–1? (làm tròn đến hàng đơn vị).
(Xem giải) Câu 36: Sulfuric acid (H2SO4) là hoá chất quan trọng, được sản xuất trong công nghiệp bằng phương pháp tiếp xúc qua ba giai đoạn:
(a) S(s) + O2(g) → SO2(g)
(b) 2SO2(g) + O2(g) ⇌ 2SO3(g) ![]() = –197,6 kJ
= –197,6 kJ
(c) nSO3(g) + H2SO4(aq) → H2SO4.nSO3(l)
Cho các phát biểu sau:
(1) Ở giai đoạn (b), cần dùng xúc tác để cân bằng chuyển dịch sang phải, giảm lượng SO2 trong khí thải.
(2) Ở giai đoạn (b), khi giảm nhiệt độ thì cân bằng dịch chuyển về phía tạo thành SO3.
(3) Nhiệt độ ở giai đoạn (b) không được quá thấp vì ảnh hưởng đến tốc độ phản ứng.
(4) Sử dụng nhiên liệu hoá thạch để cung cấp năng lượng cho quá trình sản xuất H2SO4 có thể gây ô nhiễm môi trường.
(5) Ở giai đoạn (c), người ta dùng nước cất hấp thụ trực tiếp SO3 để thu được dung dịch H2SO4 loãng.
Liệt kê phát biểu đúng theo kí hiệu số.
(Xem giải) Câu 37: Ammonia (NH3) là sản phẩm trung gian để sản xuất phân bón, đóng vai trò quan trọng trong nền kinh tế nông nghiệp của thế giới. NH3 trong công nghiệp được sản xuất từ hydrogen (H2) và nitrogen (N2). Trong đó, khí H2 được sản xuất chủ yếu từ khí methane (CH4) theo phản ứng (1):
CH4(g) + 2H2O(g) → CO2(g) + 4H2(g) (1)
Để cung cấp nhiệt cho phản ứng (1), người ta tiến hành đốt cháy CH4:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) (2)
Xét các quá trình ở điều kiện chuẩn, cho biết ![]() của các chất như sau:
của các chất như sau:
| Chất | CH4(g) | H2O(g) | CO2(g) |
| -74,8 | -241,8 | -393,5 |
Quá trình này sinh ra lượng lớn khí CO2, gây ô nhiễm môi trường. Để tạo ra 1 tấn khí H2 thì tổng lượng khí CO2 sinh ra từ phản ứng (1) và (2) là x tấn. Giả sử hiệu suất các quá trình là 100%, lượng nhiệt sinh ra ở phản ứng (2) chỉ dùng để cung cấp cho phản ứng (1). Tính x (làm tròn đến một chữ số thập phân).
(Xem giải) Câu 38: Trong công nghiệp chlorine-kiềm, dung dịch sodium chloride (NaCl) bão hoà có nồng độ khoảng 300 gL–1 chỉ được điện phân một phần thành “nước muối nghèo” có nồng độ 220 gL–1. “Nước muối nghèo” sau đó được dẫn ra khỏi bể điện phân, trong khi nước muối bão hoà mới được bơm vào. Việc làm này giúp hạn chế sự tạo thành các sản phẩm không mong muốn của quá trình điện phân. Trong khi đó, dung dịch NaOH (xút) thu được tại cathode có nồng độ khoảng 32% được chuyển sang thiết bị cô đặc để sản xuất xút có nồng độ mong muốn, ví dụ xút 45%, xút 50%. Giả sử xút không bị thất thoát trong quá trình cô đặc, thể tích dung dịch NaCl thay đổi không đáng kể trong quá trình điện phân. Để sản xuất được một thùng 20 lít xút 50% thương phẩm có khối lượng riêng là 1,52 g.mL–1, cần điện phân x lít dung dịch NaCl bão hoà.
Tính giá trị của x (làm tròn đến một chữ số thập phân).
(Xem giải) Câu 39: Khí thải từ các phương tiện giao thông là một trong các nguyên nhân gây ô nhiễm không khí, đe doạ sức khoẻ con người. Tiêu chuẩn Euro 6 đã quy định giới hạn phát thải của phương tiện giao thông cá nhân như trong bảng dưới đây:
| Hợp chất trong khói thải | Giới hạn phát thải (trên mỗi kilomet di chuyển) |
| Carbon monoxide (CO) | 1000 mg/km |
| Các hydrocarbon | 100 mg/km |
| Các oxide của nitrogen (NOx) | 60 mg/km |
| Bụi mịn | 5 mg/km |
Dựa vào thông tin từ bảng trên, một học sinh đưa ra các phát biểu sau:
(1) Khí CO có độc tính thấp nên Euro 6 cho phép phát thải CO ở nồng độ cao.
(2) NOx sinh ra từ phản ứng của nhiên liệu với nitrogen (N2) trong không khí.
(3) Nếu xe phát thải lượng hydrocarbon vượt quá 100 mg/km thì không đạt tiêu chuẩn Euro 6.
(4) Khí thải phương tiện giao thông chứa khí carbon dioxide (CO2) góp phần gây hiệu ứng nhà kính.
(5) Người ta sử dụng xăng E5 (chứa 95% xăng thông thường và 5% ethanol) để giải quyết vấn đề ô nhiễm, do khí thải sẽ không có khí CO.
Liệt kê phát biểu đúng theo kí hiệu số.
(Xem giải) Câu 40: Một học sinh sử dụng các thanh kim loại, dây dẫn, bóng đèn nhỏ và các quả chanh để lắp ráp các hệ thống như hình dưới đây:
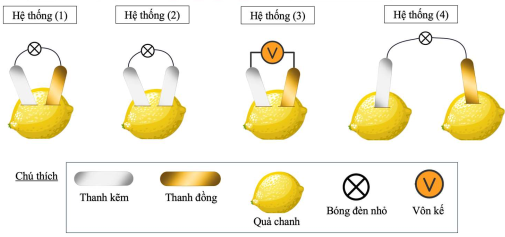
Ở các hệ thống (1), (2), (3), khi lắp ráp không để hai thanh kim loại chạm nhau.
Cho các phát biểu sau:
(1) Các bóng đèn ở hệ thống (1) và (2) đều phát sáng do có dòng điện chạy qua.
(2) Ở hệ thống (2), nếu thay hai thanh kẽm bằng hai thanh đồng (Cu) thì đèn vẫn sáng.
(3) Ở hệ thống (3), giá trị đọc được trên vôn kế chính là sức điện động chuẩn của pin Zn-Cu.
(4) Bóng đèn ở hệ thống (4) sáng hơn đèn ở hệ thống (1) do sử dụng nhiều chất điện li hơn.
(5) Ở hệ thống (3), giá trị đọc được trên vôn kế sẽ giảm theo thời gian.
Liệt kê phát biểu đúng theo kí hiệu số.


Bình luận