[2019] Thi thử THPT Quốc gia Chuyên Lê Quý Đôn – Quảng Trị (Lần 2)
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Giải chi tiết và đáp án:
| 1C | 2C | 3D | 4C | 5B | 6C | 7C | 8C | 9D | 10A |
| 11B | 12B | 13A | 14A | 15A | 16A | 17B | 18C | 19D | 20D |
| 21A | 22B | 23B | 24C | 25C | 26C | 27D | 28B | 29A | 30D |
| 31A | 32C | 33D | 34B | 35A | 36C | 37A | 38D | 39A | 40A |
Câu 1. Chất nào dưới đây thuộc loại đisaccarit?
A. Glucozơ. B. Fructozơ. C. Saccarozơ. D. Xenlulozơ.
Câu 2. Kim loại cứng nhất trong tất cả các kim loại là
A. Pb. B. Zn. C. Cr. D. W.
Câu 3. Nhựa poli(vinyl clorua) thường được dùng làm ống dẫn nước. Sản xuất poli(vinyl clorua) trong công nghiệp bằng cách trùng hợp
A. CF2=CF2. B. CH3CH2Cl. C. CH2=CH2. D. CH2=CHCl.
Câu 4. Một hiđroxit của kim loại R hóa trị n có khối lượng mol là 99 g/mol. Phương trình hóa học dạng ion rút gọn khi cho phản ứng giữa hiđroxit này với dung dịch H2SO4 loãng có dạng
A. 2Mn+ + nOH- + nH+ + nSO42- → M2(SO4)n + nH2O. B. 2Mn+ + nSO42- → M2(SO4)n.
C. M(OH)n + nH+ → Mn+ + nH2O. D. H+ + OH- → H2O.
Câu 5. Nhôm oxit không tác dụng với chất nào dưới đây?
A. HCl (dd). B. CO (t°). C. NaOH (dd). D. H2SO4 (dd).
Câu 6. Vôi sống thường được dùng để khử chua đất bị dư axit. Công thức hóa học của vôi sống là
A. CaCO3. B. Ca(OH)2. C. CaO. D. Ca(HCO3)2.
Câu 7. Cho dung dịch chất X tác dụng với lượng dư dung dịch NaOH thu được kết tủa màu trắng. Dung dịch chất X là dung dịch
A. CuSO4. B. ZnSO4. C. MgSO4. D. Al2(SO4)3.
Câu 8. Kim loại nào sau đây sản xuất bằng phương pháp điện phân nóng chảy?
A. Ag. B. Fe. C. Al. D. Cu.
Câu 9. Chất nào dưới đây không làm xanh giấy quỳ ẩm?
A. Metylamin. B. Lysin. C. Amoniac. D. Anilin.
Câu 10. Kim loại nào dưới đây là kim loại kiềm thổ?
A. Mg. B. Na. C. Fe. D. Li.
Câu 11. Phát biểu nào không đúng về peptit mạch hở Gly-Ala:
A. Mỗi phân tử Gly-Ala chứa một liên kết peptit.
B. Dung dịch của Gly-Ala hòa tan được Cu(OH)2.
C. Gly-Ala là đồng phân của Ala-Gly.
D. Gly-Ala có phản ứng hóa học với dung dịch HCl.
Câu 12. Để phân biệt hai dung dịch glucozơ và fructozơ ta dùng
A. AgNO3/NH3. B. Br2. C. H2SO4 đặc. D. Cu(OH)2.
Câu 13. Este benzyl axetat có mùi thơm đặc trưng của hoa nhài. Công thức của benzyl axetat là
A. CH3COOCH2C6H5. B. C6H5COOCH2CH3. C. CH3COOC6H5. D. C6H5COOCH3.
Câu 14. Nhóm chất nào dưới đây đều có tính lưỡng tính?
A. NaHCO3, Cr2O3. B. Cr(OH)3, CrO3. C. Al(OH)3, CrO3. D. Na2CO3, NaHCO3.
Câu 15. Để hòa tan hoàn toàn 2,8 gam Fe người ta cần dùng vừa đủ V ml dung dịch HCl 2M. Giá trị của V là
A. 50. B. 75. C. 100. D. 150.
(Xem giải) Câu 16. Tiến hành các thí nghiệm trong dung dịch: (1) Fe(NO3)2 + NaOH; (2) Fe(NO3)2 + HCl; (3) FeSO4 + AgNO3; (4) FeSO4 + H2S. Các thí nghiệm có xảy ra phản ứng hóa học bao gồm
A. Chỉ (1)(2)(3). B. Chỉ (3)(4). C. Chỉ (1)(4). D. Cả (1)(2)(3)(4).
(Xem giải) Câu 17. Cho các chất: H2O, Na2CO3, Al(OH)3, CH3COONH4, Mg(OH)2. Số chất lưỡng tính trong nhóm này là
A. 4. B. 3. C. 5. D. 2.
(Xem giải) Câu 18. Cho các polime: poli(vinyl clorua), xenlulozơ, policaproamit, polistiren, xenlulozơ triaxetat, tơ visco, nilon-6,6. Số lượng polime thiên nhiên và polime nhân tạo trong nhóm này là
A. 1 và 1. B. 2 và 1. C. 1 và 2. D. 2 và 3.
(Xem giải) Câu 19. Đốt cháy hoàn toàn amin X (no, đơn chức, mạch hở) thu được 0,2 mol CO2 và 0,05 mol N2. Phát biểu nào không đúng về X?
A. X tác dụng với dung dịch H2SO4 loãng. B. Dung dịch nước của X làm quỳ tím hóa xanh.
C. Công thức phân tử của X là C2H7N. D. Tên gọi của X là etylamin.
(Xem giải) Câu 20. Một hệ thống dùng để điều chế khí Y được mô tả như sau
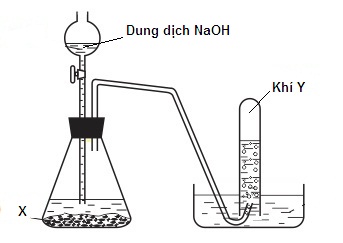
Phát biểu nào sau đây không đúng
A. Nếu chất X là Al thì khí Y là H2. B. Khí Y được thu bằng phương pháp dời chỗ nước.
C. Trong quá trình nước bị dời chỗ, áp suất khí trong cốc bằng áp suất khí quyển bên ngoài.
D. Nếu chất X là NH4Cl thì khí Y là NH3.
(Xem giải) Câu 21. Cho 0,02 mol Cu và 0,01 mol Fe3O4 vào 200 ml dung dịch HCl 0,2M. Sau phản ứng khối lượng chất rắn không tan còn lại là
A. 2,12. B. 0,64. C. 1,28. D. 1,80.
(Xem giải) Câu 22. Thực hiện các thí nghiệm
(a) Nung nóng NaNO3.
(b) Cho Fe(OH)2 vào dung dịch H2SO4 đặc, nóng dư.
(c) Cho bột CaF2 vào dung dịch H2SO4 đặc, nóng.
(d) Cho dung dịch KHSO4 vào dung dịch NaHCO3.
(e) Cho dung dịch Fe(NO3)2 vào dung dịch HCl loãng.
(g) Cho đinh sắt vào dung dịch H2SO4 loãng.
(h) Cho bột CuS vào dung dịch H2SO4 loãng.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm sinh ra chất khí là
A. 5. B. 6. C. 4. D. 7.
(Xem giải) Câu 23. Hòa tan m gam Al2O3 cần vừa đủ 500 ml dung dịch NaOH 0,4M. Cũng hòa tan m gam Al2O3 cần dùng vừa hết x gam dung dịch H2SO4 9,8%. Giá trị x là
A. 200. B. 300. C. 150. D. 100.
(Xem giải) Câu 24. Cho các phát biểu sau:
(1) Magie tác dụng với H2O rất chậm ở nhiệt độ phòng tạo Mg(OH)2
(2) Mg tác dụng nhanh với hơi nước nóng tạo ra MgO
(3) Thạch cao sống có công thức hóa học là CaSO4.H2O
(4) Nước cứng chứa các muối MgSO4, Ca(HCO3)2 là nước cứng toàn phần
(5) Đun nóng có thể làm mềm tất cả các loại nước cứng
(6) Ca(OH)2 là chất rắn màu trắng, tan rất nhiều trong nước
(7) Kim loại Ca được dùng làm chất khử tách oxi, lưu huỳnh ra khỏi thép
Số nhận xét đúng là:
A. 5. B. 7. C. 4. D. 6.
(Xem giải) Câu 25. Cho các phát biểu liên quan đến NaHCO3:
(1) NaHCO3 là một chất có tính lưỡng tính.
(2) Dung dịch NaHCO3 có môi trường axit (pH < 7).
(3) NaHCO3 bị phân hủy khi đun nóng.
(4) NaHCO3 được điều chế bằng cách cho CO2 tác dụng với một lượng dư dung dịch NaOH.
Số nhận xét đúng là
A. 3. B. 4. C. 2. D. 1.
(Xem giải) Câu 26. Cho các hỗn hợp (1) CH2=CH2 và CH3-CH=CH2; (2 CH2=CH2 và CH3-CH=CH-CH3; (3) CH3-CH=CH2 và CH3-CH=CH-CH3; (4) CH3-CH=CH-CH3 và CH2=CH-CH2-CH3. Hỗn hợp khí tác dụng với H2O (có mặt xúc tác H2SO4 loãng) tạo ra ba ancol có cấu tạo khác nhau gồm
A. (3)(4). B. (1)(2)(3). C. (1)(3). D. (1)(3)(4).
(Xem giải) Câu 27. Cốc (1) chứa dung dịch NaOH a mol/l, cốc (2) chứa dung dịch NaOH b mol/l. Lấy 20 ml dung dịch ở cốc (1) trộn với 80 ml dung dịch ở cốc (2) được 100 ml dung dịch có pH = 14. Lấy 80 ml dung dịch ở cốc (1) trộn với 20 ml dung dịch ở cốc (2) được 100 ml dung dịch có pH = 13,7. Trộn 50 ml dung dịch ở cốc (1) trộn với 50 ml dung dịch ở cốc (2) được 100 ml dung dịch có pH bằng
A. 13,42. B. 14,13. C. 13,75. D. 13,87.
(Xem giải) Câu 28. Đốt cháy hoàn toàn 29,6 gam hỗn hợp X gồm CH3COOH, CxHyCOOH và (COOH)2 thu được 14,4 gam H2O và m gam CO2. Mặt khác, 29,6 gam hỗn hợp X phản ứng hoàn toàn với NaHCO3 dư thu được 11,2 lít (đktc) khí CO2. Giá trị của m là
A. 32,3. B. 44,0. C. 48,4. D. 52,8.
(Xem giải) Câu 29. Gọi x là số lượng các hợp chất hữu cơ mạch hở có công thức phân tử C3H5Cl, y là số đồng phân có cấu tạo tương ứng với công thức phân tử C4H10O. Tổng giá trị x + y là
A. 11. B. 7. C. 10. D. 9.
(Xem giải) Câu 30. Nung nóng hỗn hợp gồm 2,7 gam Al và 14,4 gam FeO, sau một thời gian thu được chất rắn X. Hòa tan hoàn toàn X trong dung dịch chứa 0,15 mol HNO3 và 0,9 mol HCl, thu được dung dịch Y. Cho Y tác dụng hoàn toàn với lượng dư dung dịch AgNO3, thu được m gam chất rắn. Biết khí NO là sản phẩm khử duy nhất của N+5. Giá trị của m là
A. 129,15. B. 150,45. C. 134,55. D. 130,50.
(Xem giải) Câu 31. Hỗn hợp E gồm chất X (C3H10N2O4) và chất Y (C3H12N2O3). Chất X là muối của axit hữu cơ đa chức, chất Y là muối của một axit vô cơ. Cho 2,62 gam E tác dụng với dung dịch NaOH dư, đun nóng, thu được 0,04 mol hỗn hợp hai khí (có tỉ lệ mol 1 : 3) và dung dịch chứa m gam muối. Giá trị lớn nhất của m là
A. 2,54. B. 2,40. C. 3,46. D. 2,26.
(Xem giải) Câu 32. Hòa tan hoàn toàn 80,7 gam hỗn hợp X gồm Fe(NO3)2 và KCl vào nước thu được 500 ml dung dịch Y. Điện phân dung dịch Y (có màng ngăn, điện cực trơ) đến khi H2O bắt đầu bị điện phân ở cả hai điện cực thì dừng. Khi đó số mol khí thoát ra ở anot bằng ba lần số mol khí thoát ra ở catot. Lấy 250 ml dung dịch Y cho tác dụng với một lượng dư dung dịch AgNO3 thu được y gam kết tủa. Các phản ứng xảy ra hoàn toàn, giá trị của y là
A. 29,55. B. 43,05. C. 53,85. D. 86,10.
(Xem giải) Câu 33. Hòa tan hoàn toàn 1,88 gam hỗn hợp X gồm Fe, S, FeS, FeS2 trong dung dịch HNO3 đặc, dư thu được 5,376 lít khí NO2 (đktc, sản phẩm khử duy nhất của N+5) và dung dịch Y. Cho một lượng dư dung dịch Ba(OH)2 vào dung dịch Y, lọc kết tủa rồi đem nung đến khối lượng không đổi thu được m gam chất rắn. Giá trị m gần nhất với
A. 4,67. B. 5,72. C. 7,52. D. 8,77.
(Xem giải) Câu 34. Cho m gam bột Fe vào 800 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và H2SO4 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,6m gam hỗn hợp bột kim loại và V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của m và V lần lượt là
A. 10,8 và 2,24. B. 17,8 và 2,24. C. 17,8 và 4,48. D. 10,8 và 4,48.
(Xem giải) Câu 35. Đốt cháy hoàn toàn 0,1 mol este no, mạch hở cần vừa hết V lít không khí (20%O2 và 80%N2 theo thể tích, đktc). Hấp thụ toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 dư. Sau phản ứng hoàn toàn thu được 40 gam kết tủa và một dung dịch có khối lượng giảm 17 gam so với khối lượng của dung dịch Ca(OH)2 ban đầu. Giá trị của V là
A. 39,20. B. 7,84. C. 31,36. D. 50,4.
(Xem giải) Câu 36. Cho hỗn hợp gồm a mol kim loại kiềm A và b mol Al vào H2O. Sau khi kết thúc phản ứng thu được dung dịch B và 0,5(a + 3b) mol H2. Cần cho dung dịch B tác dụng nhiều nhất với V lít dung dịch HCl 1M để thu được 39b gam kết tủa. Biếu thức tính giá trị của V theo a và b là
A. V = a + 2,5b. B. V = a – 0,5b. C. V = a + 1,5b. D. V = a + 3b.
(Xem giải) Câu 37. Dung dịch X chứa a mol NaOH và b mol Ba(AlO2)2. Nhỏ từ từ dung dịch H2SO4 2M vào dung dịch X. Sự thay đổi khối lượng kết tủa theo số mol H2SO4 thêm vào được mô tả thông qua đồ thị dưới đây
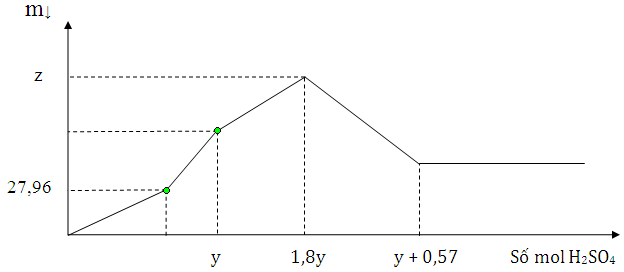
Giá trị của b và z lần lượt là
A. 0,15 và 58,35. B. 0,18 và 70,02. C. 0,25 và 97,25. D. 0,12 và 46,68.
(Xem giải) Câu 38. Cho hỗn hợp X gồm 3,2 gam Cu và 24 gam Fe2O3 vào 800 ml dung dịch HCl 2M thu được dung dịch Y. Điện phân dung dịch Y bằng dòng điện có cường độ 5A trong t phút thu được 8,8 gam kim loại ở catot. Giá trị của t là
A. 193. B. 97. C. 194. D. 386.
(Xem giải) Câu 39. Hỗn hợp X gồm hexan, etanol, glyxerol, etylen glycol, axit axetic trong đó số mol axit axetic bằng tổng số mol các chất còn lại. Cho m gam hỗn hợp X tác dụng với một lượng dư Na thu được 728 cm3 khí H2 (đktc). Đốt cháy m gam hỗn hợp X hấp thụ toàn bộ sản phẩm cháy bằng 1000 ml dung dịch Ba(OH)2 0,1M thu được 14,775 kết tủa và khối lượng dung dịch sau phản ứng giảm 6,575 gam so với trước phản ứng. Giá trị m bằng?
A. 3,24. B. 4,60. C. 2,72. D. 2,84.
(Xem giải) Câu 40. X, Y (MX < MY) là hai axit kế tiếp thuộc cùng dãy đồng đẳng axit fomic; Z là este hai chức tạo bởi X, Y và ancol T. Đốt cháy 12,52 gam hỗn hợp E chứa X, Y, Z, T (đều mạch hở) cần dùng 8,288 lít O2 (đktc) thu được 7,2 gam nước. Mặt khác đun nóng 12,52 gam E cần dùng 380 ml dung dịch NaOH 0,5M. Biết rằng ở điều kiện thường, ancol T không tác dụng được với Cu(OH)2. Phần trăm số mol của X có trong hỗn hợp E là.
A. 60% B. 50% C. 75% D. 70%


Bình luận