[2022 – 2023] Thi HSG 10 trường Phạm Ngũ Lão – Hải Phòng
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Thời gian làm bài: 120 phút
⇒ Đề thi, đáp án và giải chi tiết:
Câu 1 (1,5 điểm).
(Xem giải) 1/ Một nguyên tố R có 3 đồng vị X, Y, Z, tổng số hạt cơ bản (e, p, n) của 3 đồng vị bằng 129. Số neutron của đồng vị X bằng số proton, số neutron của đồng vị Z hơn đồng vị Y 1 hạt.
a. Xác định số khối của 3 đồng vị.
b. Cho biết tỷ lệ số nguyên tử của các đồng vị như sau: X : Y = 1846 : 94 và Y : Z = 141 : 90, xác định khối lượng nguyên tử trung bình của R và khối lượng của 30,1.10²³ nguyên tử R.
(Xem giải) 2/ Trong công thức oxide cao nhất của nguyên tố A (nằm ở nhóm A) oxygen chiếm 72,73% khối lượng. Xác định công thức phân tử của oxide trên.
(Xem giải) Câu 2 (1,0 điểm).
Biết X ở chu kì 3 và Y ở chu kì 2 trong bảng tuần hoàn các nguyên tố hóa học. Tổng số electron lớp ngoài cùng của X và Y là 10. Ở trạng thái cơ bản số electron p của X nhiều hơn số electron p của Y là 8.
a) Xác định số electron phân lớp ngoài cùng của X, Y.
b) Viết cấu hình electron đầy đủ của X, Y. Gọi tên X, Y
c) Viết công thức của oxide, hydroxide ứng với hóa trị cao nhất của các nguyên tố X, Y. So sánh tính chất của các hydroxide (Viết phương trình minh họa).
(Xem giải) Câu 3 (1,0 điểm).
Cho các chất sau: C2H6, CH3OH, CH3COOH
a) Chất nào có thể tạo được liên kết hydrogen? Vì sao?
b) Trong dung dịch CH3COOH có những kiểu liên kết hydrogen nào? Kiểu nào bền nhất và kém bền nhất? Mô tả bằng hình vẽ.
Câu 4: (1,5 điểm).
Cân bằng các phản ứng oxi hoá khử sau theo phương pháp thăng bằng electron:
(Xem giải) a) C2H5OH + K2Cr2O7 + HCl → CH3CHO + KCl + CrCl3 + H2O
(Xem giải) b) C6H5-CH=CH2 + KMnO4 → C6H5-COOK + K2CO3 + MnO2 + KOH + H2O
(Xem giải) c) Na2SO3 + KMnO4 + NaHSO4 → Na2SO4 + MnSO4 + K2SO4 + H2O
Câu 5: (2,0 điểm).
(Xem giải) 1. Đốt bột iron (sắt) trong khí oxygen thu được hỗn hợp chất rắn X gồm Fe và 3 oxide của iron. Hòa tan hoàn toàn 19,2 gam hỗn hợp X vào dung dịch chứa 0,8 mol H2SO4 đặc, dư, đun nóng, thu được dung dịch Y và khí V ((lit) SO2 (sản phẩm khử duy nhất đo ở đktc). Cho 350ml dung dịch NaOH 2M vào dung dịch Y thu được 21,4 gam kết tủa và dung dịch Z chứa m (gam) chất tan. Tính V, m.
(Xem giải) 2. Trong quá trình bảo quản, một mẫu muối FeSO4.7H2O (có khối lượng m gam) bị oxi hóa bởi oxygen không khí tạo thành hỗn hợp X chứa các hợp chất của Fe (II) và Fe (III). Hòa tan toàn bộ X trong dung dịch loãng chứa 0,025 mol H2SO4, thu được 100 ml dung dịch Y. Tiến hành hai thí nghiệm với Y:
Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 20 ml dung dịch Y, thu được 2,33 gam kết tủa.
Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 20 ml dung dịch Y, thu được dung dịch Z. Nhỏ từ từ dung dịch KMnO4 0,1M vào Z đến khi phản ứng đủ thì hết 8,6 ml. Tính giá trị của m và phần trăm số mol Fe(II) đã bị oxi hóa trong không khí .
(Xem giải) Câu 6: (1 điểm).
Một người thợ xây trong buổi sáng kéo được 500 kg vật liệu xây dựng lên tầng cao 10m. Để bù vào năng lượng đã tiêu hao, người đó cần uống cốc nước hòa tan m gam glucose. Biết nhiệt tạo thành của glucose (C6H12O6), CO2 và H2O lần lượt là -1271, -393,5 và -285,8 kJ/mol. Tính giá trị của m.
Câu 7: (1 điểm).
(Xem giải) a) Giải thích tại sao ion CO32-, không thể nhận thêm một nguyên tử oxygen để tạo ion CO42- trong khi đó ion SO32- có thể nhận thêm 1 nguyên tử oxygen để tạo thành ion SO42-?
(Xem giải) b) Giải thích tại sao hai phân tử NO2 có thể kết hợp với nhau tạo ra phân tử N2O4, trong khi đó hai phân tử CO2 không thể kết hợp với nhau để tạo ra phân tử C2O4
Câu 8: (1 điểm).
(Xem giải) 1. Hình vẽ dưới đây mô tả thí nghiệm sinh ra khí Z:
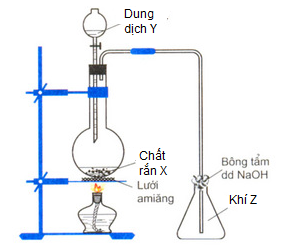
Hãy xác định chất rắn X, dung dịch Y, khí Z (có thể có) trong thí nghiệm trên. Viết phương trình phản ứng minh họa. [các điều kiện khác coi như có đủ]
(Xem giải) 2. Cho phản ứng đốt cháy butane sau:
C4H10 (g) + O2 (g) → CO2 (g) + H2O (g) (1)
Biết năng lượng liên kết trong các hợp chất cho trong bảng sau:
| Liên kết | Phân tử | Eb (kJ /mol) | Liên kết | Phân tử | Eb (kJ /mol) |
| C-C | C4H10 | 346 | C=O | CO2 | 799 |
| C-H | C4H10 | 418 | O-H | H2O | 467 |
| O=O | O2 | 495 |
a) Xác định biến thiên enthalpy (![]() ) của phản ứng (1)
) của phản ứng (1)
b) Một bình gas chứa 12 kg butane có thể đun sối bao nhiêu ấm nước? (Giả thiết mỗi ấm nước chứa 2 lit nước ở 25°C, nhiệt dung của nước là 4,2J/g.K, có 40% nhiệt đốt cháy butane bị thất thoát ra ngoài môi trường.

Bình luận