[2022 – 2023] Thi HSG 10 trường Phùng Khắc Khoan – Hà Nội
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Thời gian làm bài: 150 phút
⇒ Đề thi, đáp án và giải chi tiết:
Câu 1: (3 điểm)
(Xem giải) a) Cho các nguyên tố Sulfur (S) (Z = 16); Iron (Fe) (Z = 26); Chromium (Cr) (Z = 24); Copper (Cu) (Z = 29). Viết cấu hình electron nguyên tử và ion của S, Fe, Cr, Cu, S2- , Fe2+, Fe3+, Cr3+, Cu2+? Biểu diễn cấu hình electron theo ô orbital của S, Fe, Cr, Cu.
(Xem giải) b) X, Y, R, A, B, M theo thứ tự là 6 nguyên tố liên tiếp trong Hệ thống tuần hoàn có tổng số đơn vị điện tích hạt nhân là 63 (X có số đơn vị điện tích hạt nhân nhỏ nhất).
– Xác định số đơn vị điện tích hạt nhân của X, Y, R, A, B, M.
– So sánh bán kính của X2−, Y−, R, A+, B2+, M3+ và giải thích?
Câu 2: (3 điểm)
(Xem giải) a) Bán kính nguyên tử và khối lượng mol nguyên tử của iron (Fe) lần lượt là 1,28Å và 56 g/mol. biết rằng trong tinh thể, các nguyên tử Fe chỉ chiếm 74% thể tích, còn lại là khe trống. Tính khối lượng riêng của nguyên tử Fe.
(Xem giải) b) Trong thể dục thể thao, có một số vận động viên sử dụng các loại chất kích thích trong thi đấu, gọi là doping, dẫn đến thành tích đạt được của họ không thật so với năng lực vốn có. Một trong các loại doping thường gặp nhất là testosterone tổng hợp. Tỉ lệ giữa hai đồng vị 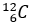 (98,98%) và
(98,98%) và 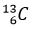 (1,11%) là không đổi đối với testosterone tự nhiên trong cơ thể. Trong khi testosterone tổng hợp (tức doping) có phần trăm số nguyên tử đồng vị
(1,11%) là không đổi đối với testosterone tự nhiên trong cơ thể. Trong khi testosterone tổng hợp (tức doping) có phần trăm số nguyên tử đồng vị 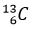 ít hơn testosterone tự nhiên. Đây chính là mấu chốt của xét nghiệm CIR (Carbon Isotope Ratio – Tỉ lệ đồng vị carbon) – một xét nghiệm với mục đích xác định xem vận động viên có sử dụng doping hay không.
ít hơn testosterone tự nhiên. Đây chính là mấu chốt của xét nghiệm CIR (Carbon Isotope Ratio – Tỉ lệ đồng vị carbon) – một xét nghiệm với mục đích xác định xem vận động viên có sử dụng doping hay không.
Giả sử, thực hiện phân tích CIR đối với một vận động viên thu được kết quả phần trăm số nguyên tử đồng vị 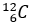 là x và
là x và 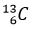 là y. Từ tỉ lệ đó, người ta tính được nguyên tử khối trung bình của carbon trong mẫu phân tích có giá trị là 12,0098. Với kết quả thu được, em có nghi ngờ vận động viên này sử dụng doping hay không? Vì sao?
là y. Từ tỉ lệ đó, người ta tính được nguyên tử khối trung bình của carbon trong mẫu phân tích có giá trị là 12,0098. Với kết quả thu được, em có nghi ngờ vận động viên này sử dụng doping hay không? Vì sao?
Câu 3: (3 điểm)
(Xem giải) a) Nguyên tố A là thành phần thiết yếu cho mọi sự sống. D là nguyên tố rất quan trọng trong nhiều ngành công nghiệp đồ gốm, men sứ, thuỷ tinh, vật liệu bản dẫn, vật liệu y tế, …. Oxide ứng với hóa trị cao nhất của hai nguyên tố A và D đều có dạng RO2. Hợp chất khí với hydrogen của A chứa 25 % hydrogen về khối lượng, còn hợp chất khí với hydrogen của D chứa 87,5 % D về khối lượng.
– Viết công thức hợp chất khí với hydrogen của các nguyên tố A và D.
– Viết công thức oxide ứng với hoá trị cao nhất của A, D và hydroxide tương úng. So sánh tính acid – base giữa các oxide, hydroxide đó. Giải thích.
(Xem giải) b) Phosphine là hợp chất hóa học giữa phosphorus với hydrogen, có công thức hóa học là PH3. Đây là chất khí không màu có mùi tỏi, rất độc, không bền tự cháy trong không khí ở nhiệt độ thường và tạo thành khối phát sáng bay lơ lửng. Phosphine sinh ra khi phân hủy xác động, thực vật và thường xuất hiện trong thời tiết mưa phùn (hiện tượng “ma trơi”). Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hóa học trong phosphine.
Câu 4: (4 điểm)
(Xem giải) a) Hydrogen sulfide (H2S) là một chất khí không màu, mùi trứng thối, độc. Theo tài liệu của Cơ quan Quản lí an toàn và sức khoẻ nghề nghiệp Hoa Kì, nồng độ H2S khoảng 100 ppm gây kích thích màng phổi. Nồng độ khoảng 400 – 700 ppm, H2S gây nguy hiểm đến tính mạng chỉ trong 30 phút. Nồng độ trên 800 ppm gây mất ý thức và làm tử vong ngay lập tức.
– Viết công thức Lewis và công thức cấu tạo của H2S.
– Em hiểu thế nào về nồng độ ppm của H2S trong không khí?
– Một gian phòng trống (25°C; 1 bar) có kích thước 3m x 4m x 6m bị nhiễm 10 gam khí H2S. Tính nồng độ ppm của H2S trong gian phòng trên. Đánh giá mức độ độc hại của H2S trong trường hợp này.
Cho biết 1 mol khí ở 25°C và 1 bar có thể tích 24,79 L.
(Xem giải) b) Liên kết hydrogen được hình thành trên cơ sở nào?
Đưa ra dự đoán và giải thích sự lựa chọn cho các câu hỏi dưới đây.
– Chất nào dễ hóa lỏng nhất: F2, NH3, CO2, CH4.
– Chất nào dễ tan trong nước nhất: H2, CH4, NH3.
– Chất nào có nhiêt độ sôi cao nhất: CO2, SO2, HF.
Câu 5: (3 điểm)
Cân bằng các phản ứng oxi hóa khử sau bằng phương pháp thăng bằng electron (trình bày cách cân bằng)
(Xem giải) 1. Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
(Xem giải) 2. FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
(Xem giải) 3. FeS2 + H2SO4 đặc → Fe2(SO4)3 + SO2 + H2O
(Xem giải) 4. Cr(OH)3 + Br2 + OH- → CrO42- + Br- + H2O
(Xem giải) 5. Na2SO3 + KMnO4 + NaHSO4 → Na2SO4 + MnSO4 + K2SO4 + H2O
(Xem giải) Câu 6: (4 điểm)
Hòa tan hoàn toàn m gam hỗn hợp hai kim loại A, B (MA < MB) thuộc nhóm IIA và ở hai chu kỳ liên tiếp cần vừa đủ 73 ml dung dịch HCl 20% (d = 1,1 g/ml), thu được dung dịch X và khí H2 ở đktc. Cô cạn dung dịch X thu được 21,22 gam chất rắn khan.
1. Xác định hai kim loại và % theo khối lượng các kim loại trong hỗn hợp ban đầu.
2. Nếu cho hỗn hợp hai kim loại trên vào 135 gam dung dịch CuCl2 25%. Sau phản ứng thu được dung dịch Y và chất rắn Z. Tính khối lượng chất rắn Z và nồng độ % các muối trong dịch Y. Biết các phản ứng xảy ra hoàn toàn.

Bình luận