[2022-2023][Hóa 10] Kiểm tra giữa kỳ 2 của sở GDĐT
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Giải chi tiết và đáp án:
⇒ Mã đề: 043
| 1C | 2B | 3C | 4A | 5D | 6B | 7B | 8B | 9C | 10C |
| 11D | 12D | 13B | 14A | 15C | 16C | 17B | 18A | 19D | 20C |
| 21D | 22D | 23C | 24B | 25D | 26A | 27A | 28A | 29B | 30B |
| 31D | 32A | 33A | 34D | 35D | 36A | 37A | 38C | 39A | 40C |
(Xem giải) Câu 1. Cho phương trình nhiệt hóa học của phản ứng:
N2(g) + O2(g) → 2NO(l)  = +179,20kJ
= +179,20kJ
Phản ứng trên là phản ứng
A. không có sự thay đổi năng lượng. B. tỏa nhiệt.
C. thu nhiệt. D. có sự giải phóng nhiệt lượng ra môi trường.
(Xem giải) Câu 2. Cho phản ứng sau: Fe + H2SO4 → FeSO4 + H2. Trong phản ứng trên H2SO4 đóng vai trò
A. Chất xúc tác. B. Chất oxi hoá.
C. Chất khử. D. Vừa khử, vừa oxi hoá.
(Xem giải) Câu 3. Cho phản ứng sau: 2CO (g) + O2 (g) → 2CO2 (g)
 (kJ/mol) của CO và CO2 lần lượt là –110,53 và –393,51. Lượng nhiệt giải phóng khi chuyển 56 gam khí CO thành khí CO2 là
(kJ/mol) của CO và CO2 lần lượt là –110,53 và –393,51. Lượng nhiệt giải phóng khi chuyển 56 gam khí CO thành khí CO2 là
A. 106,11 kJ. B. 282,98 kJ. C. 565,96 kJ. D. 424,47 kJ.
(Xem giải) Câu 4. Phản ứng đốt cháy than xảy ra như sau: C(s) + O2(g) → CO2(g). Enthalpy hình thành của CO2 là -353,61 (kJ/mol). Biến thiên enthalpy (kJ) của phản ứng khi tạo thành một mol CO2 có giá trị
A. -353,61. B. -707,22. C. +353,61. D. +707,22.
(Xem giải) Câu 5. Số oxi hoá của N trong ion NH4+ là
A. + 4. B. + 5. C. – 1. D. – 3.
(Xem giải) Câu 6. Trong phản ứng: Al + HNO3 → Al(NO3)3 + N2O + H2O. Số nguyên tử Al bị oxi hoá và số phân tử HNO3 bị khử (các hệ số nguyên, tối giản) là
A. 4 và 15. B. 8 và 6. C. 4 và 3. D. 8 và 30.
(Xem giải) Câu 7. Cho các phát biểu sau:
(1) Số oxi hóa của oxygen trong các hợp chất luôn là -2.
(2) Trong liên kết cộng hóa trị, cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn.
(3) Số oxi hóa của nitrogen trong các hợp chất N2O, Cu(NO3)2 và NO lần lượt là +1; +4; +2.
(4) Liên kết hóa học trong phân tử NaCl; MgO và HCl đều là liên kết ion.
(5) Phản ứng đốt cháy xăng, dầu là phản ứng oxi hoá khử.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 8. Cho phản ứng: Fe2+ + H+ + MnO4- → Fe3+ + Mn2+ + H2O. Tổng các hệ số tối giản của các chất và ion sau khi cân bằng phản ứng là:
A. 22. B. 24. C. 16. D. 18.
(Xem giải) Câu 9. Số oxi hoá của iron trong hợp chất FeSO4 là
A. – 1. B. + 1. C. +2. D. + 3.
(Xem giải) Câu 10. Cho phản ứng sau: 2H2S (g) + O2 (g) → 2S (s) + 2H2O (l)
Cho bảng giá trị  của một số chất:
của một số chất:
| Chất | H2O (l) | H2O (g) | SO2 (g) | H2S (g) |
 (kJ mol-1) (kJ mol-1) |
–285,83 | –241,82 | –296,83 | –20,63 |
 của phản ứng là:
của phản ứng là:
A. +530,4 kJ. B. – 265,2 kJ. C. –530,4 kJ. D. – 1060,8 kJ.
(Xem giải) Câu 11. Trong các phản ứng sau, phản ứng nào thuộc loại phản ứng oxi hoá- khử?
A. Cu(OH)2 + 2HCl → CuCl2 + 2H2O. B. BaCl2 + H2SO4 → BaSO4 + 2HCl.
C. CO2 + Ca(OH)2 → CaCO3 + H2O. D. 3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O.
(Xem giải) Câu 12. Cho các phản ứng sau:
(1) N2 + 3H2 → 2NH3  = –92,22 kJ
= –92,22 kJ
(2) 4Na (s) + O2 (g) → 2Na2O (s)  = –835,96 kJ
= –835,96 kJ
(3) H2 (g) + I2 (s) → 2HI (g)  = 52,96 kJ
= 52,96 kJ
(4) CaCO3 → CaO (s) + CO2 (g)  = 178,29 kJ
= 178,29 kJ
Phản ứng nào là phản ứng thu nhiệt?
A. (2) và (3). B. (1) và (2). C. (1) và (4). D. (3) và (4).
(Xem giải) Câu 13. Trong phản ứng Fe3O4 tác dụng với HNO3 tạo ra sản phẩm Fe(NO3)3, NO và H2O thì một phân tử Fe3O4 sẽ
A. nhường 2 electron. B. nhường 1 electron. C. nhận 1 electron. D. nhường 3 electron.
(Xem giải) Câu 14. Trong phản ứng: Cu + 2H2SO4 (đặc, nóng) → CuSO4 + SO2 + 2H2O, vai trò của acid H2SO4
A. vừa là chất oxi hóa, vừa là chất tạo môi trường. B. là chất khử.
C. vừa là chất khử, vừa là chất tạo môi trường. D. là chất oxi hóa.
(Xem giải) Câu 15. Trong phản ứng oxi hoá khử, chất khử là chất
A. Nhận proton. B. Nhường proton. C. Nhường electron. D. Nhận electron.
(Xem giải) Câu 16. Chất nào sau đây là hợp chất cộng hoá trị?
A. NaCl. B. H2. C. HCl. D. MgO.
(Xem giải) Câu 17. Cho phản ứng sau: aMnO2 + bHCl → xMnCl2 + yCl2 + zH2O
Trong phản ứng trên b có giá trị (Biết rằng a, b, x, y, z là hệ số nguyên tối giản của phản ứng sau khi đã cân bằng).
A. 6. B. 4. C. 2. D. 8.
(Xem giải) Câu 18. Sơ đồ nào sau đây thể hiện đúng liên kết hydrogen giữa 2 phân tử hydrogen fluoride (HF)
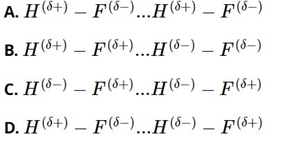
(Xem giải) Câu 19. Công thức Lewis của SO2 là
A. O = S = O. B. . C. O = S → O. D. .
(Xem giải) Câu 20. Cho 20 gam CaCO3 tan hoàn toàn trong dung dịch HCl dư, sau phản ứng thu được V lít khí CO2 ở điều kiện tiêu chuẩn. Giá trị của V là:
A. 3,36. B. 2,24. C. 4,48. D. 8,96.
(Xem giải) Câu 21. Phản ứng nhiệt nhôm là phản ứng dùng nhôm để khử các oxide kim loại ở nhiệt độ cao. Ứng dụng phổ biến của phản ứng là hàn đường ray xe lửa:
2Al (s) + Fe2O3 (s) → Al2O3 (s) + 2Fe (s)
Biết  của Fe2O3 (s) là –824,2 kJ/mol-1, của Al2O3 (s) là –1675,7 kJ/mol.
của Fe2O3 (s) là –824,2 kJ/mol-1, của Al2O3 (s) là –1675,7 kJ/mol.
Biến thiên enthalpy chuẩn của phản ứng trên là:
A.  = + 851,5 kJ. B.
= + 851,5 kJ. B.  = –824,2 kJ.
= –824,2 kJ.
C.  – 851,5 kJ/mol. D.
– 851,5 kJ/mol. D.  = – 851,5 kJ.
= – 851,5 kJ.
(Xem giải) Câu 22. Xác định năng lượng liên kết H–Cl của khí HCl từ các giá trị sau:
EH–H = 436 kJmol-1; ECl–Cl = 242 kJmol-1;
 HCl (g) = –92,31 kJmol-1.
HCl (g) = –92,31 kJmol-1.
A. EH–Cl = – 431,31 kJmol-1. B. EH–Cl = 436 kJmol-1.
C. EH–Cl = 242 kJmol-1. D. EH–Cl = 431,31 kJmol-1.
(Xem giải) Câu 23. Hòa tan hoàn toàn m gam Al vào HNO3 loãng dư thu được muối Al(NO3)3 và hỗn hợp khí gồm 0,015 mol N2O và 0,01 mol NO (phản ứng không tạo sản phẩm khử nào khác). Giá trị của m là
A. 0,81 gam. B. 8,1 gam. C. 1,35 gam. D. 13,5 gam.
(Xem giải) Câu 24. Số oxi hoá của Mn trong các hợp chất KMnO4, MnCl2, MnO2 lần lượt là
A. +2, +4, +7. B. +7, +2, +4. C. + 1, +4, +7. D. +1, +5, +7.
(Xem giải) Câu 25. Tình trạng ô nhiễm nước thải chứa nitrogen vào các nguồn nước đang ngày càng trở nên nghiêm trọng. Các học sinh thuộc đội bảo vệ môi trường của một trường học cho rằng có thể dùng aluminium để khử ion NO3- trong nước. Trong quá trình này, ion NO3- được khử thành N2 theo phương trình:
aAl + bNO3- + cH+ → xAl3+ + yN2 + zH2O
Giá trị của c trong phản ứng trên sau khi cân bằng với các hệ số a, b, c, x, y, z nguyên, tối giản là:
A. 18. B. 10. C. 6. D. 36.
(Xem giải) Câu 26. Điều kiện nào sau đây là điều kiện chuẩn?
A. Áp suất 1 bar và nhiệt độ 25°C hay 298K. B. Áp suất 1 bar và nhiệt độ 25K.
C. Áp suất 1 bar và nhiệt độ 273K. D. Áp suất 1 bar và nhiệt độ 250°C.
(Xem giải) Câu 27. Phản ứng nào sau đây HCl đóng vai trò là chất khử?
A. 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O. B. HCl + AgNO3 → AgCl + HNO3.
C. 2HCl + Zn → ZnCl2 + H2. D. HCl + NaOH → NaCl + H2O.
(Xem giải) Câu 28. Phản ứng nào sau đây là phản ứng oxi hoá khử nội phân tử
A. NH4NO2 → N2 + 2H2O. B. 8NH3 + 3Cl2 → N2 + 6NH4Cl.
C. 2NH3 + 3CuO → N2 + 3Cu + 3H2O. D. CaCO3 → CaO + CO2.
(Xem giải) Câu 29. Trong các chất và ion sau đây: Fe, Fe2+, SO2, Cl2, BaSO4. Có bao nhiêu chất và ion vừa có tính oxi hoá vừa có tính khử?
A. 2. B. 3. C. 5. D. 4.
(Xem giải) Câu 30. Cho các phản ứng sau:
1) 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
2) 6HCl + 2Al → 2AlCl3 + 3H2
3) 2HCl + Fe → FeCl2 + H2
4) HCl + NH4HCO3 → NH4Cl + CO2 + H2O
5) 2HCl + Zn → ZnCl2 + H2
Số phản ứng trong đó HCl thể hiện tính oxi hóa là?
A. 4. B. 3. C. 2. D. 5.
(Xem giải) Câu 31. Trong phân tử CH3Cl có mấy liên kết C-H?
A. 2. B. 1. C. 4. D. 3.
(Xem giải) Câu 32. Trong phản ứng : Mg + HNO3 → Mg(NO3)2 + NO + H2O. Tổng hệ số các chất tham gia phản ứng sau khi cân bằng với các hệ số nguyên, tối giản là:
A. 11. B. 21. C. 3. D. 8.
(Xem giải) Câu 33. Chlorine là nguyên tố thuộc nhóm VIIA, trong hợp chất của nó, số oxi hoá cao nhất của Cl là
A. +7. B. +5. C. +3. D. -1.
(Xem giải) Câu 34. Sự có mặt của khí SO2 trong không khí là nguyên nhân chính gây ra hiện tượng mưa acid. Nồng độ của SO2 có thể xác định bằng cách chuẩn độ với dung dịch pemanganat theo phản ứng sau: SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4
Biết một mẫu không khí phản ứng vừa đủ với 125 ml dung dịch KMnO4 0,008 M. Tính khối lượng (gam) của SO2 có trong mẫu không khí đó.
A. 160. B. 160.10^-6. C. 180.10^-6. D. 160.10^-3.
(Xem giải) Câu 35. Trong phản ứng tỏa nhiệt, biến thiên enthalpy chuẩn luôn nhận giá trị
A. Có thể âm có thể dương. B. Dương.
C. Không xác định được. D. Âm.
(Xem giải) Câu 36. Cho 5,6 gam Fe tác dụng hết với dung dịch HCl thu được V (lít) khí ở đktc. Giá trị của V là
A. 2,24. B. 1,12. C. 8,96. D. 5,6.
(Xem giải) Câu 37. Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
A. Phản ứng giữa Zn và dung dịch H2SO4.
B. Phản ứng đốt cháy cồn.
C. Phản ứng giữa H2 và O2 trong hỗn hợp khí.
D. Phản ứng nhiệt phân Cu(OH)2.
(Xem giải) Câu 38. Để hình thành phân tử NaCl từ các đơn chất tương ứng, nguyên tử Na đã
A. Nhận 1 electron. B. Nhường 2 electron. C. Nhường 1 electron. D. Nhường 1 proton.
(Xem giải) Câu 39. Cho quá trình: N+5 + 3e → N+2, đây là quá trình
A. khử. B. nhận proton. C. oxi hóa. D. tự oxi hóa – khử.
(Xem giải) Câu 40. Khi hoà tan hoàn toàn m gam hỗn hợp gồm Fe2O3, MgO, ZnO cần dùng vừa đủ 250 ml dung dịch H2SO4 0,2M. Sau phản ứng cô cạn dung dịch thu được 6,81 gam muối. Giá trị của m là
A. 3,81 gam. B. 5,81 gam. C. 2,81 gam. D. 4,81 gam.


Bình luận