[2024 – 2025] Đề chọn đội tuyển thi HSG tỉnh của Chuyên ĐH Vinh – Nghệ An
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Thời gian làm bài: 150 phút
⇒ Bảng đáp án phần trắc nghiệm:
| Phần 1 | Phần 2 | 13 | 14 | 15 | 16 | ||
| 1B | 2B | 3C | (a) | S | S | Đ | S |
| 4B | 5A | 6B | (b) | Đ | Đ | Đ | Đ |
| 7A | 8B | 9D | (c) | S | Đ | S | Đ |
| 10A | 11C | 12D | (d) | Đ | Đ | S | S |
| Phần 3 | Câu 17 | 39,3 | Câu 18 | 1 |
A. PHẦN TRẮC NGHIỆM (8,0 điểm)
PHẦN I (3,0 điểm): Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1: Cho các phân tử: H2; CO2; Cl2; N2; I2; CH4; C2H2. Có bao nhiêu phân tử chứa liên kết ba?
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 2: Xét phản ứng : 2NO2(g) (đỏ nâu) ⇋ N2O4(g) (không màu).
Tỉ khối hơi của hỗn hợp khí thu được so với H2 ở nhiệt độ t1 là 28,2; ở nhiệt độ t2 là 24,5 (t1 < t2). Có 3 ống nghiệm đựng khí NO2 (có nút kín). Sau đó: Ngâm ống thứ nhất vào cốc nước đá; ngâm ống thứ hai vào cốc nước sôi; ống thứ ba để ở điều kiện thường. Chọn phát biểu đúng trong các phát biểu sau:
A. Sau một thời gian, ống thứ nhất có màu đậm nhất, ống thứ ba có màu nhạt nhất.
B. Sau một thời gian, ống thứ nhất có màu nhạt nhất, ống thứ hai có màu đậm nhất.
C. Khi tăng áp suất cân bằng phản ứng chuyển dịch theo chiều nghịch.
D. Phản ứng theo chiều thuận là phản ứng thu nhiệt, làm giảm nhiệt độ môi trường.
(Xem giải) Câu 3. Phát biểu nào sau đây không đúng?
A. Cả glucose và fructose đều bị oxi hóa bởi thuốc thử Tollens.
B. Để phân biệt dung dịch glucose và fructose có thể dùng nước bromine.
C. Quá trình chuyển hóa tinh bột trong cơ thể người có sinh ra saccharose.
D. Tinh bột và cellulose không phải là đồng phân của nhau.
(Xem giải) Câu 4. Tiêu lệnh chữa cháy do cục cảnh sát phòng cháy, chữa cháy ban hành bao gồm các bước: (a) Dùng bình chữa cháy, cát và nước để dập tắt. (b) Điện thoại số 114 đội chữa cháy chuyên nghiệp. (c) Khi xảy ra cháy báo động gấp. (d) Cúp cầu dao điện nơi xảy ra cháy. Thứ tự đúng của các bước trên là
A. (d), (c), (a), (b). B. (c), (d), (a), (b). C. (d), (b), (a), (c). D. (c), (d), (b), (a).
(Xem giải) Câu 5. Myrcene là một hyđrocarbon được dùng để tạo hương thơm cay, nồng trong bia. Phân tử myrcene mạch hở, có 3 liên kết đôi và 22 liên kết đơn. Công thức phân tử của myrcene là
A. C10H16. B. C12H20. C. C11H18. D. C9H14.
(Xem giải) Câu 6. Trong những cơn mưa dông kèm sấm sét, nitrogen kết hợp trực tiếp với oxygen sau đó chuyển hoá thành phân đạm tự nhiên bổ sung vào đất, bón cho cây trồng. Hợp chất nào không xuất hiện trong quá trình chuyển hoá trên?
A. NO. B. N2O. C. HNO3. D. NO2.
(Xem giải) Câu 7: Khi đun nóng ethyl chloride trong dung dịch chứa KOH và C2H5OH, thu được
A. ethylene. B. ethanal. C. ethanol. D. ethyne.
(Xem giải) Câu 8. Catechin là một chất kháng oxi hóa mạnh, ức chế hoạt động của các gốc tự do nên có khả năng phòng chống bệnh ung thư, nhồi máu cơ tim. Trong lá chè tươi, catechin chiếm khoảng 25 – 35% tổng trọng lượng khô. Ngoài ra, catechin còn có trong táo, lê, nho… Công thức cấu tạo của catechin cho như hình bên:
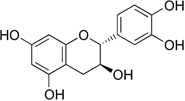
Phát biểu nào sau đây là không đúng?
A. Công thức phân tử của catechin là C15H14O6.
B. Phân tử catechin có 5 nhóm -OH phenol.
C. Catechin phản ứng được với dung dịch NaOH.
D. Catechin thuộc loại hợp chất thơm.
(Xem giải) Câu 9. Học sinh tiến hành một số thí nghiệm với ba hóa chất HCHO, CH3CHO, HCOOH (kí hiệu các chất X, Y, Z không theo thứ tự); kết quả thu được ở bảng sau:
| Thuốc thử/Chất | X | Y | Z |
| Tollens | p | p | p |
| I2/NaOH | x | p | x |
| NaHCO3 | x | x | p |
(Ghi chú: p: có phản ứng; x: không phản ứng) Phát biểu nào sau đây không đúng?
A. Chất Y phản ứng với I2 trong NaOH tạo kết tủa màu vàng.
B. Dung dịch Z làm mất màu nước bromine và có khí thoát ra.
C. Oxi hóa hoàn toàn X bằng nước bromine dư chỉ thu được các chất vô cơ.
D. Cho 1 mol Z tráng bạc hoàn toàn thu được tối đa 4 mol Ag.
(Xem giải) Câu 10. Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện,…) và giúp ngăn cản sự phát triển của một số loại vi khuẩn và nấm gây hại cho thực phẩm. Ở áp suất 1 bar và nhiệt độ 25°C: S(s) + O2(g) → SO2(g) ![]() = -296,8kJ
= -296,8kJ
Phát biểu nào sau đây không đúng?
A. Để tạo được 1 mol SO2 từ đơn chất cần cung cấp nhiệt lượng 296,8 kJ.
B. Nhiệt tạo thành chuẩn của sulfur dioxide bằng -296,8 kJ.mol.
C. Trong phản ứng trên sulfur là chất khử.
D. Cho 0,5 mol sulfur tác dụng hết với O2 giải phóng nhiệt lượng 148,4 kJ.
(Xem giải) Câu 11: Methadone là một loại thuốc dùng trong cai nghiện ma túy, nó thực chất cũng là một loại chất gây nghiện nhưng “nhẹ” hơn các loại ma túy thông thường và dễ kiểm soát hơn. Công thức cấu tạo của nó như hình dưới đây:
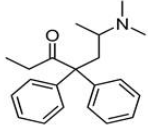
Phát biểu nào sau đây đúng?
A. Methadone có phản ứng với thuốc thử Tollens.
B. Công thức phân tử của methadone là C21H25NO.
C. Methadone bị khử bởi LiAlH4 tao alcohol bậc 2.
D. Methadone làm mất màu nước bromine.
(Xem giải) Câu 12. Có 5 dung dịch: NH3, HCl, NH4Cl, Na2CO3, CH3COOH cùng nồng độ được đánh ngẫu nhiên là A, B, C, D, E. Giá trị pH và khả năng dẫn điện của dung dịch theo bảng sau:
| Dung dịch | A | B | C | D | E |
| pH | 5,25 | 11,53 | 3,01 | 1,25 | 11,00 |
| Khả năng dẫn điện | Tốt | Tốt | Kém | Tốt | Kém |
Các dung dịch A, B, C, D, E lần lượt là
A. NH4Cl, NH3, CH3COOH, HCl, Na2CO3.
B. CH3COOH, NH3, NH4Cl, HCl, Na2CO3.
C. Na2CO3, HCl, NH3, NH4Cl, CH3COOH.
D. NH4Cl, Na2CO3, CH3COOH, HCl, NH3.
PHẦN II (4,0 điểm). Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, học sinh chọn đúng hoặc sai.
(Xem giải) Câu 13: Thực hiện phản ứng: 2HBr + Cl2 → Br2 + 2HCl. Nồng độ đầu của HBr và Cl2 được lấy đúng theo tỉ lệ hợp thức. Nghiên cứu sự thay đổi nồng độ các chất tham gia và chất tạo thành trong phản ứng theo thời gian, thu được đồ thị sau:
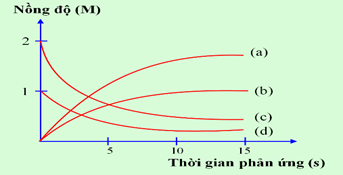
a) Đường (a) nồng độ HCl thay đổi theo thời gian: nồng độ tăng dần lượng tăng gấp đôi Cl2.
b) Đường (a), (b), (c), (d) lần lượt là: HCl, Br2, HBr, Cl2.
c) Tốc độ trung bình của phản ứng trong các khoảng thời gian 5 giây là như nhau.
d) Đường (c) nồng độ HBr thay đổi theo thời gian: nồng độ giảm dần, lượng giảm gấp đôi Cl2.
(Xem giải) Câu 14: Thí nghiệm khảo sát khả năng oxi hoá benzene và các đồng đẳng bằng dung dịch KMnO4:
• Bước 1: Cho khoảng 2 mL benzene vào ống nghiệm thứ nhất, 2 mL toluene vào ống nghiệm thứ hai, 2 ml ethylbenzene vào ống nghiệm thứ ba.
• Bước 2: Thêm vào mỗi ống nghiệm 2 mL dung dịch KMnO4 0,02M. Lắc đều mỗi ống trong 2 phút rồi để yên.
• Bước 3: Ngâm các ống vào cốc nước nóng khoảng 80°C thỉnh thoảng lắc nhẹ.
a) Sau bước 2, không có phản ứng xảy ra, hỗn hợp lỏng phân lớp, lớp phía trên có màu tím còn lớp dưới không màu.
b) Sau bước 3, ở ống nghiệm 2 và ống nghiệm 3 mất màu tím và xuất hiện kết tủa màu nâu đen.
c) Sau bước 3, cả ống nghiệm 2 và ống nghiệm 3 đều tạo thành sản phẩm hữu cơ là C6H5COOK.
d) Nếu thay ethylbenzene bằng styrene thì sau bước 2, dung dịch KMnO4 đã bị mất màu và xuất hiện kết tủa màu nâu đen.
(Xem giải) Câu 15: Từ tinh dầu bạc hà, người ta tách được A, đem A đi phân tích nguyên tố thu được kết quả 76,92% C; 12,82% H, còn lại là oxygen. Từ phổ MS thấy xuất hiện tín hiệu có giá trị mức lớn nhất 156. Biết A được điều chế bằng cách hydrogen hóa chất B là 2-isopropyl-5-methylphenol ở điều kiện thích hợp. Chất X là ester của A và acetic acid.
a) Công thức phân tử của A là C10H20O.
b) Oxi hóa A bằng CuO, đun nóng thu được sản phẩm C là một ketone.
c) A là một phenol, B là alcohol thơm.
d) Cho 0,1 mol X tác dụng hoàn toàn với dung dịch NaOH dư thu được 26 gam muối.
(Xem giải) Câu 16: Thực hiện sơ đồ các phản ứng sau theo đúng tỉ lệ mol:
X + Y → Z + A↑ + B
NaOH + Y → Z + B
Ba(OH)2 + Z → T↓ + 2NaOH
Ba(OH)2 + Y → T↓ + NaOH + B
Biết X, Y là hai hợp chất của sulfur có cùng thành phần nguyên tố và MX + MY = 224.
a) Khí A là nguyên nhân chính gây hiệu ứng nhà kính.
b) Kết tủa T bền với nhiệt, không tan trong dung dịch hydrochloric acid.
c) Chất A có khả năng làm mất màu nước bromine.
d) Dung dịch chứa Z hoặc Y đều làm quỳ tím hóa đỏ.
PHẦN III (1,0 điểm). Câu trắc nghiệm yêu cầu trả lời ngắn.
(Xem giải) Câu 17: Một loại phân NPK có độ dinh dưỡng được ghi trên bao bì 16-16-8. Để cung cấp 8,6 kg nitrogen; 1,75 kg phosphorus và 4,15 kg potassium cho một thừa ruộng, người ta sử dụng đồng thời x kg phân NPK (ở trên), y kg đạm urea độ dinh dưỡng là 45%) và z kg phân potassium (độ dinh dưỡng là 75%). Tính tổng giá trị (x + y + z). (Chỉ lấy gần bằng kết quả cuối cùng và làm tròn kết quả đến hàng phần mười).
(Xem giải) Câu 18. Có bao nhiêu phát biểu đúng trong các phát biểu sau?
(a) Phân tử C4H6 luôn chứa 2 liên kết π.
(b) Trong hợp chất hữu cơ nhất thiết phải có carbon và hydrogen.
(c) Những hợp chất hữu cơ có thành phần nguyên tố giống nhau, thành phần phân tử hơn kém nhau một hay nhiều nhóm CH2 là đồng đẳng của nhau.
(d) Phản ứng hữu cơ thường xảy ra chậm, theo nhiều hướng, tạo nhiều sản phẩm.
(e) Công thức tổng quát cho biết thành phần nguyên tố và số lượng nguyên tử của mỗi nguyên tố trong phân tử.
B – TỰ LUẬN (12 điểm)
Câu 1 (3,0 điểm):
(Xem giải) 1.1 (1,0 điểm) Hydrazine (N2H4) là chất lỏng, được sử dụng rộng rãi trong tổng hợp hoá hữu cơ và là một thành phần quan trọng trong nhiên liệu tên lửa, có mùi giống ammonia nhưng lại rất nguy hiểm. Nhiệt lượng toả ra khi 1 mol hydrazine lỏng bị phân huỷ thành ammonia và nitrogen là 111,9 kJ ở điều kiện chuẩn.
a) Viết phương trình nhiệt hoá học của phản ứng trên (hệ số cân bằng là số nguyên tối giản nhất) và tính nhiệt tạo thành chuẩn của hydrazine.
Cho biết: NH3 có ![]() = -45,9 KJ/mol.
= -45,9 KJ/mol.
b) Dự đoán tính tan của hydrazine trong nước. Giải thích.
c) Một nhóm nghiên cứu của trường đại học Old Dominion (Hoa Kỳ) đã tiến hành khảo sát sự chuyển hoá năng lượng nhiệt của phản ứng thành năng lượng cơ học để sử dụng trong động cơ tên lửa mô hình. Thí nghiệm cho thấy rằng với lượng nhiệt toả ra là 4029,5 kJ thì tên lửa đạt độ cao cực đại khi bắn là 134,7 m. Với lượng nhiệt toả ra khi phân huỷ 500 gam N2H4 có thể bắn tên lửa đạt độ cao cực đại không?
(Xem giải) 1.2 (1,0 điểm): Chất rắn A có sẵn trong tự nhiên dưới dạng nhiều loại khoáng khác nhau. Nung nóng A ở 900°C là phương pháp để sản xuất lượng lớn chất B. Cho B phản ứng với nước sẽ được chất X và tỏa nhiều nhiệt. Trong phòng thí nghiệm, dung dịch nước của X được dùng để phát hiện khí D. Khí D được sử dụng trong rất nhiều loại nước giải khát.
a) Viết các phản ứng hóa học xảy ra trong quá trình ở trên.
b) Vì sao khí D có thể dùng làm chất chữa cháy? Khí D không dùng để chữa cháy trong trường hợp nào? Giải thích.
c) Khí D ở trên có nhiều ứng dụng trong công nghiệp, một trong số đó là điều chế muối E (có trong thành phần bột nở) theo phương pháp Solvay: cho một lượng bằng nhau về số mol của NH3 và khí D sục qua dung dịch sodium chloride (nước biển) ở nhiệt độ thấp. Sản phẩm tạo thành ngoài muối E còn có muối ammonium chloride. Do ít tan ở nhiệt độ thấp nên muối E sẽ kết tủa, tách khỏi dung dịch. Nhiệt phân E thu được soda. Viết phương trình hóa học xảy ra trong quá trình trên.
d) Từ D điều chế được một loại phân đạm phổ biến có hàm lượng đạm cao nhất trong các loại phân đạm trên thị trường hiện nay. Viết phương trình hóa học xảy ra.
(Xem giải) 1.3 (1,0 điểm): Phản ứng tạo NO từ NH3 là một giai đoạn trung gian trong quá trình sản xuất nitric acid, sinh ra các sản phẩm đều ở pha khí. Trong một thí nghiệm, cho vào bình phản ứng dung tích 5 lít (không đổi) 0,4 mol NH3 và 0,6 mol O2 rồi thực hiện phản ứng ở 850°C, xúc tác Pt. Sau khi phản ứng thực hiện 2,5 giờ thu được hỗn hợp X chứa 0,24 mol NO tạo thành.
a) Viết biểu thức tính tốc độ trung bình theo sự biến đổi nồng độ chất đầu và chất sản phẩm của phân ứng trên (hệ số cân bằng là các số nguyên tối giản nhất).
b) Tính tốc độ trung bình của phản ứng theo đơn vị mol/(L.min).
c) Tính phần trăm số mol của NH3 trong hỗn hợp X.
Câu 2. (3,0 điểm)
(Xem giải) 2.1. (1,0 điểm) Trong các nhà máy cung cấp nước sinh hoạt thì khâu cuối cùng của việc xử lí nước là khử trùng nước. Một trong các phương pháp khử trùng nước đang được dùng phổ biến ở nước ta là dùng chlorine.
a) Lượng chlorine được bơm vào nước trong bể tiếp xúc theo nồng độ 7,042.10^-6 M. Nếu với dân số Vinh là 576000 người, mỗi người dùng 0,2m³ nước/ngày, thì các nhà máy cung cấp nước sinh hoạt cần dùng bao nhiêu kg chlorine mỗi tuần cho việc xử lí nước?
b) Dùng chlorine để khử trùng nước sinh hoạt là một phương pháp rẻ tiền và dễ sử dụng. Tuy nhiên cần phải thường xuyên kiểm tra nồng độ chlorine dư ở trong nước bởi vì lượng chlorine dư nhiều sẽ gây nguy hiểm cho con người và môi trường. Cách đơn giản để kiểm tra lượng chlorine dư là dùng potassium iodide và hồ tinh bột. Hãy nêu hiện tượng của quá trình kiểm tra này và viết phương trình phản ứng xảy ra (nếu có).
c) Để sát trùng nước nhanh người ta bơm chlorine vào trong nước với hàm lượng 10g/m³ để có thể tiêu diệt các vi khuẩn và phá huỷ các hợp chất hữu cơ trong vòng 10 phút. Cuối giai đoạn khử trùng này người ta trung hoà chlorine dư bằng sulfur dioxide hoặc sodium sulfide. Hãy viết các phương trình phản ứng trung hoà đó?
d) Calcium hypochlorite được dùng làm chất chống tạo rong rêu trong vệ sinh bể bơi theo phản ứng sau: Ca(OCl)2 + 2H2O → 2HClO + Ca(OH)2
Calcium hypochlorite phản ứng với nước tạo hypochlorous acid là một tác nhân hoạt động. Ở pH bằng 7,0 có 32,5% acid ion hoá thành ion ClO- không hoạt động. Phần hypochlorous acid còn lại (67,5%) chuyển thành chlorine dùng làm sạch hồ bơi. Cần bao nhiêu kg calcium hypochlorite để thêm vào hồ bơi chứa 60 m³ nước để chlorine đạt tiêu chuẩn vệ sinh là 3ppm ở pH bằng 7,0 (1ppm = 10^-3 (g/L)).
(Xem giải) 2.2. (1,0 điểm) CAN là tên viết tắt của calcium ammonium nitrate là phân bón vô cơ được sử dụng rộng rãi trong nông nghiệp. Phân bón này là sự kết hợp của hai loại phân bón: calcium nitrate và ammonium nitrate. Phân bón CAN giúp cải tạo phục hồi đất, khử chua, hạ phèn; bổ sung calcium, magnesium, nitrogen…
Phân bón CAN được sản xuất bằng cách:
• Bước 1: Người ta điều chế ammonium nitrate bằng cách cho khí ammonia tác dụng với nitric acid nồng độ 60% trong lò phản ứng trung hòa.
• Bước 2: Cho dung dịch ammonium nitrate (chứa nitric acid dư) tác dụng với bột đá dolomite (CaCO3.MgCO3).
• Bước 3: CAN được làm khô trong máy sấy.
a) Viết các phương trình hóa học xảy ra trong quá trình sản xuất CAN.
b) Vì sao phân bón CAN rất dễ chảy rữa, có thể gây nổ ở nhiệt độ cao. Đề xuất biện pháp để bảo quản CAN?
(Xem giải) 2.3. (1,0 điểm) Khí SO2 do các nhà máy sinh ra là nguyên nhân quan trọng nhất gây ô nhiễm môi trường. Theo tiêu chuẩn quốc tế quy định nếu lượng SO2 vượt quá 10.10^-6 mol/m³ không khí thì bị coi là ô nhiễm. Kết quả phân tích 50 lít không khí ở một số khu vực như sau:
| Khu vực | Khối lượng SO2 |
| X | 0,042 mg |
| Y | 0,012 mg |
a) Hãy cho biết không khí của khu vực X, Y có bị ô nhiễm hay không? Giải thích.
b) Hydrogen sulfide (H2S) là một chất khí không màu, mùi trứng thối, độc. Theo tài liệu của cơ quan quản lí an toàn và sức khoẻ nghề nghiệp Hoa Kì, mức độ nguy hại của H2S như sau:
| Nồng độ H2S (tính theo thể tích) | Mức độ nguy hại |
| Khoảng 100 ppm | gây kích thích màng phổi |
| Khoảng 400 – 700 ppm | gây nguy hiểm đến tính mạng chỉ trong 30 phút |
| Trên 800 ppm | gây mất ý thức và làm tử vong ngay lập tức |
Một gian phòng trống (25°C; 1bar) có kích thước 3m × 4m × 4m bị nhiễm 20 gam khí H2S. (ppm là đơn vị để đo mật độ thể tích cực kỳ nhỏ; 1ppm = 10^-6). Tính nồng độ ppm của H2S trong gian phòng trên và đánh giá mức độ độc hại của H2S trong trường hợp này.
c) Trong thực tiễn, phản ứng giữa SO2 và H2S có ý nghĩa thu hồi các khí độc và tận dụng nguồn nguyên liệu sulfur. Viết phương trình hóa học xảy ra.
Câu 3 (3,5 điểm)
3.1. (1.0 điểm).
(Xem giải) a) Berberin là hợp chất isoquinoline alkaloid, màu vàng, có trong rất nhiều cây thuốc như vàng đẳng (Coscinium fenestratum (Gaertn) Colebr Menispermaceae).
Trong y học, berberin dùng để trị tiêu chảy do lỵ, amip,…
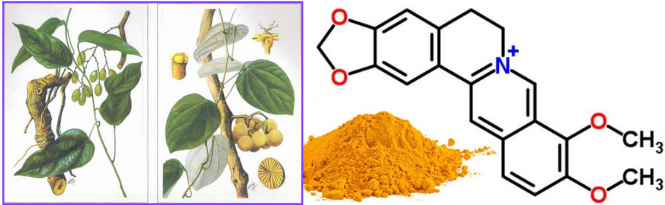
Để thu được berberin từ dược liệu vàng đắng, người ta thực hiện quy trình gồm các bước như sau:
1. Ngâm bột dược liệu vàng đắng trong nước vôi trong theo phương pháp ngâm lạnh.
2. Lọc lấy phần dịch, cho dung dịch HCl + NaCl nồng độ thích hợp vào để kết tủa berberin chloride.
3. Lọc lấy phần tủa, hòa tan kết tủa trong ethanol (vừa đủ), cho than hoạt tính vào để loại tạp chất và tẩy màu.
4. Đun nóng, lọc nóng, để nguội.
5. Lọc, xử lý làm khô tinh thể.
Hãy cho biết trong quy trình trên đã sử dụng những phương pháp nào để tách biệt và tinh chế hợp chất hữu cơ?
(Xem giải) b) Thực hiện thí nghiệm chưng cất ethanol từ dung dịch ethanol – nước:
Chuẩn bị: Rượu (được nấu thủ công); bình cầu có nhánh 250 mL, nhiệt kế, ống sinh hàn nước, ống nối, ống đong 50 mL, bình tam giác 100 mL, đá bọt, nguồn nhiệt (bếp điện, đèn cồn).
Tiến hành:
– Cho 60 mL rượu được nấu thủ công vào bình cầu có nhánh (chú ý chất lỏng trong bình không vượt quá 2/3 thể tích bình), thêm vài viên đá bọt.
– Lắp dụng cụ như hình dưới.
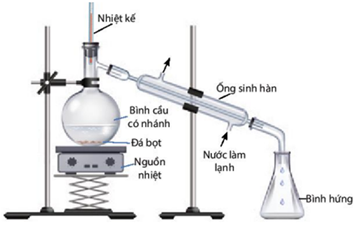
– Đun nóng từ từ đến khi hỗn hợp sôi, quan sát nhiệt độ trên nhiệt kế thấy tăng dần, khi nhiệt độ trên nhiệt kế ổn định, đó chính là nhiệt độ sôi của hỗn hợp ethanol và nước. Khi nhiệt độ bắt đầu tăng trở lại thì tắt nguồn nhiệt, ngừng chưng cất.
Hãy cho biết:
+ Vai trò của ống sinh hàn và đá bọt?
+ Trong quá trình chưng cất, tỉ lệ ethanol/nước trong bình cầu thay đổi như thế nào?
(Xem giải) 3.2. (1,5 điểm). Trong công nghiệp hiện đại, phần lớn acetone được sản xuất từ nguyên liệu là cumene (isopropylbenzene) theo sơ đồ:
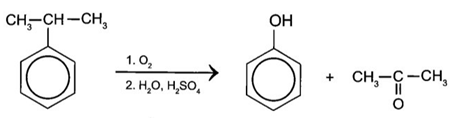
a) Tính khối lượng phenol và acetone (theo kg) thu được khi oxi hoá 1 tấn cumene trong công nghiệp. Biết hiệu suất của quá trình điều chế phenol và acetone từ cumene trong công nghiệp là 95%.
b) Vì sao acetone được dùng làm dung môi để lau sơn móng tay?
(Xem giải) c) Acetone được sử dụng như một nguyên liệu để tổng hợp methacrylic acid (một hợp chất được dùng nhiều trong tổng hợp thuỷ tinh hữu cơ) theo sơ đồ:
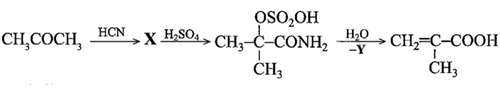
Xác định công thức cấu tạo chất X trong sơ đồ tổng hợp trên. Tính thể tích methacrylic acid (theo m³) tổng hợp được từ 10 m³ acetone theo sơ đồ trên. Biết hiệu suất mỗi giai đoạn là 80%; khối lượng riêng của methacrylic acid và acetone lần lượt là 1,015 g/mL và 0,7844 g/mL.
(Xem giải) d) Từ methacrylic acid, viết phương trình hóa học điều chế PMMA (poly(methyl methacrylate)).
(Xem giải) 3.3 (1,0 điểm). Học sinh Minh đề xuất một quá trình thí nghiệm chuyển hóa giữa các chất như sau: Thủy phân hoàn toàn maltose trong môi trường acid thu được chất A. Cho A lên men alcohol thu được chất B. Cho B tách nước thu được chất D. Khi cho D tác dụng với nước bromine, thu được chất X. Cho X vào lượng dư dung dịch NaOH đun nóng, tạo ra chất Y. Có thể điều chế Y trực tiếp từ D bằng một phản ứng. Cho Y tác dụng với Cu(OH)2 tạo dung dịch màu xanh lam. Cho Y tác dụng với Na tỉ lệ tối đa thu được chất khí. Biết các chất A, B, D, X, Y là các hợp chất hữu cơ. Viết các phương trình hóa học xảy ra trong quá trình trên.
Câu 4 (1,0 điểm).
(Xem giải) a) Trong công nghiệp, copper(II) sulfate được sản xuất bằng cách ngâm đồng phế liệu trong sulfuric acid loãng và sục không khí.
+ Lập phương trình hoá học của phản ứng trên.
+ Tại sao thực tế không sản xuất bằng cách ngâm đồng phế liệu trong sulfuric acid đặc.
(Xem giải) b) Copper(II) sulfate là hoá chất được sử dụng làm tăng sức đề kháng, chống chọi sâu bệnh cho cây trồng, làm thuốc kháng nấm… Độ tan của CuSO4 ở 85°C và 12°C lần lượt là 87,7 gam và 35,5 gam. Khi làm lạnh 1877 gam dung dịch bão hoà CuSO4 từ 85°C xuống 12°C thì có m gam tinh thể CuSO4.5H2O tách ra. Tính giá trị của m.
Câu 5 (1,5 điểm).
(Xem giải) 5.1. (1,0 điểm). Cho sơ đồ chuyển hóa sau:
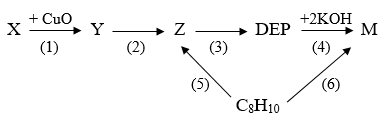
Trong đó: Hợp chất X có công thức phân tử C8H10O2 và có chứa vòng benzene, phổ IR của X có peak hấp thụ rộng ở vùng 3300 cm-1. Hợp chất Y đa chức, có peak hấp thụ đặc trưng ở khoảng 1700 cm-1. Chất DEP (ortho-diethyl phthalate) được sử dụng làm thuốc trị ghẻ ngứa, côn trùng đốt. Chất M là muối potassium của Z
a) Biện luận công thức cấu tạo X, Y.
b) Viết các phương trình hóa học (dùng công thức cấu tạo) hoàn thành sơ đồ phản ứng trên: (mỗi mũi tên là một phương trình hóa học, ghi rõ điều kiện phản ứng (nếu có)).
(Xem giải) 5.2. (0,5 điểm). Hợp chất X có công thức phân tử là C10H10O4, có chứa vòng benzene. Thực hiện sơ đồ chuyển hóa sau theo đúng tỉ lệ mol:
(1) X + 3NaOH → Y + H2O + T + Z
(2) Y + HCl → Y1+ NaCl
(3) C2H5OH + O2 → Y1 + H2O
(4) T + HCl → T1 + NaCl
Xác định công thức cấu tạo của X và T1. Biết các chất X, Y, Z, T, Y1, T1 là hợp chất hữu cơ, MT > MZ.

Bình luận