[2024 – 2025] Thi học sinh giỏi lớp 12 – Tỉnh Bắc Ninh
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề 052-H12A năm 2024-2025
⇒ Thời gian làm bài: 90 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1C | 2D | 3C | 4C | 5A | 6C | 7A | 8C | 9D | 10A |
| 11D | 12A | 13A | 14B | 15B | 16A | 17C | 18B | 19A | 20B |
| 21B | 22D | 23B | 24C | 25B | 26C | 27D | 28A | 29D | 30B |
| 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | |
| (a) | Đ | Đ | Đ | S | S | Đ | Đ | Đ |
| (b) | S | Đ | Đ | S | Đ | Đ | S | S |
| (c) | Đ | Đ | Đ | Đ | S | S | S | Đ |
| (d) | Đ | Đ | Đ | Đ | Đ | S | S | Đ |
| 39 | 40 | 41 | 42 | 43 | 44 |
| 45 | 3,1 | 138,8 | 761 | 10 | 252 |
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 30. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Sử dụng vôi sữa là phương pháp phổ biến để xử lí khí thải SO2. 90% lượng SO2 trong khí thải được hấp thụ theo phương trình hóa học: Ca(OH)2 + SO2 → CaSO3 + H2O. Sau đó CaSO3 bị oxi hóa hoàn toàn thành CaSO4 dưới tác dụng của oxygen. CaSO4 được lọc tách, làm sạch, nung khô và thu hồi dưới dạng thạch cao thương phẩm (2CaSO4.H2O) với hiệu suất 80%. Một nhà máy trong một ngày thải ra 2500 m³ khí thải (ở đkc) chứa 1% SO2 về thể tích. Khối lượng 2CaSO4.H2O thu được trong 30 ngày theo phương pháp trên đạt là
A. 3948,1 kg. B. 3509,4 kg. C. 3158,5 kg. D. 3262,5 kg.
(Xem giải) Câu 2. Một học sinh sử dụng các thanh kim loại, dây dẫn, bóng đèn nhỏ và các quả chanh để lắp ráp các hệ thống như hình dưới đây:
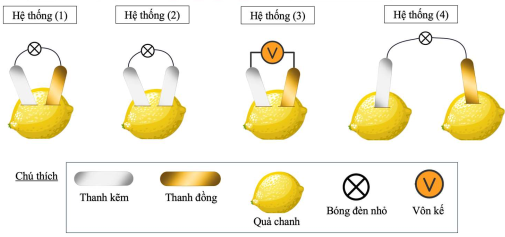
Ở các hệ thống (1), (2), (3), khi lắp ráp không để hai thanh kim loại chạm nhau. Cho các phát biểu sau:
(1) Các bóng đèn ở hệ thống (1) và (2) đều phát sáng do có dòng điện chạy qua.
(2) Ở hệ thống (2), nếu thay hai thanh kẽm bằng hai thanh đồng thì đèn vẫn sáng.
(3) Ở hệ thống (3), giá trị đọc được trên vôn kế chính là sức điện động chuẩn của pin Zn-Cu.
(4) Bóng đèn ở hệ thống (4) sáng hơn đèn ở hệ thống (1) do sử dụng nhiều chất điện li hơn.
(5) Ở hệ thống (1), độ sáng của bóng đèn sẽ giảm dần theo thời gian.
Số phát biểu đúng là
A. 3. B. 4. C. 2. D. 1.
(Xem giải) Câu 3. Tiến hành thí nghiệm theo các bước sau:
• Bước 1: Cho 10 mL dung dịch H2SO4 70% vào ống nghiệm khô (ống nghiệm (1)), sau đó thêm tiếp một nhúm bông vào ống nghiệm (1) và dùng đũa thủy tinh khuấy đều. Đặt ống nghiệm (1) vào cốc nước nóng và khuấy trong khoảng 3 phút để cho bông tan hết tạo dung dịch đồng nhất.
• Bước 2: Thêm từ từ NaHCO3 vào ống nghiệm (1) cho đến khi khí ngừng thoát ra.
• Bước 3: Cho 1 mL dung dịch AgNO3 1% vào ống nghiệm khô khác (ống nghiệm (2)), giọt dung dịch NH3 cho đến khi kết tủa vừa xuất hiện tan hết.
• Bước 4: Cho dung dịch trong ống nghiệm (1) vào ống nghiệm (2) và đun nóng nhẹ.
Cho các phát biểu sau:
(a) Trong bước 1, xảy ra phản ứng thủy phân cellulose.
(b) Tại bước 2, dùng NaHCO3 để loại bỏ hoàn toàn H2SO4.
(c) Sau bước 4, xuất hiện kết tủa Ag bám vào thành ống nghiệm.
(d) Tại bước 2, có thể thay NaHCO3 bằng dung dịch NaOH.
(e) Phản ứng ở bước 4, chứng minh cellulose có tham gia phản ứng tráng bạc.
Số phát biểu đúng là
A. 2. B. 1. C. 4. D. 3.
(Xem giải) Câu 4. Cho các phát biểu sau:
(a) Các kim loại đều có tính dẻo, tính dẫn nhiệt, tính dẫn điện và có ánh kim.
(b) Các kim loại nhóm IA, nhóm IIA và Al đều được gọi là kim loại nhẹ.
(c) Tính chất hoá học đặc trưng của kim loại là tính dễ bị khử.
(d) Kim loại có thế điện cực chuẩn càng lớn thì có tính khử càng mạnh.
(e) Trong công nghiệp, phương pháp nhiệt luyện và phương pháp điện phân đều được sử dụng để tách kim loại zinc.
(g) Trong môi trường không khí ẩm thép carbon bị ăn mòn điện hoá, sắt là cathode và carbon là anode.
(h) Nhiệt độ càng cao độ dẫn điện của các kim loại càng tăng.
Số phát biểu đúng là
A. 5. B. 4. C. 3. D. 6.
(Xem giải) Câu 5. Phân supephosphate kép chứa thành phần chủ yếu là Ca(H2PO4)2, được sản xuất từ quặng phosphorite theo hai giai đoạn sau:
• Giai đoạn 1: Ca3(PO4)2 + 3H2SO4 → 2H3PO4 + 3CaSO4
• Giai đoạn 2: Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
Để sản xuất được 500 tấn supephosphate kép chứa 69,2% Ca(H2PO4)2 với hiệu suất của cả quá trình là 80% thì cần bao nhiêu tấn dung dịch H2SO4 70%?
A. 517,52 tấn. B. 362,26 tấn. C. 414,02 tấn. D. 258,76 tấn.
(Xem giải) Câu 6. X là quặng hematite đỏ chứa 64,0% Fe2O3 (còn lại là tạp chất không chứa nguyên tố Fe). Y là quặng manhetite chứa 96,0% Fe3O4 (còn lại là tạp chất không chứa nguyên tố Fe). Trộn m1 tấn quặng X với m2 tấn quặng Y thu được 1 tấn hỗn hợp Z. Đem toàn bộ hỗn hợp Z luyện gang, rồi luyện thép thì thu được 497,3 kg thép chứa 0,1% khối lượng gồm carbon và các tạp chất. Giả thiết hiệu suất toàn bộ quá trình luyện gang và thép là 80%. Tỉ lệ m1 : m2 gần nhất với tỉ lệ nào sau đây?
A. 2 : 5. B. 1 : 2. C. 3 : 7. D. 6 : 4.
(Xem giải) Câu 7. Có năm dung dịch dựng trong năm lọ riêng biệt, mỗi dung dịch chỉ chứa một chất tan có nồng độ 0,1M, gồm: (NH4)2SO4, K2SO4, Ba(OH)2, Na2CO3, HCl được đánh số ngẫu nhiên từ (1) đến (5). Tiến hành thí nghiệm với các dung dịch trên cho kết quả như sau:
– Dung dịch ở lọ (2) tác dụng với dung dịch ở lọ (3) có kết tủa và khí thoát ra.
– Dung dịch ở lọ (2) tác dụng với dung dịch ở lọ (1) hoặc dung dịch ở lọ (4) đều có kết tủa.
– Dung dịch ở lọ (4) tác dụng với dung dịch ở lọ (5) có khí thoát ra.
Cho các phát biểu sau:
(a) Độ pH của dung dịch ở lọ (4) lớn hơn độ pH của dung dịch ở lọ (1).
(b) Nhỏ vài giọt vào dung dịch ở lọ (2) vào giấy quỳ tím, giấy quỳ tím chuyển sang màu xanh.
(c) Chất tan trong lọ (5) có trong dịch vị của dạ dày của người.
(d) Cho dung dịch BaCl2 vào dung dịch ở lọ (3), thấy xuất hiện kết tủa màu vàng.
(e) Các chất tan trong lọ (1) và lọ (3) có thể được sử dụng làm phân bón hoá học.
Số phát biểu đúng là
A. 4. B. 1. C. 3. D. 2.
(Xem giải) Câu 8. Một trong các phương pháp dùng để loại bỏ sắt trong nguồn nước nhiễm sắt là sử dụng lượng vôi tôi vừa đủ để tăng pH của nước nhằm kết tủa ion sắt khi có mặt oxygen, theo sơ đồ phản ứng
(1) Fe3+ + OH- → Fe(OH)3
(2) Fe2+ + OH- + O2 + H2O → Fe(OH)3
Một mẫu nước có hàm lượng sắt cao gấp 28 lần so với ngưỡng cho phép là 0,30 mg/L (theo QCVN 01-1:2018/BYT). Giả thiết sắt trong mẫu nước trên chỉ tồn tại ở hai dạng là Fe3+ và Fe2+ với tỉ lệ mol Fe3+ : Fe2+ = 1 : 4. Cần tối thiểu m gam Ca(OH)2 để kết tủa hoàn toàn lượng sắt trong 30 m³ mẫu nước trên. Giá trị của m là
A. 732,6. B. 666,0. C. 366,3. D. 333,0.
(Xem giải) Câu 9. Polymer Y được dùng làm hộp đựng thực phẩm, đồ chơi trẻ em, vỏ đĩa CD, DVD, … Trong công nghiệp sản xuất chất dẻo, polymer Y được điều chế theo sơ đồ sau:
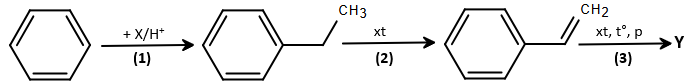
Cho các phát biểu sau:
(a) Trong phản ứng (1), X là ethane.
(b) Phản ứng (1) thuộc loại phản ứng cộng.
(c) Đồ hộp làm từ chất Y không nên đựng thực phẩm nóng hoặc sử dụng trong lò vi sóng để làm nóng thức ăn.
(d) Polymer Y có tính đàn hồi cao, dùng để sản xuất vật liệu chống thấm, lốp xe,…
(e) Từ 100 kg benzene và 32 m³ khí X (ở 25°C, 1 bar), với hiệu suất mỗi quá trình (1), (2), (3) lần lượt là 60%, 55% và 60%, thu được 26,4 kg polymer Y.
Số phát biểu đúng là
A. 5. B. 4. C. 2. D. 3.
(Xem giải) Câu 10. Một loại chất béo có chứa tristearin, tripalmitin, stearic acid, palmitic acid. Thành phần phần trăm về khối lượng và hiệu suất phản ứng của các chất khi xà phòng hóa chất béo này bằng dung dịch NaOH như sau:
| Thành phần | Tristearin | Tripalmitin | Stearic acid | Palmitic acid | Tạp chất |
| Phần trăm khối lượng | 53,4% | 32,24% | 1,136% | 1,536% | 11,688% |
| Hiệu suất phản ứng với NaOH | 90% | 88% | 100% | 100% | 0% |
Một nhà máy cần sản xuất 15 000 bánh xà phòng, khối lượng tịnh của mỗi bánh xà phòng là 90 gam (chứa 72% khối lượng muối sodium của các acid béo) bằng cách xà phòng hóa x kg chất béo nói trên với dung dịch NaOH. Biết trong quá trình đóng gói, lượng xà phòng bị hao hụt 4%. Giá trị của x là
A. 1237,5. B. 1289,1. C. 1718,7. D. 1649,9.
(Xem giải) Câu 11. R là nguyên tố mà nguyên tử có phân lớp electron ngoài cùng là np(2n+1) (n là số thứ tự của lớp electron). Cho các phát biểu sau về R:
(1) Tổng số hạt mang điện trong nguyên tử R là 18.
(2) Số electron độc thân trong nguyên tử R là 3.
(3) Oxide cao nhất của R là R2O7.
(4) Dung dịch muối NaR tác dụng với dung dịch AgNO3 sinh ra kết tủa.
(5) Hợp chất với hydrogen của R có tính acid mạnh.
(6) Đơn chất R2 có nhiều trong tự nhiên.
Số nhận xét đúng là:
A. 2. B. 4. C. 3. D. 1.
(Xem giải) Câu 12. Chanh là một loài thực vật cho quả nhỏ, thuộc chi Cam chanh (Citrus), khi chín có màu xanh hoặc vàng, thịt quả có vị chua. Nước ép chanh chứa khoảng 5% (khoảng 0,3 mol/L) citric acid, điều này giúp chanh có vị chua và độ pH của chanh từ 2 – 3. Citric acid có công thức cấu tạo là:
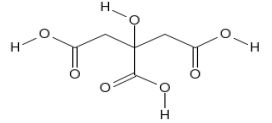
Phát biểu nào sau đây đúng?
A. Citric acid tác dụng tối đa với NaHCO3 theo tỉ lệ mol 1 : 3.
B. Citric acid thuộc loại hợp chất đa chức.
C. Công thức phân tử của citric acid là C6H6O7.
D. Citric acid tác dụng với NaOH theo tỉ lệ mol 1 : 4.
(Xem giải) Câu 13. Cho các nhận định sau:
(a) Trimethylamine là chất khí ở điều kiện thường.
(b) Tripeptide Ala-Gly-Lys có chứa 3 nguyên tử nitrogen.
(c) Có thể dùng nước ép từ quả chanh để khử mùi tanh của cá.
(d) Trong quá trình làm đậu hũ (đậu phụ), có xảy ra quá trình đông tụ protein.
(e) Glutamic acid có tên bán hệ thống là α-aminoglutamic acid.
(f) Aniline có tính base nên làm quỳ tím hoá xanh.
(g) Các arylamine thường được điều chế bằng cách oxi hoá hợp chất nitro.
(h) Tại pH = 6, trong điện trường, glutamic acid di chuyển về phía cực âm.
Số nhận định không đúng là
A. 5. B. 4. C. 6. D. 3.
(Xem giải) Câu 14. Sulfuric acid là một trong những hóa chất quan trọng nhất được sử dụng trong công nghiệp, được sản xuất hàng trăm triệu tấn mỗi năm. Phương pháp sản xuất sulfuric acid phổ biến nhất là phương pháp tiếp xúc, theo đó acid có thể được sản xuất từ quặng pyrite qua các giai đoạn sau:
• Giai đoạn 1: Sản xuất SO2
4FeS2(s) + 11O2(g) → 2Fe2O3(s) + 8SO2(g) (1)
• Giai đoạn 2: Sản xuất SO3
2SO2(g) + O2(g) ⇋ 2SO3(g) ![]() = -196kJ (2)
= -196kJ (2)
• Giai đoạn 3: Sản xuất H2SO4
H2SO4(aq) + nSO3(g) → H2SO4.nSO3) (oleum) (3)
H2SO4.пSO3() + nH2O(1) → (n + 1)H2SO4(aq) (4)
(a) Phản ứng (2) nên được thực hiện ở nhiệt độ rất cao để tăng hiệu suất điều chế SO3.
(b) Cách thực hiện đạt hiệu quả tiếp xúc tốt nhất ở giai đoạn 3 là khí SO3 được phun vào từ phía trên tháp xuống, dung dịch H2SO4 được bơm từ dưới lên.
(c) Nếu ở giai đoạn 3 dùng nước thay cho H2SO4 đặc để hấp thụ SO3 thì sẽ gây ra hiện tượng khói mù acid.
(d) Để xác định công thức của oleum thu được, người ta pha loãng 8,36 gam oleum vào nước thành 1,0 L dung dịch acid H2SO4, sau đó tiến hành chuẩn độ 10,0 mL dung dịch acid này bằng dung dịch chuẩn NaOH 0,1M. Thể tích NaOH trung bình cần sử dụng để chuẩn độ là 20,0 mL. Công thức của oleum thu được ở trên là H2SO4.SO3.
Số phát biểu đúng là
A. 2. B. 1. C. 3. D. 4.
(Xem giải) Câu 15. Xà phòng và chất giặt rửa tổng hợp đều có khả năng làm sạch bụi bẩn, dầu mỡ bám trên bề mặt. Cho các phát biểu sau:
(a) Phân tử xà phòng và phân tử chất giặt rửa tổng hợp đều có cấu tạo gồm đầu ưa nước chứa nhóm -COO- và đuôi kị nước là gốc hydrocarbon có mạch carbon dài.
(b) Có thể sử dụng chất giặt rửa tổng hợp với cả nước cứng, do chất giặt rửa tổng hợp không tạo muối khó tan với Ca2+, Mg2+.
(c) Chất giặt rửa tổng hợp khó bị phân hủy sinh học bởi các vi sinh vật, do đó gây ô nhiễm môi trường.
(d) Từ sản phẩm của dầu mỏ, điều chế được cả xà phòng và chất giặt rửa tổng hợp.
(e) Xà phòng và chất giặt rửa tổng hợp làm sạch chất bẩn trên bề mặt vật rắn là nhờ xảy ra các phản ứng hoá học.
Số phát biểu đúng là:
A. 4. B. 3. C. 2. D. 5.
(Xem giải) Câu 16. Cocaine là chất gây nghiện, do đó cocaine có thể gây lệ thuộc sau khi sử dụng chỉ trong một thời gian ngắn. Các tác hại khác bao gồm tăng nguy cơ đột quỵ, nhồi máu cơ tim, tổn thương phổi và có thể đột tử do nguyên nhân tim mạch. Cũng giống như cocaine, ketamine là loại thuốc được dùng phổ biến trong giới giải trí, thường gọi tắt (hay tiếng lóng) là “Ke”, nó làm biến dạng nhận thức về hình ảnh, âm thanh và tạo ra cảm giác phân li giữa bản thân và môi trường xunh quanh. Cocaine và ketamine có công thức cấu tạo là:
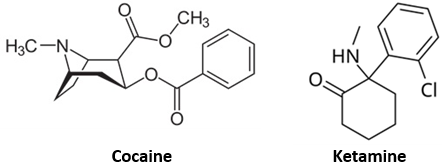
Cho các phát biểu sau:
(a) Cocaine và ketamine đều là hợp chất hữu cơ tạp chức và gây nghiện.
(b) Phân tử khối của cocaine và ketamine hơn kém nhau 65,5 amu.
(c) Có thể oxi hóa ketamine bằng LiAlH4 hoặc NaBH4 để thu được hợp chất hữu cơ có nhóm chức alcohol bậc II.
(d) Cho 1 mol cocaine phản ứng hoàn toàn với dung dịch NaOH, tổng khối lượng muối có trong dung dịch sau phản ứng là 368 gam.
(e) Trên phổ IR, cocaine và ketamine đều có tín hiệu đặc trưng của liên kết N-H.
Số phát biểu đúng là
A. 2. B. 3. C. 5. D. 4.
(Xem giải) Câu 17. Ion Ca2+ cần thiết cho máu và người hoạt động bình thường. Nồng độ Ca2+ không bình thường là dấu hiệu của bệnh. Để xác định nồng độ Ca2+ trong máu, người ta lấy mẫu máu, sau đó kết tủa Ca dưới dạng calcium oxalate (CaC2O4) rồi cho tác dụng với dung dịch KMnO4 trong môi trường acid theo phản úng:
KMnO4 + CaC2O4 + H2SO4 → CaSO4 + K2SO4 + MnSO4 + CO2 + H2O
Giả sử calcium oxalate kết tủa từ 1 mL máu một người tác dụng đủ với 2,05 mL dung dịch KMnO4 4,52.10^-4 M. Nồng độ Ca2+ trong máu người đó (được tính bằng đơn vị mg Ca2+/100 mL máu) là
A. 8,525. B. 4,633. C. 9,266. D. 6,244.
(Xem giải) Câu 18. Trong công nghiệp, một lượng lớn NaHCO3 và Na2CO3 được sản xuất theo phương pháp Solvay bằng cách cho khí CO2 (lấy từ nhiệt phân đá vôi) vào dung dịch chứa sodium chloride (NaCl) bão hoà và ammonia (NH3) bão hoà:
CO2(aq) + H2O(l) + NH3(aq) + NaCl(aq) → NH4Cl(aq) + NaHCO3(s) (1)
NaHCO3 tách ra đem nhiệt phân thu được soda:
2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(g) (2)
Để tái sử dụng NH3, người ta cho dung dịch NH4Cl phản ứng với CaO (thu được từ quá trình nhiệt phân đá vôi):
CaO(s) + 2NH4Cl(aq) → 2NH3(g) + CaCl2(aq) + H2O(l) (3)
Cho các phát biểu sau:
(a) Phản ứng (1) xảy ra được là do NaHCO3 có độ tan kém hơn nên bị kết tinh trước.
(b) Trong thực tế sản xuất, người ta đun nóng hỗn hợp các chất tham gia phản ứng (1) để thu lấy Na2CO3 ngay.
(c) Quá trình sản xuất soda, NH3 được tái sử dụng giúp giảm chi phí sản xuất và giảm thiểu ô nhiễm trường.
(d) NaHCO3 được ứng dụng làm bột nở là do phản ứng (2).
(e) Soda là nguyên liệu quan trọng trong sản xuất thuỷ tinh, bột giặt, chất tẩy rửa.
Số phát biểu đúng là
A. 3. B. 4. C. 5. D. 2.
(Xem giải) Câu 19. Cho bảng số liệu sau:
| Chất | Nước (H2O) | Hydrogen sulfide (H2S) |
| Nhiệt độ sôi (°C) ở 1 atm | 100,0 | -60,7 |
Phát biểu nào sau đây sai?
A. Liên kết O-H trong phân tử H2O phân cực kém hơn liên kết S-H trong phân tử H2S.
B. Số liên kết trong phân tử H2O bằng số liên kết trong phân tử H2S.
C. Trong phân tử H2O và phân tử H2S chỉ có các liên kết cộng hóa trị.
D. Do có liên kết hydrogen giữa các phân tử nên nước có nhiệt độ sôi cao hơn hydrogen sulfide.
(Xem giải) Câu 20. Trong công nghiệp, người ta điều chế Al bằng phương pháp điện phân nóng chảy Al2O3 theo sơ đồ sau:
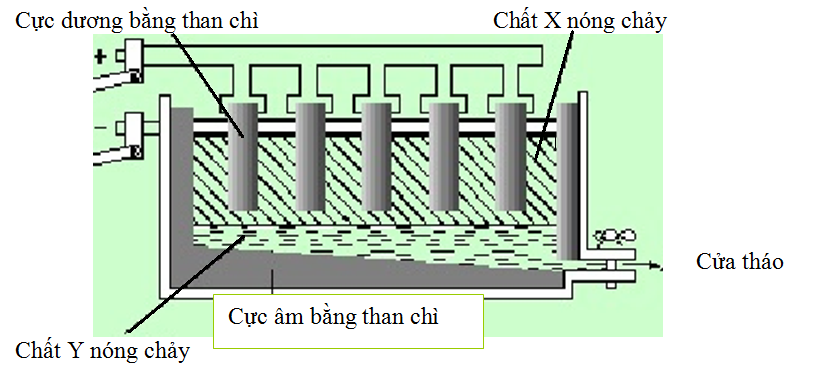
Cho các phát biểu sau:
(1) X là Al nóng chảy, Y là hỗn hợp Al2O3 và Na3AlF6 nóng chảy.
(2) Na3AlF6 được thêm vào Al2O3, hỗn hợp thu được có khối lượng riêng nhỏ hơn khối lượng riêng của Al giúp bảo vệ Al nóng chảy khỏi bị oxi hóa bởi O2 trong không khí.
(3) Na3AlF6 làm giảm nhiệt độ nóng chảy và làm tăng tính dẫn điện của hỗn hợp điện phân.
(4) Trong quá trình điện phân, anode bị ăn mòn dần.
(5) Trung bình để sản xuất được 1,08 tấn Al thì lượng điện cực than chì bị tiêu hao 0,89 tấn do bị oxi hoá bởi O2 sinh ra trong quá trình điện phân. (Giả thiết thành phần khí bay ra ở cực dương gồm 42%CO, 44%CO2 và 14% O2 về thể tích).
Số phát biểu đúng là
A. 5. B. 3. C. 4. D. 2.
(Xem giải) Câu 21. Cho sơ đồ phản ứng sau:
![]()
Biết X, Y, Z, T là các hợp chất hữu cơ. Cho các phát biểu sau:
(1) Chất T chỉ chứa một nhóm -CH3.
(2) Ở điều kiện thường, X và T hòa tan được Cu(OH)2 tạo thành dung dịch phức màu xanh lam.
(3) X, Z, T đều tác dụng với kim loại Na.
(4) T tác dụng được với Na, NaHCO3 và NaOH.
(5) Khi đun nóng, Y và T phản ứng được với Cu(OH)2 tạo kết tủa màu đỏ gạch.
(6) Trong công nghiệp, X là nguyên liệu để sản xuất PE
Số phát biểu đúng là:
A. 5. B. 3. C. 6. D. 4.
(Xem giải) Câu 22. Một xưởng sản xuất muốn phủ một lớp bạc dày 0,1 μm lên 1000 chiếc ruột phích với diện tích bề mặt mỗi chiếc là 0,2 m², khối lượng riêng của bạc là 10,49 g/cm³. Họ sử dụng dung dịch saccharose có nồng độ 5% để thực hiện phản ứng theo sơ đồ sau (biết rằng biết hiệu suất cả quá trình là 80%):
![]()
Cho các nhận định sau:
(a) Trong quá trình sản xuất, lượng dung dịch saccharose 5% ít nhất cần dùng là 8,3 kg.
(b) Lượng bạc được tráng lên 1000 chiếc ruột phích là 209,8 gam.
(c) Trong dung dịch A có hai loại monosaccharide.
(d) Trong quá trình thủy phân saccharose có thể thay xúc tác acid bằng xúc tác base.
Trong các nhận định trên, số nhận định đúng là
A. 4. B. 1. C. 3. D. 2.
(Xem giải) Câu 23. Cho các polymer: polyacrylonitrile, poly(phenol formaldehyde), polyethylene, polybuta-1,3-diene, poly(methyl methacrylate). Số polymer được điều chế bằng phản ứng trùng hợp là
A. 3. B. 4. C. 5. D. 2.
(Xem giải) Câu 24. Phát biểu nào sau đây đúng?
A. Trong phân tử lipid, số nguyên tử oxygen luôn bằng 6.
B. Chất béo tan tốt trong nước và nhẹ hơn nước.
C. Hydrogen hoá hoàn toàn chất béo dạng lỏng, thu được chất béo ở dạng rắn.
D. Phản ứng thuỷ phân ester trong môi trường acid được gọi là phản ứng ester hoá.
(Xem giải) Câu 25. Cho X, Y, Z, T là các chất khác nhau trong số bốn chất: CH3COOH, CH3CH2OH, CH3CHO. HCOOH và các tính chất được ghi trong bảng sau:
| Chất | X | Y | Z | T |
| Nhiệt độ sôi | 78,3 | 100,8 | 21,0 | 118,0 |
| pH (dung dịch 0,001M) | 7,00 | 3,47 | 7,00 | 3,88 |
Phát biểu nào sau đây sai?
A. Từ chất X có thể điều chế trực tiếp được chất T.
B. Trong dung dịch nước, chất Z không tạo được liên kết hydrogen với nước.
C. Chỉ dùng quỳ tím và thuốc thử Tollens phân biệt được bốn dung dịch của bốn chất trên.
D. Lực acid của Y lớn hơn lực acid của T hay Ka(Y) lớn hơn Ka(T).
(Xem giải) Câu 26. Muối ăn khi khai thác từ nước biển, mỏ muối, hồ muối thường có lẫn nhiều tạp chất như MgCl2, CaCl2, CaSO4 làm cho muối có vị đắng chát và dễ bị chảy nước gây ảnh hưởng xấu tới chất lượng muối. Một trong những phương pháp loại bỏ tạp chất ở muối ăn là dùng hỗn hợp A gồm Na2CO3, NaOH, BaCl2 tác dụng với dung dịch nước muối để loại tạp chất dưới dạng các chất kết tủa CaCO3, Mg(OH)2, BaSO4. Một mẫu muối thô thu được bằng phương pháp bay hơi nước biển có thành phần khối lượng như sau: 96,525% NaCl; 0,190% MgCl2; 1,224% CaSO4, 0,010% CaCl2; 0,951% H2O. Khối lượng hỗn hợp A cần dùng để loại bỏ hết tạp chất có trong 1 tấn muối nói trên là
A. 25,83 kg. B. 22,53 kg. C. 29,96 kg. D. 29,16 kg.
(Xem giải) Câu 27. Insulin là hormone có tác dụng điều tiết lượng đường trong máu. Thủy phân một phần insulin thu được heptapeptide X mạch hở. Khi thủy phân không hoàn toàn X, thu được hỗn hợp có chứa các peptide: Glu-Gln-Cys, Gly-Ile-Val, Gln-Cys-Cys, Val-Glu-Gln. Nếu đánh số thứ tự amino acid đầu N là số 1 thì amino acid ở vị trí số 3 trong X là
A. Gln. B. Cys. C. Glu. D. Val.
(Xem giải) Câu 28. Cho các phát biểu sau:
(a) Công thức phân tử của aniline là C3H7O2N.
(b) Số nguyên tử hydrogen trong phân tử glucose là 12.
(c) Trong phản ứng ester hoá giữa ethyl alcohol với acetic acid, H2O được tách ra từ OH của ethyl alcohol và H của acetic acid.
(d) Dùng thuốc thử Tollens phân biệt được hai dung dịch glucose và glycerol.
(e) Tơ nitron bền với nhiệt và giữ nhiệt tốt nên được dùng để dệt vải may quần áo ấm.
(f) Trùng hợp adipic acid với hexamethylenediamine thu được poly(hexamethylene adipamide).
(g) Muối disodium glutamate là thành phần chính của mì chính (bột ngọt).
Số phát biểu đúng là
A. 3. B. 4. C. 6. D. 5.
(Xem giải) Câu 29. Một số loại thực vật chỉ phát triển tốt ở môi trường có pH phù hợp, việc nghiên cứu pH của đất rất quan trọng trong nông nghiệp. Một số loại cây trồng phù hợp với đất có giá trị pH cho trong bảng sau:
| Cây trồng | pH thích hợp | Cây trồng | pH thích hợp |
| Bắp (Ngô) | 5,7 – 7,5 | Cây chè | 4,5 – 5,5 |
| Cà chua | 6,0 – 7,0 | Thanh long | 4,0 – 6,0 |
| Cải thảo | 6,5 – 7,0 | Lúa | 5,5 – 6,5 |
| Hành tây | 6,4 – 7,9 | Mía | 5,0 – 8,0 |
Dùng máy đo pH xác định được giá trị pH của một loại đất là 4,52. Phát biểu nào sau đây không đúng?
A. Loại đất trên phù hợp trồng cây chè và thanh long
B. Nồng độ Ion [H+] của loại đất trên lớn hơn 1.10^-7M.
C. Loại đất trên bị chua, để trồng hành tây, cà chua, mía phát triển tốt ta cần khử chua cho đất.
D. Để cây cải thảo và hành tây phát triển tốt trên loại đất trên, ta cần bón nhiều đạm hai lá (NH4NO3) qua nhiều vụ liên tiếp để tăng pH của đất.
(Xem giải) Câu 30. Từ một loại tinh dầu thảo mộc, người ta tách được hợp chất hữu cơ A có mùi thơm. Phân tích phần trăm khối lượng các nguyên tố cho thấy A có 81,82% Carbon và 6,06% Hydrogen về khối lượng, còn lại là Oxygen. Phổ MS cho thấy A có phân tử khối bằng 132. Trên phổ IR của A có một tín hiệu đặc trưng ở 1746 cm-1. Chất A có phản ứng tráng bạc, làm mất màu Br2 trong dung môi CCl4 và khi bị oxi hoá bằng dung dịch KMnO4 đun nóng, thu được potassium benzoate. Trong phân tử chất A không có nhóm methylene. Cho các phát biểu sau:
(a) Từ kết quả phân tích nguyên tố và phân tích phổ MS, tìm được công thức phân tử của A là C9H10O.
(b) Từ phổ IR và phản ứng tráng bạc, chứng tỏ A có chứa nhóm -CH=O.
(c) Chất A là đồng đẳng của benzaldehyde.
(d) A tác dụng với nước bromine (dư), thu được sản phẩm hữu cơ có công thức phân tử là C9H8OBr4.
(e) Hợp chất hữu cơ A có đồng phân hình học.
Số phát biểu đúng là:
A. 1. B. 2. C. 3. D. 4.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 31 đến câu 38. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 31. Vôi sống có nhiều ứng dụng như: sản xuất vật liệu xây dựng, vật liệu chịu nhiệt, khử chua đất trồng, uế, sát trùng, xử lí nước thải,… Hiện nay, nhiều lò nung vôi thủ công hoạt động tự phát, gây ảnh hưởng xấu đến môi trường xung quanh. Ở các lò nung vôi công nghiệp, quá trình kiểm soát phát thải ô nhiễm được thực hiện chặt chẽ hơn. Một lò nung vôi công nghiệp sử dụng than đá làm nhiên liệu. Giả thiết:
– Đá vôi chỉ chứa CaCO3 và để phân hủy 1 kg đá vôi cần cung cấp một nhiệt lượng là 1800 kJ.
– Đốt cháy 1 kg than đá giải phóng một nhiệt lượng là 27000 kJ và có 50% lượng nhiệt này được hấp thụ ở quá trình phân hủy đá vôi.
– Than đá chứa 1% sulfur (ở dạng hợp chất như FeS2, CaSO4, CxHySH,…) về khối lượng, 80% lượng sulfur bị đốt cháy tạo thành SO2 và 1,6% lượng SO2 sinh ra phát thải vào khí quyển.
– Công suất của lò nung vôi là 420 tấn vôi sống/ngày.
– Các phản ứng xảy ra hoàn toàn.
a) Khối lượng than đá mà lò nung vôi trên đã sử dụng mỗi ngày là 100 tấn.
b) Phản ứng nhiệt phân đá vôi là phản ứng tỏa nhiệt.
c) Khối lượng đá vôi mà lò nung vôi trên sử dụng mỗi ngày là 750 tấn.
d) Giả thiết toàn bộ lượng SO2 thoát ra từ lò nung vôi trên trong 30 ngày chuyển hết thành sufuric acid trong nước mưa với nồng độ H2SO4 là 2.10^-5 M. Khi toàn bộ lượng nước mưa này rơi trên một vùng đất rộng 60 km² thì tạo ra một cơn mưa acid với lượng mưa trung bình là 10 mm.
Các phép tính chỉ làm tròn ở bước tính cuối cùng và kết quả làm tròn đến hàng phần đơn vị.
(Xem giải) Câu 32. Magnesium là kim loại được ứng dụng để tạo các hợp kim nhẹ, bền, đặc biệt là cho ngành công nghiệp sản xuất ô tô và hàng không vũ trụ. Magnesium được sản xuất trong công nghiệp theo quá trình Pidgeon với nguyên liệu ban đầu là quặng dolomite. Quá trình được thực hiện qua các giai đoạn sau:
• Giai đoạn 1. Nung quặng dolomite:
MgCO3.CaCO3(s) → MgO(s) + CaO(s) + 2CO2(g)
• Giai đoạn 2. Dùng silicon trong ferrosilicon (Fe, Si) làm chất khử trong điều kiện chân không:
2MgO(s) + 2CaO(s) + Si(s) → 2Mg(g) + Ca2SiO4(s)
Phản ứng chung của quá trình Pidgeon là:
2MgCO3.CaCO3(s) + Si(s) → 2Mg(s) + Ca2SiO4(s) + 2CO2(g) ![]() = 183 kJ
= 183 kJ
a) Trong phản ứng ở giai đoạn 2, MgO dễ bị khử bởi Si hơn CaO.
b) Phản ứng ở giai đoạn 2 thuộc phương pháp nhiệt luyện.
c) Quá trình Pidgeon là quá trình thu nhiệt.
d) Từ 1 tấn quặng dolomite (chứa 92% MgCO3.CaCO3 về khối lượng) thu được 108 kg kim loại magnesium. Hiệu suất của toàn bộ quá trình là 90%.
(Xem giải) Câu 33. Peptide X mạch hở có công thức phân tử C8H15N3O4.
a) Ứng với công thức phân tử C8H15N3O4 có 9 peptide mạch hở.
b) Thủy phân hoàn toàn 2,604 gam X trong 40 ml dung dịch NaOH 1M đun nóng, thu được dung dịch Y. Cho dung dịch HCl (dư) vào dung dịch Y, thu được dung dịch chứa 6,690 gam muối.
c) X là một tripeptide tạo bởi hai loại α-aminoacid.
d) Khi thuỷ phân hoàn toàn peptide X (xúc tác enzyme), thu được hỗn hợp các α-aminoacid, trong đó luôn có glycine.
(Xem giải) Câu 34. Nhiệt độ sôi của các hợp chất với hydrogen của các nguyên tố nhóm VA, VIA và VIIA được biểu diễn đồ thị sau:

a) Ở điều kiện thường, HF và H2O tồn tại ở thể lỏng, các hợp chất còn lại ở thể khí.
b) H2O có nhiệt độ sôi cao hơn HF là do liên kết H-O phân cực mạnh hơn liên kết H-F.
c) Nhiệt độ sôi của H2O cao bất thường so với H2S, H2Se và H2Te là do H2O có liên kết hydrogen liên phân tử.
d) Ngoài HF, H2O, NH3, nhiệt độ sôi của các hợp chất còn lại trong cùng một nhóm tăng dần do tương tác van der Waals tăng.
(Xem giải) Câu 35. Sodium được sản xuất trong công nghiệp bằng cách điện phân muối ăn nóng chảy ở nhiệt độ khoản 800°C. Sơ đồ bình điện phân được mô tả như hình sau:
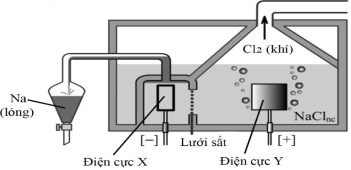
a) Trong quá trình sản xuất sodium, người ta sử dụng điện cực X làm bằng than chì, điện cực Y làm bằng kim loại Fe.
b) Hệ thống ống dẫn sodium và bình thu sodium nóng chảy luôn được đặt trong môi trường khí trơ.
c) Hệ thống thu kim loại sodium được lắp đặt phía trên bề mặt bình điện phân do sodium thu được ở thể lỏng.
d) Với một quy mô sản xuất ở mức trung bình, người ta dùng cường độ dòng điện là 9000 A thì sau 8,0 giờ sản xuất được 49,42 kg sodium (hiệu suất của cả quá trình đạt 80%. Biết điện lượng được tính theo công thức: q = I.t = n.F. Trong đó t là thời gian (s), I là cường độ dòng điện (A), n là số mol electron trao đổi mỗi điện cực, F = 96500 C/mol. Kết quả được làm tròn đến hàng phần trăm.
(Xem giải) Câu 36. Chất béo (hay triglyceride) là một trong những nguồn cung cấp năng lượng và chuyên chở các chất tan trong chất béo của quá trình trao đổi chất. Một triglyceride X là thành phần chính của một loại dầu thực vật và có công thức cấu tạo như sau:
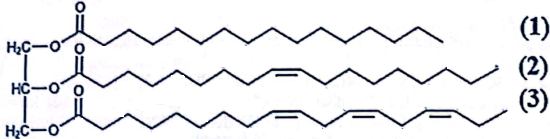
a) Công thức phân tử của X là C55H98O6 và ở điều kiện thường X là chất lỏng.
b) Khi sử dụng làm thực phẩm thì X sẽ cung cấp acid béo omega-3 cho cơ thể.
e) Trong X, các gốc acid béo đều có số nguyên tử carbon là số lẻ và gốc không no đều có cấu hình cis-
d) Hydrogen hóa hoàn toàn 427 kg X bằng hydrogen (dư) ở nhiệt độ cao, có Ni xúc tác thu được tối đa 434 kg chất béo no.
(Xem giải) Câu 37. Acquy chì được sử dụng phổ biến trong nhiều phương tiện giao thông như xe máy, ô tô. Acquy chì gồm một điện cực Pb và một điện cực Pb có phủ PbO2 nhúng trong dung dịch H2SO4 nồng độ khoảng 40%. Phản ứng xảy ra trong acquy chì khi phóng điện và khi nạp điện như sau:
Pb(s) + PbO2(s) + 2H+(aq) + 2HSO4-(aq) ⇋ 2PbSO4(s) + 2H2O(l)
Trong đó quá trình thuận là quá trình phóng điện, quá trình nghịch là quá trình nạp điện.
a) Khi acquy phóng điện, ở anode xảy ra quá trình oxi hóa Pb.
b) Trong quá trình nạp điện cho acquy chì bằng dòng điện một chiều có cường độ 2,0A trong 1 giờ thì có 26,2 gam PbSO4 tham gia phản ứng. Giả thiết: H2SO4 40% chỉ là acid mạnh ở nấc thứ nhất; hiệu suất quá trình nạp điện cho acquy chì đạt 100%. Biết điện lượng được tính theo công thức: q = I.t = n.F. Trong đó t là thời gian (s), I là cường độ dòng điện (A), n là số mol electron trao đổi ở mỗi điện cực, F = 96500 C/mol. (Kết quả chỉ được làm tròn ở bước tính cuối cùng và làm tròn đến hàng phần mười).
c) Khi acquy nạp điện, ở cathode xảy ra quá trình chuyển PbSO4 thành PbO2.
d) Trong quá trình phóng điện, khối lượng của anode giảm còn khối lượng của cathode tăng.
(Xem giải) Câu 38. Chất hữu cơ E được điều chế từ alcohol X và acid Y (phân tử Y chứa vòng benzene) được dùng trong thành phần của một số thuốc giảm đau, thuốc xoa bóp, cao dán dùng điều trị căng cơ, bong gân,… Thành phần phần trăm về khối lượng các nguyên tố trong phân tử E như sau: 63,16% C; 5,26% H và 31,58% O. Phổ IR của E ngoài vùng hấp thụ với peak đặc trưng của liên kết C=O (số sóng 1750 – 1735 cm-1), liên kết C-O (số sóng 1300 – 1000 cm-1) còn có vùng hấp thụ với peak đặc trưng của liên kết O-H (số sóng 3650 – 3200 cm-1). Từ phổ MS, xác định được phân tử khối của E là 152.
a) Phân tử Y có một nhóm -OH và một -COOH.
b) Hiện nay, alcohol X được điều chế từ cellulose và tinh bột bằng phương pháp lên men sinh học.
c) Cho 3,8 gam E phản ứng với 60 mL dung dịch NaOH 1,0M. Sau khi phản ứng xảy ra hoàn toàn, khối lượng chất rắn thu được sau khi cô cạn dung dịch là 4,95 gam.
d) Từ Y, có thể điều chế được chất F theo phương trình phản ứng sau: Y + (CH3CO)2O → F + CH3COOH
Chất F được sử dụng làm thuốc giảm đau, hạ sốt. Mỗi viên thuốc chứa 500 mg chất F. Mỗi vỉ thuốc có 10 viên. Để sản xuất 2000 hộp thuốc, mỗi hộp chứa 10 vỉ thuốc trên thì khối lượng chất Y cần sử dụng để điều chế lượng chất F (hiệu suất phản ứng 90%) là 85,2 kg. (Kết quả chỉ được làm tròn ở bước cuối cùng và làm tròn đến hàng phần mười).
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 39 đến câu 44.
(Xem giải) Câu 39. Rutin là hợp chất hữu cơ có trong nụ hoa hòe, có tác dụng làm giảm các chứng suy giảm tĩnh mạch, giảm cholesterol trong máu. Ngoài ra rutin còn được dùng để điều chế thuốc quercetin có tác dụng chống oxy hóa mạnh, kháng viêm, chống dị ứng, ngăn ngừa tế bào ung thư. Công thức cấu tạo của rutin và quercetin cho ở hình dưới đây:
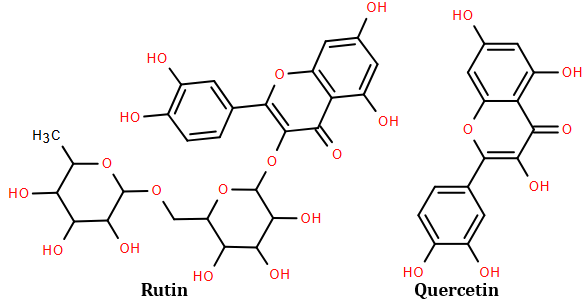
Trong môi trường acid, một phân tử rutin phản ứng với hai phân tử nước thu được sản phẩm gồm quercetin, glucose và rhamnose. Cho các phát biểu sau:
1) Công thức phân tử của rhamnose C5H10O5.
2) Để sản xuất 1 triệu viên thuốc (mỗi viên có khối lượng 500 mg, chứa 96,64% quercetin về khối lượng) cần 4009,74 kg bột hoa hòe. (Biết hàm lượng rutin trong bột hoa hòe là 30,20%, phần còn lại không tạo ra quercetin; hiệu suất toàn bộ quá trình sản xuất đạt 80%).
3) Phân tử quercetin có 5 nhóm -OH phenol.
4) Số nhóm -OH phenol trong phân tử rutin bằng số nhóm -OH phenol trong phân tử quercetin.
5) Công thức phân tử của quercetin là C15H10O7.
Liệt kê số phát biểu đúng theo thứ tự tăng dần.
(Xem giải) Câu 40. Thuốc nổ đen là một trong bốn phát minh vĩ đại của nước Trung Hoa cổ. Thuốc nổ đen gồm ba thành phần cơ bản là: sulfur, diêm tiêu (potassium nitrate) và than củi (carbon). Hỗn hợp ba chất này cháy nổ rất mạnh. Chính vì vậy người ta gọi hỗn hợp trên là “hoả dược”. Quá trình cháy nổ xảy ra phản ứng hoá học sau:
KNO3 + C + S → K2S + CO2 + N2
Nếu cho 10 gam thuốc nổ đen (tỉ lệ phần trăm theo khối lượng lần lượt là 75% KNO3, 15%C, 10%S) thực hiện phản ứng nổ thì sinh ra V lít khí (ở 25°C, 1 bar). Tính giá trị của V. (Kết quả cuối cùng làm tròn đến hàng phần mười).
(Xem giải) Câu 41. Phèn chua (K2SO4.Al2(SO4)3.24H2O) được sử dụng nhiều trong công nghiệp nhuộm, sản xuất giấy, sử dụng làm trong nước. Có nhiều cách để điều chế phèn chua, một trong số cách đó được tiến hành như sau:
• Bước 1: Hòa tan vừa đủ quặng bauxite (Al2O3.2H2O) trong dung dịch KOH 16,8%.
• Bước 2: Cho từ từ dung dịch H2SO4 50% vào dung dịch thu được sau bước 1 cho đến khi kết tủa tan vừa hết.
• Bước 3: Đun nóng để nước bay hơi cho đến khi khối lượng dung dịch giảm đi 30% so với ban đầu.
• Bước 4: Hạ nhiệt độ dung dịch về 20°C để phèn chua tách ra.
Biết các phản ứng xảy ra vừa đủ và độ tan của phèn chua tại 20°C là 14 gam/100 gam H2O. Ban đầu sử dụng 100 kg dung dịch KOH, sau khi kết thúc các bước trên thu được m kg phèn chua. Tính m. (Chỉ làm tròn kết quả ở bước tính cuối cùng và kết quả làm tròn đến hàng đơn vị).
(Xem giải) Câu 42. Cây xanh có vai trò rất lớn với sự sống trên Trái đất. Cây xanh cung cấp lương thực, thực phẩm cho con người. Thông qua quá trình quang hợp, cây xanh hấp thụ khí CO2, giải phóng khí O2, làm giảm hiệu ứng nhà kính, giúp điều hòa khí hậu, bảo vệ môi trường,… Cellulose được tạo ra trong cây xanh bắt đầu từ quá trình quang hợp theo sơ đồ:
(a) 6CO2 + 6H2O → C6H12O6 (glucose) + 6O2
(b) nC6H12O6 → (C6H10O5)n (cellulose) + nH2O
Cellulose là thành phân chính tạo nên màng tế bào thực vật, tạo nên bộ khung của cây cối. Thân cây, cành cây được dùng làm nguyên liệu để sản xuất đồ gỗ, sản xuất giấy,… Một quả đồi có diện tích 1000 m² trồng cây keo với mật độ 10 m²/cây, trung bình mỗi cây khai thác được 243 kg gỗ. Toàn bộ lượng gỗ thu được từ đồi keo trên đem chế biến và sản xuất thành vở học sinh (loại 96 trang, không tính bìa, kích thước mỗi trang là 210 mm x 297 mm). Biết: giấy chứa 80% bột gỗ, khối lượng bột gỗ (cellulose) trong giấy bằng 60% so khối lượng gỗ ban đầu, định lượng giấy là 80 g/m². Số quyển vở sản xuất được đóng gói vào các thùng với mỗi thùng có 10 tập, mỗi tập có 10 quyển vở. Với lượng gỗ trên thu được bao nhiêu thùng vở? (Chỉ làm tròn kết quả ở bước tính cuối cùng và kết quả làm tròn đến hàng đơn vị)
(Xem giải) Câu 43. Theo quy ước, một đơn vị độ cứng ứng với 0,5 milimol Ca2+ hoặc Mg2+ trong 1,0 lít nước. Một loại nước cứng chứa đồng thời các ion Ca2+, HCO3- và Cl-. Để làm mềm 10 lít nước cứng đó cần dùng vừa đủ 100 ml dung dịch chứa NaOH 0,2M và Na3PO4 0,2M, thu được nước mềm (không chứa Ca2+). Số đơn vị độ cứng có trong nước cứng đó là a. Tính a?
(Xem giải) Câu 44. Glucosamine hydrochloride được sản suất từ chitin trong vỏ tôm. Glucosamine hydrochloride là sản phẩm hỗ trợ giảm các triệu chứng viêm, đau thoái hóa khớp, mạnh gân cốt, tăng tiết chất nhờn khớp, giúp bảo vệ sụn khớp. Glucosamine hydrochloride được chuyển hóa từ chitin trong vỏ tôm theo sơ đồ (hình bên).
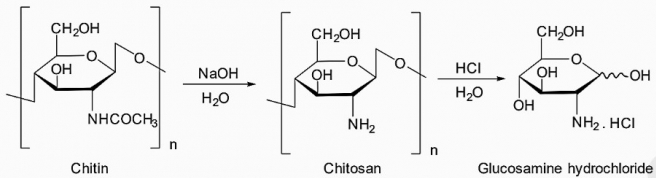
Nếu tận dụng vỏ tôm (đã được sơ chế) từ các nhà máy chế biến thủy, hải sản để sản xuất 500 hộp thuốc, mỗi hộp có chứa 60 viên, mỗi viên có hàm lượng glucosamine hydrochloride là 1000 mg/1 viên, thì cần sử dụng bao nhiêu kg vỏ tôm? Biết vỏ tôm chứa 28% chitin, hiệu suất điều chế glucosamine hydrochloride từ chitin đạt 40%. (Chỉ làm tròn ở phép tính cuối cùng, làm tròn kết quả đến hàng đơn vị)

Bình luận