[2024 – 2025] Thi học sinh giỏi lớp 12 – TP Hà Nội
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Danh sách đề hsg năm 2024-2025
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 051-H12C năm 2024-2025
⇒ Thời gian làm bài: 180 phút
Câu 1. (4,0 điểm)
(Xem giải) 1. Sulfur dioxide (SO2) là một chất khí không màu, mùi hắc, độc và là một trong những tác nhân hàng đầu gây mưa acid.
a) Viết phương trình hóa học chứng minh SO2 là tác nhân gây mưa acid.
b) Cho biết tác động của mưa acid đối với calcium carbonate trong núi đá vôi và với kim loại sắt trong gang thép. Viết phương trình hóa học minh họa.
c) Để tách SO2 có trong một nguồn khí thải của nhà máy nhiệt điện, người ta dẫn khí thải đi qua thiết bị lọc bụi tĩnh điện rồi qua thiết bị khử lưu huỳnh ướt (sơ đồ hình bên).

– Mô tả quá trình loại bỏ SO2 khỏi khí thải theo phương pháp khử lưu huỳnh ướt. Trong quá trình này, khí SO2 được hấp thụ theo nguyên tắc nào?
– Viết phương trình hóa học của các phản ứng xảy ra.
d) Tính khối lượng CaCO3 (theo kilogam) tối thiểu tiêu thụ mỗi ngày đêm để loại bỏ 95% lượng SO2 có trong khí thải của nhà máy trên. Cho biết lưu lượng khí thải của nhà máy đó là 10000 m³/giờ (đã hiệu chỉnh tới điều kiện chuẩn) và SO2 chiếm 0,15% thể tích khí thải.
(Xem giải) 2. Calcium carbonate là thành phần chính có trong vỏ trứng, vỏ sò, vỏ ốc,… Để xác định hàm lượng calcium carbonate có trong một mẫu vỏ trứng, một nhóm học sinh đã làm như sau:
– Bước 1: Rửa sạch vỏ trứng bằng nước cất, sấy cho đến khi khô hoàn toàn rồi nghiền thành bột.
– Bước 2: Cân chính xác 2,2 gam bột vỏ trứng rồi cho vào bình nón. Thêm 100,0 mL dung dịch hydrochloric acid 2,0M vào bình nón, đậy hờ và để trong vài giờ.
– Bước 3: Lọc dung dịch trong bình nón cho vào bình định mức 250,0 mL rồi thêm nước cất đến vạch và lắc đều.
– Bước 4: Cho dung dịch sodium hydroxide 1,0M vào burette 50,0 mL và điều chinh dung dịch trong burette về mức 0.
– Bước 5: Chuyển 25,0 mL dung dịch đã chuẩn bị ở bước 3 vào bình nón, thêm vài giọt chất chỉ thị acid – base thích hợp và tiến hành chuần độ. Học sinh đã thực hiện chuẩn độ sơ bộ (bước thử trước khi chuẩn độ chính thức) rồi lặp lại chuẩn độ 3 lần nữa, kết quả thí nghiệm được ghi lại trong bảng sau:
| Chuẩn độ sơ bộ | Lần 1 | Lần 2 | Lần 3 | |
| VNaOH ban đầu (mL) | 0,0 | 0,0 | 16,4 | 32,6 |
| VNaOH sau chuẩn độ (mL) | 16,4 | 16,4 | 32,6 | 48,9 |
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Nêu vai trò của lần chuẩn độ sơ bộ.
c) Đưa ra 2 lý do vì sao không chuẩn độ trực tiếp calcium carbonate trong vỏ trứng bằng dung dịch HCl.
d) Học sinh lặp lại thí nghiệm chuẩn độ bằng cùng một thiết bị nhưng sử dụng dung dịch NaOH 0,10M. Giải thích lý do tại sao điều này lại gây ra hạn chế cho quy trình chuẩn độ.
e) Tính hàm lượng calcium carbonate trong mẫu vỏ trứng.
Câu 2. (5,0 điểm)
(Xem giải) 1. X và Y là 2 nguyên tố thuộc 2 nhóm A liên tiếp và 2 chu kỳ liên tiếp của bảng tuần hoàn (ZX < ZY). Tổng số hiệu nguyên tử của 2 nguyên tố là 25; X có phản ứng trực tiếp với Y ở điều kiện thường. Nguyên tố Z nằm cùng chu kỳ với Y. Tổng số electron độc thân trong 2 nguyên tử Y và Z ở trạng thái cơ bản là 4.
a) Xác định các nguyên tố X, Y, Z.
b) X, Y, Z tạo với hydrogen các hợp chất khí tương ứng là HxX; HyY; HzZ.
– Viết công thức Lewis và xác định dạng hình học của các phân tử dựa vào mô hình VSEPR.
– So sánh nhiệt độ sôi của các hợp chất và giải thích.
c) Nguyên tố T thuộc cùng chu kỳ với Y. Tổng số oxi hóa cao nhất và 3 lần số oxi hóa thấp nhất của T bằng 4. Viết công thức cấu tạo các acid có oxygen của T và so sánh tính acid của chúng, giải thích.
(Xem giải) 2. Hợp chất hữu cơ X đơn chức, mạch hở chứa các nguyên tố C, H, O. Phân tích thành phần các nguyên tố trong X xác định được % khối lượng của O là 53,33%.
a) Tìm công thức phân tử, viết các công thức cấu tạo có thể có của X.
b) Phổ hồng ngoại của X như sau:
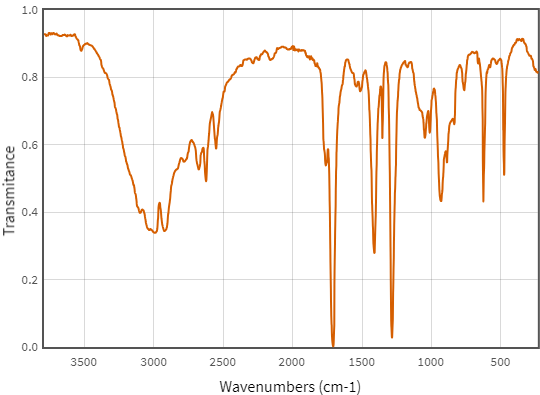
Lập luận tìm công thức cấu tạo đúng của X. Cho biết số sóng hấp thụ đặc trưng trên phổ hồng ngoại của một số nhóm chức cơ bản như sau:
| Nhóm chức/Liên kết | Số sóng (cm-1) | Nhóm chức/Liên kết | Số sóng (cm-1) |
| -OH (alcohol) | 3500 – 3200 | -O- (ether) | 1150 – 1050 (C-O) |
| -CH=O (aldehyde) | 2830 – 2695 (C-H) 1740 – 1685 (C=O) |
-C=O (ketone) | 1715 – 1666 (C=O) |
| -COOH (carboxylic acid) | 3300 – 2500 (O-H) 1760 – 1690 (C=O) |
-COO- (ester) | 1750 – 1715 (C=O) |
c) X tham gia vào sơ đồ chuyển hóa sau:
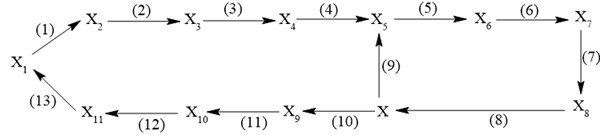
Trong sơ đồ chuyển hóa trên:
– Tất cả các chất đều là hợp chất hữu cơ, trong đó có 4 chất thuộc loại hydrocarbon và 3 chất thuộc loại alcohol.
– X4 dễ bay hơi và được dùng làm dung môi để lau sơn móng tay, dung môi trong sản xuất tơ nhân tạo,…
– Từ X10 có phản ứng trực tiếp điều chế X. Phản ứng chuyển hóa X11 thành X1 thuộc loại phản ứng cộng.
– MX1 + MX6 = 74; MX6 + MX7 = 66,5
i) Xác định các chất X1, X2… X11 và viết phương trình hóa học (ở dạng công thức cấu tạo thu gọn) thực hiện sơ đồ chuyển hóa.
ii) Viết cơ chế của phản ứng (2).
Câu 3. (4,0 điểm)
(Xem giải) 1. Vì sao glucose được dùng để truyền tĩnh mạch trong y học mà không thể sử dụng saccharose?
(Xem giải) 2. Để bón phân cho một loại đất có pH trong khoảng 3-4,5, người nông dân có ý định sử dụng loại phân bón NPK được phối trộn từ ammonium sulfate, superphosphate kép và potassium chloride. Theo em, loại phân bón được phối trộn ở trên có phù hợp cho loại đất này không? Giải thích ngắn gọn.
(Xem giải) 3. Cân bằng các phương trình hóa học sau bằng phương pháp thăng bằng electron, xác định chất khử và chất oxi hóa:
a) Để xác định nồng độ cùa ion Ca2+ trong máu, người ta lấy mẫu máu, sau đó kết tủa ion Ca2+ dưới dạng calcium oxalate (CaC2O4) rồi cho kết tủa đó tác dụng với dung dịch potassium permanganate trong môi trường acid theo phản ứng:
KMnO4 + CaC2O4 + H2SO4 → CaSO4 + K2SO4 + MnSO4 + CO2 + H2O
b) Sản xuất phosphorus từ phản ứng nung quặng phosphorite, cát và than cốc ở 1200°C trong lò điện:
Ca3(PO4)2 + SiO2 + C → CaSiO3 + P4 + CO
c) Nhiên liệu dành cho tên lửa tăng tốc của tàu vũ trụ con thoi là hỗn hợp gồm ammonium perchlorate (NH4ClO4) và bột nhôm. Khi được đốt đến trên 200°C, ammonium perchlorate nổ theo phản ứng:
NH4ClO4 → N2 + Cl2 + O2 + H2O
(Xem giải) 4. Hiện nay người ta sản xuất ammonia theo chu trình Haber – Bosch bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí methane (trong các tháp phản ưng) qua các giai đoạn theo sơ đồ sau:
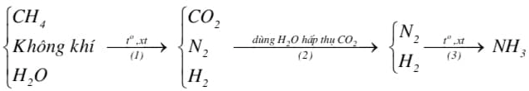
a) Nếu lấy 1000 m³ không khí (chứa 21%O2 và 78%N2, còn lại là CO2) thì cần phải lấy V m³ khí methane để thu được lượng N2 và H2 theo tỉ lệ 1 : 3 về thể tích dùng cho phản ứng tổng hợp ammonia. Tính V, biết các phản ứng ở giai đoạn (1) đều xảy ra hoàn toàn, các thể tích khí và hơi được đo ở cùng điều kiện.
b) Ở giai đoạn (3) xảy ra cân bằng: N2(g) + 3H2(g) ⇋ 2NH3(g)
– Tính ![]() của phản ứng tổng hợp trên. Cho biết
của phản ứng tổng hợp trên. Cho biết ![]() của NH3 là -45,9 kJ/mol.
của NH3 là -45,9 kJ/mol.
– Theo nguyên lý chuyển dịch cân bằng Le Chatelier, để tăng hiệu suất tổng hợp thì phản ứng nên được thực hiện ở nhiệt độ cao hay thấp? Vì sao?
– Trong thực tế, phản ứng được thực hiện ở nhiệt độ khá cao (khoảng 450°C). Hãy giải thích.
Câu 4. (4,0 điểm)
(Xem giải) 1. Trong dung dịch, amino acid tồn tại ở dạng ion lưỡng cực, cation hay anion tùy thuộc vào pH của dung dịch. Giá trị pH mà tại đó nồng độ dạng ion lưỡng cực đạt giá trị lớn nhất gọi là điểm đẳng điện (ký hiệu là pI). Điểm đẳng điện của các amino acid được tính theo biểu thức: pI = (pKa1 + pKa2)/2
(với Ka1, Ka2 là hằng số phân li acid của các nhóm chức; pKa = -lgKa)
Đối với các diamino monocarboxylic hoặc monoamino dicarboxylic, pI là giá trị trung bình của hai giá trị pKa gần nhau. Cho pKa của các amino acid như sau:
| Amino acid | pKa1 | pKa2 | pKa3 |
| Alanine | 2,35 | 9,87 | |
| Lysine | 2,18 | 8,95 | 10,53 |
| Aspartic acid | 2,10 | 3,86 | 9,82 |
a) Tính điểm đẳng điện của alanine, lysine, aspartic acid. Viết công thức dạng ion lưỡng cực của các amino acid tại điểm đẳng điện.
b) Viết công thức các dạng ion chủ yếu của từng amino acid trong dung dịch ở pH = 1 và ở pH = 13.
c) Các amino acid có các điểm đẳng điện khác nhau nên ở một pH xác định, chúng sẽ di chuyển về cathode hoặc anode với những vận tốc khác nhau. Dựa trên cơ sở này người ta xây dựng phương pháp điện di để phân tích và tinh chế các amino acid từ hỗn hợp của chúng. Tính các dạng tồn tại chủ yếu của alanine và aspartic acid ở pH = 5,97. Từ đó cho biết có thể tách được 2 amino acid này bằng phương pháp điện di ở không?
(Xem giải) 2. X là một hydrocarbon thơm. Phân tích thành phần nguyên tố của X thấy X chứa 90,57% carbon về khối lượng.
a) Lập công thức phân tử của X. Cho biết MX < 170. Viết các công thức cấu tạo có thể có của X.
b) Từ X có thể tổng hợp diethylphthalate (DEP) được dùng làm thuốc điều trị bệnh ghẻ và giảm triệu chứng sưng tấy ở vùng da bị côn trùng cắn, theo sơ đồ sau:
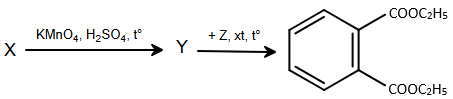
– Chọn công thức cấu tạo đúng của X và viết phương trình hóa học của các phản ứng xảy ra.
– Biết mỗi hộp 10 gam thuốc mỡ chứa 9,5 gam diethylphtalate. Tính số hộp thuốc mỡ có thể sản xuất được từ 10,6 tấn X, biết hiệu suất của toàn bộ quá trình tổng hợp diethylphtalate từ X là 60%.
Câu 5. (3,0 điểm)
(Xem giải) 1. Đồng với độ tinh khiết cao có khả năng dẫn điện tốt, bền về mặt hóa học nên được sử dụng rộng rãi trong các thiết bị điện tử. Để thu được đồng tinh khiết từ một đồng xu làm bằng hợp kim Cu-Zn chứa 95% đồng về khối lượng (không chứa tạp chất khác), một nhóm học sinh đã thực hiện thí nghiệm như sau:
– Cân để xác định khối lượng ban đầu của đồng xu (2,340 gam) và thanh đồng tinh khiết (2,550 gam).
– Nối đồng xu với một điện cực và thanh đồng tinh khiết với điện cực còn lại của nguồn điện một chiều, rồi nhúng vào bình điện phân chứa dung dịch copper (II) sulfate dư.
– Điện phân với cường độ dòng điện 2A (hiệu suất điện phân là 100%).
– Sau t giây, lấy 2 điện cực, làm khô rồi cân để xác định lại khối lượng của đồng xu và thanh đồng tinh khiết, thấy khối lượng đồng xu là 1,935 gam và khối lượng thanh đồng là m gam.
a) Trong thí nghiệm trên, đồng xu và thanh đồng tinh khiết được nối với điện cực nào của nguồn điện?
b) Viết các quá trình xảy ra tại các điện cực.
c) Tính giá trị của t và m.
(Xem giải) 2. Cho 2 hợp chất hữu cơ mạch hở E, F có công thức phân tử tương ứng là CxH2y-2Oy và CxHx+3Ox với 125 < ME < MF < 180. E, F tham gia các phản ứng theo đúng tỉ lệ mol:
(1) E + 2NaOH (t°) → X + Y + Z
(2) F + 2NaOH (t°) → X + Y + Z + T
(3) X + HCl → X1 + NaCl
(4) Y + HCl → Y1 + NaCl
(5) 2X1 (t°) → X2 + 2T
(6) Z + 2[Ag(NH3)2]OH (t°) → Z1 + 2Ag + 3NH3 + H2O
a) Tìm công thức phân tử của E, F.
b) Xác định công thức cấu tạo của E, F. Viết phương trình hóa học của các phản ứng xảy ra.


Bình luận