[2025 – 2026] Thi học sinh giỏi lớp 12 – Tỉnh Lâm Đồng
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 023-H12B năm 2025-2026
⇒ Thời gian làm bài: 180 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1C | 2B | 3C | 4A | 5D | 6D |
| 7B | 8C | 9D | 10A | 11D | 12A |
| 13 | 14 | 15 | 16 | 17 | 18 | |
| (a) | Đ | S | Đ | S | S | S |
| (b) | S | S | S | Đ | S | Đ |
| (c) | Đ | S | S | S | Đ | Đ |
| (d) | Đ | S | S | Đ | Đ | S |
I. TRẮC NGHIỆM
Phần 1. Trắc nghiệm nhiều lựa chọn (6,0 điểm): Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ ghi một phương án
(Xem giải) Câu 1. Cho các dung dịch có cùng nồng độ 0,1M: glucose, ammonia, aniline, ethylamine được kí hiệu ngẫu nhiên là X, Y, Z, T. Tiến hành đo giá trị pH của mỗi dung dịch thu được kết quả theo bảng sau:
| Dung dịch | X | Y | Z | T |
| pH | 8,8 | 11,1 | 11,9 | 7,0 |
Các dung dịch glucose, ammonia, aniline, ethylamine tương ứng với các kí hiệu là:
A. Z, X, Y, T. B. T, X, Z, Y. C. T, Y, X, Z. D. X, T, Y, Z.
(Xem giải) Câu 2. Chất X có các tính chất sau: (a) phản ứng với thuốc thử Tollens, (b) phản ứng cộng với HCN, (c) có phản ứng tạo iodoform CHI3. Chất X là
A. HCH=O. B. CH3CH=O. C. (CH3)2CO. D. HCOOH.
(Xem giải) Câu 3. R là nguyên tố mà nguyên tử có phân lớp electron ngoài cùng là 2p5. Cho các phát biểu sau về R:
(a) Tổng số hạt mang điện trong một nguyên tử R là 18.
(b) Số electron độc thân trong một nguyên tử R là 1.
(c) Oxide cao nhất của R là R2O7.
(d) Dung dịch muối NaR tác dụng với dung dịch AgNO3 sinh ra kết tủa.
(e) Đơn chất R2 có nhiều trong tự nhiên.
Số nhận xét đúng là
A. 4. B. 3. C. 2. D. 1.
(Xem giải) Câu 4. Liên kết cộng hóa trị được tạo thành do sự xen phủ các orbital nguyên tử; một số xen phủ orbital thường gặp như sau:
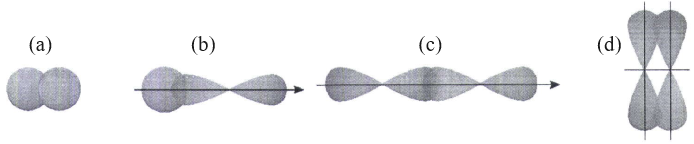
Cho các phát biểu:
(a) Kiểu xen phủ (a), (b), (c) hình thành liên kết σ.
(b) Kiểu xen phủ (d) hình thành liên kết π.
(c) Liên kết trong phân tử HCl theo kiểu xen phủ (c).
(d) Phân tử N2 chứa 3 xen phủ kiểu (d).
(e) Phân tử C2H4 có 5 liên kết σ và 1 liên kết π.
Số phát biểu đúng là
A. 3. B. 4. C. 2. D. 5.
(Xem giải) Câu 5. Cho các phát biểu sau về sulfur và hợp chất của sulfur:
(a) Trong tự nhiên, sulfur tồn tại chủ yếu ở dạng muối sulfide và muối sulfate của một số kim loại.
(b) Là một phi kim khá hoạt động nên trong tự nhiên không tìm thấy sulfur đơn chất.
(c) Trứng gà ung có mùi thối đặc trưng một phần là do các hợp chất của sulfur có trong trứng phân hủy gây ra.
(d) Thành phần chính của quặng pyrite là hợp chất của sulfur và chì (lead, Pb).
Số phát biểu đúng là
A. 1. B. 3. C. 4. D. 2.
(Xem giải) Câu 6. Cho các phương trình hóa học sau:
2FeBr2 + Br2 → 2FeBr3
2NaBr + Cl2 → 2NaCl + Br2
Phát biểu nào sau đây không đúng?
A. Tính khử của Cl- yếu hơn tính khử của Br-.
B. Tính oxi hóa của Cl2 mạnh hơn tính oxi hóa của Br2.
C. Tính khử của Br- yếu hơn tính khử của Fe2+.
D. Tính oxi hóa của Cl2 yếu hơn tính oxi hóa của Fe3+.
(Xem giải) Câu 7. Khi con người sử dụng thức ăn chứa tinh bột, enzyme α-amylase có trong nước bọt thúc đẩy quá trình thuỷ phân tinh bột thành các phân tử nhỏ hơn gồm dextrin và maltose. Quá trình này tiếp tục ở ruột non, nơi phần lớn tinh bột bị thuỷ phân thành glucose. Glucose được hấp thụ vào máu và di chuyển đến các tế bào trong khắp cơ thể. Glucose có thể được sử dụng cho nhu cầu năng lượng hoặc có thể được chuyển đổi thành glycogen lưu trữ trong gan và cơ. Sự chuyển hóa tinh bột trong cơ thể được biểu diễn bởi sơ đồ sau:
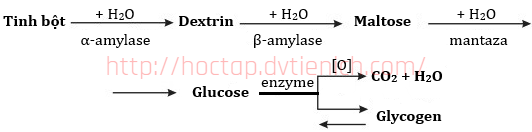
Trong sơ đồ trên, số phản ứng thuộc loại phản ứng thủy phân là
A. 3. B. 4. C. 5. D. 6.
(Xem giải) Câu 8. Tiến hành các thí nghiệm sau trong phòng thí nghiệm:
• Thí nghiệm 1: Nhúng giấy quỳ tím vào dung dịch ethylamine 5%.
• Thí nghiệm 2: Nhúng đũa thủy tinh sạch vào bình đựng dung dịch HCl đặc rồi đưa đũa thủy tinh lại miệng của bình chứa dung dịch ethylamine đậm đặc.
• Thí nghiệm 3: Cho vào ống nghiệm 5 giọt dung dịch FeCl3 3%, sau đó vừa lắc vừa thêm từ từ đến hết 2 mL dung dịch ethylamine 5%.
• Thí nghiệm 4: Cho vào ống nghiệm 5 giọt dung dịch CuSO4 5%, sau đó vừa lắc vừa thêm từ từ đến dư dung dịch ethylamine 5%.
Hiện tượng của các thí nghiệm trên như sau:
(a) Kết thúc thí nghiệm 1, thấy giấy quỳ tím chuyển sang màu xanh.
(b) Kết thúc thí nghiệm 2, thấy có khói trắng. Kết thúc thí nghiệm 3, thấy có kết tủa màu xanh.
(c) Trong quá trình thực hiện thí nghiệm 4, ban đầu có kết tủa màu xanh, sau đó kết tủa tan dần tạo dung dịch màu xanh lam.
(d) Nếu thay dung dịch ethylamine ở trên bằng dung dịch aniline thì hiện tượng ở các thí nghiệm 1, 2, 3, 4 vẫn xảy ra tương tự.
Số nhận định đúng là
A. 1. B. 3. C. 2. D. 4.
(Xem giải) Câu 9. Trong công nghiệp, Ammonia được tổng hợp từ nitrogen và hydrogen theo phương pháp Haber-Bosch. Phản ứng tổng hợp ammonia:
N2 (g) + 3H2 (g) ⇋ 2NH3 (g)  = – 91,8kJ
= – 91,8kJ
Kết quả nghiên cứu sự phụ thuộc của hiệu suất tổng hợp ammonia vào áp suất và nhiệt độ của phản ứng được thể hiện ở giản đồ trong hình dưới đây:
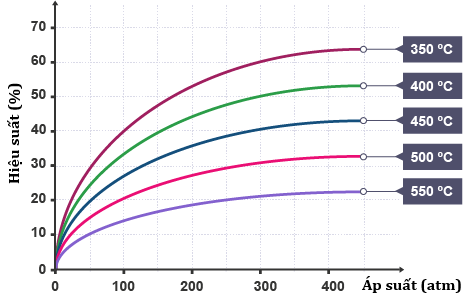
Nhận xét nào sau đây là đúng?
A. Ở nhiệt độ 400°C và 200 atm, hiệu suất phản ứng đạt 50%.
B. Nếu thực hiện phản ứng ở nhiệt độ càng thấp thì sẽ càng đạt hiệu quả kinh tế cao.
C. Trong khoảng từ 350°C đến 550°C, hiệu suất thu ammonia tăng dần.
D. Để tăng hiệu suất tổng hợp ammonia có thể đồng thời tăng áp suất và giảm nhiệt độ.
(Xem giải) Câu 10. Thuỷ phân không hoàn toàn một đoạn phân tử insulin, thu được peptide X (Glu-Arg-Gly). Cho công thức cấu tạo và kí hiệu một số nhóm chức của các amino acid:
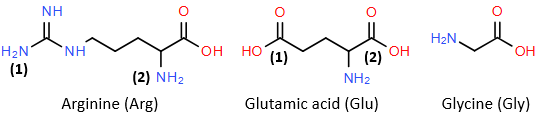
(a) Trong phân tử X còn nhóm carboxyl số (1) của Glu.
(b) Trong phân tử X, nhóm –NH2 số (1) của Arg đã tham gia tạo liên kết peptide.
(c) Tách biệt được hỗn hợp Glu, Arg, Gly bằng phương pháp điện di ở pH thích hợp.
(d) X có amino acid đầu N là Glu, amino acid đầu C là Gly.
Số nhận định đúng là
A. 3. B. 1. C. 4. D. 2.
(Xem giải) Câu 11. Cho sơ đồ các phản ứng theo đúng tỉ lệ mol:
(1) X + 2NaOH (t°) → 2X1 + X2
(2) X1 + HCl → X3 + NaCl
(3) Y + 2NaOH (t°) → Y1 + 2X2
(4) Y1 + 2HCl → Y2 + 2NaCl
(5) Y2 + X2 (H2SO4 đặc, t°) ⇌ Y3 + H2O
Cho biết: X (C6H10O5) là hợp chất hữu cơ mạch hở; Y (C6H10O4) là este hai chức. X1, X2, X3, Y1, Y2 và Y3 là các chất hữu cơ khác nhau. Cho các phát biểu sau:
(a) Phân tử X3 chứa đồng thời nhóm alcohol và nhóm carboxyl.
(b) Trong y tế, chất X2 được dùng để sát khuẩn.
(c) Phân tử khối của Y3 là 146.
(d) Nhiệt độ sôi của Y2 cao hơn nhiệt độ sôi của X3.
(e) 1 mol chất X, tác dụng với kim loại Na dư thu được tối đa 0,5 mol H2.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
(Xem giải) Câu 12. Hợp chất X có công thức phân tử C2H7NO2, khi phản ứng với dung dịch NaOH loãng tạo ra dung dịch Y và khí Z. Cho Z tác dụng với dung dịch gồm NaNO2 và HCl tạo ra T. Biết X, Y, Z, T là các chất hữu cơ khác nhau. Cho các phát biểu sau:
(a) X là α-amino acid.
(b) Z và T đều làm dung dịch phenolphthalein hóa hồng.
(c) Khí Z là methylamine.
(d) Cho 11,55 gam X tác dụng với 200 mL dung dịch NaOH 1,0M, cô cạn dung dịch sau phản ứng thu được 12,2 gam chất rắn khan.
(e) T dùng để sản xuất xăng E5.
Số phát biểu đúng là
A. 2. B. 3. C. 4. D. 5.
Phần 2. Trắc nghiệm đúng, sai (6,0 điểm): Thí sinh trả lời từ câu 13 đến câu 18. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh ghi Đúng (Đ) hoặc Sai (S).
(Xem giải) Câu 13. Poly(vinyl chloride) (PVC) là một chất dẻo có tính cách điện tốt, không thấm nước, bền với acid vì vậy nó được dùng để sản xuất vật liệu cách điện, ống dẫn nước,… Khi đun nóng, PVC mềm ra rồi nóng chảy và khi để nguội nó lại đóng rắn. Hiện nay, trong công nghiệp sản xuất PVC người ta đi từ nguyên liệu là khí ethylene và chlorine. Quy trình sản xuất thực hiện theo sơ đồ khép kín như sau:
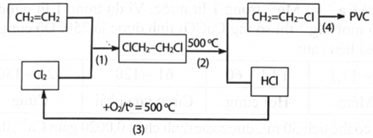
a) Phản ứng (3) giúp giảm thải khí gây ô nhiễm môi trường và tăng hiệu quả của quá trình sản xuất.
b) Đốt cháy là một trong các phương pháp xử lí chất thải nhựa PVC mà không làm ô nhiễm môi trường.
c) PVC thuộc loại polymer nhiệt dẻo và vật liệu làm bằng PVC có thể tái chế.
d) Biết chỉ có 1,4% lượng chlorine bị thất thoát vì vậy để sản xuất 1 tấn PVC cần 576 kg chlorine (làm tròn số đến hàng đơn vị).
(Xem giải) Câu 14. Một nhóm học sinh làm thí nghiệm để nghiên cứu sự phụ thuộc của sức điện động vào nồng độ của ion kim loại. Giả thuyết mà nhóm học sinh này đặt ra là: “Khi giảm nồng độ ion kim loại trong dung dịch thì sức điện động của pin cũng giảm”. Để kiểm chứng giả thuyết trên, nhóm học sinh tiến hành thí nghiệm ở điều kiện 25°C, áp suất 1 bar như sau:
• Bước 1: Chuẩn bị 5 cốc chứa dung dịch ZnSO4 1M, 5 cốc chứa dung dịch AgNO3 có nồng độ lần lượt là 1,00M; 0,50M; 0,10M; 0,05M; 0,01M; các thanh điện cực Zn và Ag có kích thước như nhau; cầu muối; điện kế để đo sức điện động.
• Bước 2: Tiến hành lắp các dụng cụ theo sơ đồ như hình vẽ sau:
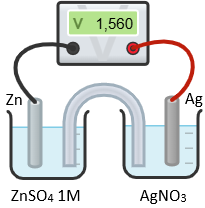
• Bước 3: Lần lượt thay các cốc chứa dung dịch AgNO3 có nồng độ khác nhau, tiến hành đo sức điện động của pin. Kết quả thí nghiệm được học sinh ghi theo bảng sau:
| Nồng độ dung dịch AgNO3 (mol/L) | 1,00 | 0,50 | 0,10 | 0,05 | 0,01 |
| Sức điện động của pin (V) | 1,560 | 1,542 | 1,501 | 1,483 | 1,442 |
a) Dựa vào kết quả thí nghiệm và lí thuyết điện hoá, giả thiết của học sinh đưa ra là hợp lý.
b) Chiều dòng điện di chuyển từ thanh Zn sang thanh Ag.
c) Khi nồng độ dung dịch AgNO3 là 0,10 M thì sức điện động chuẩn của pin là 1,501 V.
d) Từ kết quả thí nghiệm, tính được thế điện cực chuẩn của Ag+/Ag (khi nồng độ Ag+ bằng 0,50M) là 0,872V biết E°Zn2+/Zn = -0,76V.
(Xem giải) Câu 15. Để xác định nồng độ acetic acid có trong một mẫu giấm ăn, một nhóm học sinh tiến hành thí nghiệm sau:
• Bước 1: Pha loãng 10,00 mL giấm ăn bằng nước cất lên 10 lần trong bình định mức 100 mL thu được dung dịch X. Dùng pipette lấy 10,00 mL dung dịch X cho vào bình tam giác, thêm chưa to vài giọt chất chỉ thị phenolphthalein.
• Bước 2: Tráng sạch burette bằng nước cất, sau đó tráng lại bằng một ít dung dịch NaOH 0,01M lắp dụng cụ như hình vẽ; lấy dung dịch NaOH 0,01 M vào burette (đã khóa) và chỉnh về vạch 0.
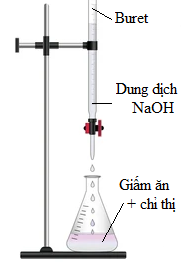
• Bước 3: Cho dung dịch NaOH trong burette chảy từ từ từng giọt vào bình tam giác đồng thời lắc đều bình. Quan sát đến khi dung dịch trong bình tam giác chuyển từ không màu sang màu hồng bền trong khoảng 20 giây thì dừng lại. Ghi kết quả thể tích dung dịch NaOH đã dùng.
• Bước 4: Lặp lại thí nghiệm 3 lần ghi lại kết quả như sau:
| Lần chuẩn độ | Lần 1 | Lần 2 | Lần 3 |
| Vdd NaOH (mL) | 15,1 | 14,9 | 15,0 |
a) Những dụng cụ thí nghiệm được sử dụng để pha và lấy chính xác các thể tích trong thí nghiệm trên gồm bình định mức, pipette và burette.
b) Ở bước 2, nếu tráng burette bằng dung dịch NaOH 0,02M sau khi đã rửa sạch bằng nước cất thì sai số của kết quả chuẩn độ vẫn là nhỏ nhất.
c) Nồng độ mol/L của acetic acid trong mẫu giấm ăn trên bằng 0,015 M.
d) Trong quá trình chuẩn độ, pH của dung dịch trong bình tam giác không thay đổi.
(Xem giải) Câu 16. Để tinh chế đồng từ một mẫu đồng không tinh khiết (chứa đồng và phần tạp chất còn lại không tham gia vào quá trình điện phân, tạp chất phân bố đều trong mẫu đồng), người ta đã thực hiện như sau:
• Bước 1: Nối mẫu đồng không tinh khiết với một điện cực và miếng đồng tinh khiết với điện cực còn lại của nguồn điện một chiều, rồi nhúng 2 điện cực vào bình điện phân chứa dung dịch copper(II) sulfate.
• Bước 2: Tiến hành điện phân với cường độ dòng điện 24A. Sau t giờ, các điện cực được lấy
ra, làm khô và đem cân.
Khối lượng các điện cực trước và sau điện phân được ghi lại trong bảng dưới đây:
| Thời điểm | Khối lượng mẫu đồng (gam) | Khối lượng miếng đồng tinh khiết (gam) |
| Trước điện phân | 1030 | 155 |
| Sau t giờ | 85,6 | 980 |
Giả sử hiệu suất quá trình điện phân là 100%. Biết q = ne.F = I.t, trong đó: q là điện lượng (C), ne là số mol electron đi qua dây dẫn, I là cường độ dòng điện (A), t là thời gian (giây), F là hằng số Faraday (96500 C/mol).
a) Trong thí nghiệm, mẫu đồng không tinh khiết được nối với cực/âm, miếng đồng tinh khiết được nối với cực dương của nguồn điện.
b) Ở cực âm xảy ra quá trình khử Cu2+.
c) Theo số liệu thu được, giá trị của t là 33 giờ (làm tròn đến hàng đơn vị).
d) Hàm lượng đồng trong mẫu đồng thô là khoảng 87,36%.
(Xem giải) Câu 17. Trong bình có dung tích không đổi 1 Lít, ban đầu nạp vào bình hỗn hợp gồm 0,9 mol chất A và 0,6 mol chất B. Giữ nhiệt độ ổn định ở 760°C, xảy ra cân bằng hóa học:
aA(g) + bB(g) ⇋ cC(g) + dD(g) (a, b, c, d là các hệ số nguyên, tối giản của phản ứng; biểu thức tính tốc độ phản ứng tuân theo định luật tác dụng khối lượng)
Sau 6 phút, phản ứng đạt tới trạng thái cân bằng. Sự phụ thuộc nồng độ mol/L của các chất trong bình phản ứng vào thời gian (phút) được biểu diễn bằng đồ thị sau:
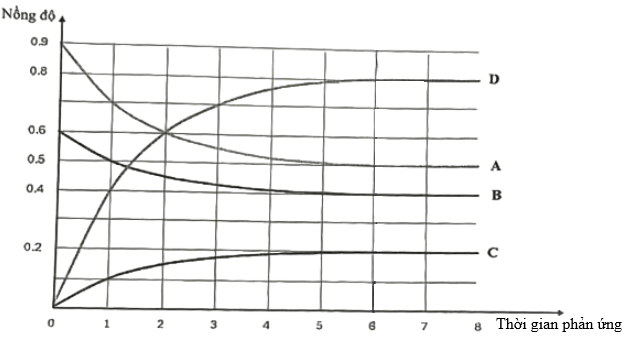
a) Trước khi đạt tới trạng thái cân bằng, tốc độ phản ứng nghịch giảm dần theo thời gian.
b) Ở trạng thái cân bằng, nếu tăng nhiệt độ của bình phản ứng thì số mol khí trong bình tăng lên, chứng tỏ rằng phản ứng thuận là phản ứng tỏa nhiệt.
c) Hằng số cân bằng của phản ứng ở 760°C là 0,8192.
d) Tốc độ trung bình của phản ứng thuận trong khoảng thời gian từ 0 đến 6 phút là 1/1800 mol/Ls
(Xem giải) Câu 18. Hợp chất E được điều chế từ alcohol X và carboxylic acid Y (biết Y là hợp chất tạp chức chứa vòng benzene). E có trong thành phần của một số thuốc giảm đau, xoa bóp, cao dán… Thành phần về khối lượng các nguyên tố trong E như sau: %C = 63,16%, %H = 5,26%, còn lại là oxygen. Phân tích E bằng phổ hồng ngoại (IR) cho kết quả xuất hiện các peak sau:
– Peak đặc trưng của liên kết C=O (số sóng 1750 -1735 cm-1);
– Peak đặc trưng liên kết C−O (số sóng 1300 – 1000 cm-1);
– Peak đặc trưng của liên kết O-H (số sóng 3650 – 3200 cm-1).
Từ phổ khối lượng (MS), xác định được E có phân tử khối là 152.
a) Dựa vào dữ kiện phân tích nguyên tố hợp chất E có công thức đơn giản nhất là C3H3O.
b) Trong dung dịch NaOH dư, 0,01 mol hợp chất E có thể phản ứng tối đa với 0,02 mol NaOH.
c) Tín hiệu phổ IR cho phép xác định được công thức cấu tạo của E.
d) Carboxylic acid Y phản ứng với alcohol X theo tỉ lệ mol tương ứng 2 : 1.
II. TỰ LUẬN
Câu 1. (2,0 điểm)
(Xem giải) 1.1. Cho phương trình nhiệt hóa học của phản ứng đốt cháy alkene X như sau:
CnH2n(g) + 1,5nO2(g) → nCO2(g) + nH2O(g)  = -1852kJ
= -1852kJ
a) Xác định công thức phân tử, công thức cấu tạo của alkene X. Cho bảng giá trị năng lượng liên kết sau:
| Liên kết | O=O | H-O | C-H | C=O | C=C | C-C |
| E (kJ/mol) | 498 | 467 | 413 | 799 | 611 | 414 |
b) Từ X điều chế X8 theo sơ đồ phản ứng sau:
![]()
Biết: Các chất X1, X2, X3, X4, X5, X6, X7, X8 là các chất hữu cơ, mỗi mũi tên là một phản ứng, X8 là polymer được dùng để làm kính máy bay, kính xây dựng, kính bảo hiểm, bể cá. X1 có phân tử khối là 78,5. Xác định công thức cấu tạo của các chất X1, X2, X3, X4, X5, X6, X7, X8.
(Xem giải) 1.2. Viết công thức Lewis, nêu trạng thái lai hóa của nguyên tử trung tâm của các phân tử CO2, SO2, NH3, H2O.
Câu 2. (2,0 điểm)
(Xem giải) 2.1. Trong công nghiệp, giấm ăn được điều chế bằng phương pháp lên men theo sơ đồ sau: (C6H10O5)n → C6H12O6 → C2H5OH → CH3COOH (Hiệu suất lần lượt là 60%, 50%, 50%).
a) Viết các phương trình hóa học xảy ra theo sơ đồ.
b) Từ 16,2 tấn sắn chứa 80% tinh bột (còn lại là tạp chất trơ) sản xuất được V m³ dung dịch acetic acid nồng độ 5%. Tính V (biết khối lượng riêng của dung dịch acetic acid nồng độ 5% là 1,0025 g/cm³).
c) Dung dịch CH3COOH 0,1M ở 25°C có Ka = 1,75.10^-5. Tính pH (bỏ qua sự phân ly của nước).
(Xem giải) 2.2. Hai hợp chất X, Y đều có phần trăm khối lượng carbon và hydrogen lần lượt là 63,16% và 8,77%, còn lại là oxygen. Bằng phổ MS xác định được MX = MY = 114. Tiến hành oxi hóa X, Y bằng KMnO4 trong môi trường base thì thu được các sản phẩm như sau:
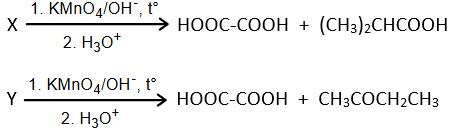
Biết: Trong hóa học hữu cơ, liên kết đôi C=C và alcohol bậc I có thể bị oxi hóa bởi KMnO4 theo sơ đồ sau:
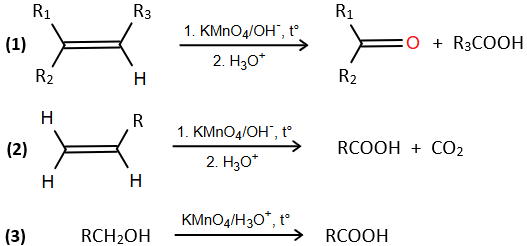
a) Xác định công thức phân tử của X, Y.
b) Xác định công thức cấu tạo và gọi tên của X, Y.
Câu 3. (2,0 điểm)
(Xem giải) 3.1. Sau đợt lũ lớn, người dân cần xử lí 12000 Lít nước lũ đọng để dùng tạm thời (giặt rửa, vệ sinh) bằng phèn chua hoặc PAC (poly (aluminium chloride)) để làm trong nước, sau đó khử trùng bằng chloramine-B.
Biết:
– Liều dùng làm trong 1,0 m³ nước cần: 30,0 gam phèn chua hoặc 9,0 gam PAC.
– Giá bán: phèn chua 20000 đ/kg; PAC 65000 đồng/kg.
– 1 viên chloramine-B 250 mg vừa đủ để khử trùng 30 Lít nước; giá 500 đồng/viên.
a) Giải thích vì sao phèn chua và PAC có tác dụng làm trong nước.
b) Tính khối lượng phèn chua hoặc PAC cần dùng để làm trong 12000 Lít nước.
c) Tính chi phí hóa chất làm trong nước khi dùng phèn chua hoặc PAC và cho biết dùng chất nào kinh tế hơn.
d) Tính số viên chloramine-B cần dùng và số tiền người dân cần trả để mua lượng chloramine-B trên.
(Xem giải) 3.2. Hiện nay người ta sản xuất ammonia bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí methane (thành phần chính của khí thiên nhiên).
Phản ứng điều chế H2: CH4 + 2H2O → CO2 + 4H2 (1)
Phản ứng loại O2 để thu N2: CH4 + 2O2 → CO2 + 2H2O (2)
Phản ứng tổng hợp NH3: N2 + 3H2 ⇋ 2NH3 (3)
Để sản xuất khí ammonia, nếu lấy 1683,4 m³ không khí (chứa 21,03% O2; 78,02% N2, còn lại là khí hiếm theo thể tích) thì cần phải lấy a m³ khí methane và b m³ hơi nước để có đủ lượng N2 và H2 theo tỉ lệ 1 : 3 về thể tích dùng cho phản ứng tổng hợp ammonia. Giả thiết các phản ứng (1), (2) đều xảy ra hoàn toàn và các thể tích khí đo ở cùng điều kiện.
Xác định giá trị (a + b).
Câu 4. (2,0 điểm)
(Xem giải) 4.1. Nguyên tố X thuộc nhóm A có hoá trị cao nhất trong oxide bằng VI, oxide này có khả năng hút ẩm mạnh và dễ dàng chuyển thành acid tương ứng khi tiếp xúc với nước. Hợp chất khí của X với hydrogen (chất Y) có chứa 5,88% khối lượng hydrogen, đây là một khí không màu, dễ cháy, thường sinh ra trong quá trình phân huỷ xác động thực vật; ở nồng độ cao, nó có thể gây ảnh hưởng nghiêm trọng đến hệ hô hấp của con người. Theo tài liệu của Cơ quan Quản lí An toàn và Sức khỏe Hoa Kì, nồng độ Y khoảng 100 ppm gây kích thích màng phổi. Nồng độ khoảng 400 – 700 ppm, Y gây nguy hiểm đến tính mạng chỉ trong 30 phút. Nồng độ trên 800 ppm gây mất ý thức và nguy cơ làm tử vong ngay lập tức.
a) Xác định nguyên tố X.
b) Khí Y là một khí độc có nhiều trong nước thải và hệ thống cống rãnh,… Tại 25°C, giả sử độ tan của Y trong nước thải là 0,4 g/L, tại 40°C độ tan của Y giảm xuống còn 0,25 g/L. Tính thể tích khí Y (đkc) thoát ra từ 1 m³ nước thải khi nhiệt độ nước tăng từ 25°C lên 40°C (bỏ qua sự bay hơi của nước).
c) Một gian phòng trống (25°C, 1 bar) có kích thước 4 m × 6 m × 3,5 m bị nhiễm 15 g khí Y. Tính nồng độ của Y và đánh giá mức độ độc hại của khí Y trong trường hợp này (biết rằng nồng độ ppm của Y trong không khí là số lít khí Y có trong 1,0×10^6L không khí).
(Xem giải) 4.2. DAP là tên viết tắt của diamonium phosphate, một loại phân bón vô cơ phức hợp được sử dụng rộng rãi trong nông nghiệp để cung cấp nitrogen và phosphorus, đồng thời giúp cải tạo đất chua. Phân bón DAP được sản xuất theo quy trình sau:
• Bước 1: Cho khí ammonia tác dụng với phosphoric acid trong thiết bị phản ứng.
• Bước 2: Dung dịch thu được cô đặc và tạo hạt.
• Bước 3: Sản phẩm được sấy khô và làm nguội.
a) Viết phương trình hóa học của phản ứng điều chế DAP.
b) Vì sao DAP dễ hút ẩm và dễ vón cục khi bảo quản? Đề xuất biện pháp bảo quản DAP.
c) Nêu hai lưu ý khi sử dụng phân DAP trong thực tế sản xuất nông nghiệp để đạt hiệu quả cao và hạn chế tác hại cho đất.
d) Một loại phân DAP thương phẩm có hàm lượng 18,0% N và 46,0% P2O5 (theo khối lượng). Một thửa ruộng cần được bón phân sao cho cung cấp đồng thời 12,0 kg nitrogen và 20,0 kg P2O5 cho cây trồng. Người nông dân dùng DAP kết hợp với phân urea chứa 46,0% N. Tính khối lượng mỗi loại phân cần dùng để cung cấp vừa đủ lượng nitrogen và phosphorus cho thửa ruộng trên.


Bình luận