[2025 – 2026] Thi học sinh giỏi lớp 12 – Tỉnh Ninh Bình
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Tổng hợp đề hsg theo năm học
⇒ Mã đề 022-H12A năm 2025-2026
⇒ Thời gian làm bài: 90 phút
⇒ Bảng đáp án phần trắc nghiệm:
| 1B | 2A | 3D | 4D | 5C | 6B | 7C | 8A | 9A | 10B |
| 11C | 12D | 13B | 14B | 15D | 16B | 17A | 18B | 19B | 20B |
| Câu 21 | Câu 22 | Câu 23 | Câu 24 | Câu 25 | Câu 26 | |
| (a) | S | S | Đ | Đ | Đ | S |
| (b) | S | S | S | S | S | S |
| (c) | Đ | Đ | S | S | Đ | Đ |
| (d) | S | S | Đ | Đ | Đ | Đ |
| Câu 27 | Câu 28 | Câu 29 | Câu 30 | Câu 31 | Câu 32 |
| 245 | 3 | 8,1 | 2 | 3 | 12 |
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 20. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Cho phản ứng hóa học sau: K2Cr2O7 + HCl → KCl + CrCl3 + Cl2 + H2O. Tỉ lệ mol giữa chất bị khử và chất bị oxi hóa ở phản ứng hóa học trên là
A. 6 : 1. B. 1 : 6. C. 3 : 1. D. 1 : 3.
(Xem giải) Câu 2. Có thể dùng phản ứng ozone phân để xác định cấu tạo của hydrocarbon không no, khi đó liên kết đôi C=C bị oxi hóa bằng ozone, rồi khử ngay bằng chất khử (CH3)2S tạo ra sản phẩm hữu cơ chứa oxygen theo sơ đồ sau:
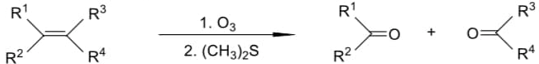
(trong đó R1, R2, R3, R4 là các gốc hydrocarbon hoặc nguyên tử H)
Để xác định cấu tạo của hydrocarbon A, người ta làm như sau:
• Tiến hành phân tích nguyên tố trong A, kết quả: carbon chiếm 88% về khối lượng, còn lại là hydrogen.
• Xác định phân tử khối của A bằng phương pháp phổ khối lượng, kết quả: peak ion phân tử có giá trị m/z lớn nhất là 150.
• Tiến hành ozone phân rồi khử A, thu được A1 và A2 theo sơ đồ sau:
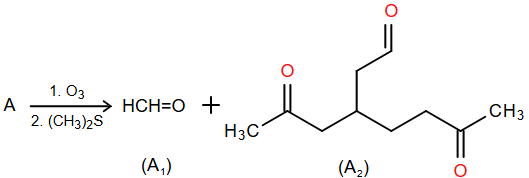
Số liên kết π trong A là
A. 2. B. 5. C. 3. D. 4.
(Xem giải) Câu 3. Cho giá trị nhiệt độ sôi của các hydrogen halide trong bảng sau:
| Chất | X | Y | Z | T |
| Nhiệt độ sôi (°C) | -66,7 | 19,5 | -84,9 | -35,8 |
Chất X là
A. HI. B. HF. C. HCl. D. HBr.
(Xem giải) Câu 4. Đất chua là đất có độ pH từ 3,0 đến 6,5. Nếu đất chua nhiều có thể độc cho hệ rễ cây, làm cho rễ bị bó và phát triển chậm. Muốn sản xuất được trên nền đất này cần phải cải thiện độ chua của đất trước khi gieo trồng. Cho biết một số loại cây trồng phù hợp với đất có giá trị pH như sau:
| STT | Cây trồng | pH thích hợp | STT | Cây trồng | pH thích hợp |
| 1 | Ngô | 5,7 – 7,5 | 4 | Chè | 4,5 – 5,5 |
| 2 | Cà chua | 6,0 – 7,0 | 5 | Thanh long | 4,0 – 6,0 |
| 3 | Cải thảo | 6,5 – 7,0 | 6 | Mía | 5,0 – 8,0 |
Một kỹ sư nông nghiệp đã xác định được giá trị pH trong khu vực đất canh tác là 5,4. Cho các phát biểu sau:
(1) Khu vực đất canh tác trên thuộc loại đất chua.
(2) Có bốn loại cây trồng ở bảng trên thích hợp với khu vực đất canh tác trên.
(3) Nếu bón tro thực vật (K2CO3) vào đất chua sẽ làm tăng giá trị pH của đất.
(4) Để xử lý đất chua, người ta thường dùng vôi bột để cải tạo đất.
(5) Để trồng cây cải thảo và cà chua vào khu vực đất canh tác trên, cần bón nhiều đạm NH4NO3 để tăng pH của đất.
Số phát biểu đúng là
A. 4. B. 5. C. 2. D. 3.
(Xem giải) Câu 5. Cellulose được sử dụng làm vật liệu xây dựng, sản xuất giấy, sợi tự nhiên, sợi nhân tạo và làm nguyên liệu để sản xuất ethanol. Dưới đây là cấu trúc của cellulose:
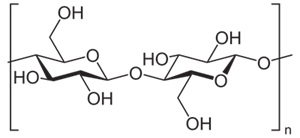
Cho các phát biểu sau:
(1) Cellulose polymer thiên nhiên.
(2) Phân tử cellulose tạo bởi nhiều đơn vị α-glucose, nối với nhau qua liên kết α-1,4-glycoside.
(3) Cellulose có nhiều trong sợi bông.
(4) Cellulose là chất rắn, màu trắng, dạng sợi không tan trong nước, tan tốt trong benzene hay ether.
(5) Cellulose tan được trong dung dịch [Cu(NH3)4](OH)2.
(6) Cần dùng 43,5 tấn dung dịch HNO3 63% để sản xuất 29,7 tấn cellulose trinitrate với hiệu suất tính theo HNO3 là 75% (kết quả làm tròn đến hàng phần mười).
Số phát biểu đúng là
A. 5. B. 4. C. 3. D. 2.
(Xem giải) Câu 6. Phản ứng hoá học: A + 2B → C, có mối liên hệ giữa tốc độ phản ứng và nồng độ các chất tham gia phản ứng là v = k.CA.CB². Tốc độ phản ứng thay đổi như thế nào nếu nồng độ chất A giảm đi 2 lần và nồng độ chất B tăng lên 2 lần?
A. không thay đổi. B. tăng lên 2 lần.
C. tăng lên 4 lần. D. giảm đi 2 lần.
(Xem giải) Câu 7. Ammonia được sản xuất trong công nghiệp dựa trên phản ứng sau đây: N2(g) + 3H2(g) ⇋ 2NH3(g) (t°, p, xt) ![]() = -92 kJ
= -92 kJ
Cho các phát biểu sau:
(1) Khi hỗn hợp phản ứng đang ở trạng thái cân bằng, nếu tăng áp suất của hệ thì hiệu suất tổng hợp ammonia tăng.
(2) Khi hỗn hợp phản ứng đang ở trạng thái cân bằng, nếu thêm chất xúc tác thì cân bằng chuyển dịch theo chiều thuận.
(3) Khi hỗn hợp phản ứng đang ở trạng thái cân bằng, nếu tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm.
(4) Khi làm lạnh hỗn hợp khí gồm ammonia, hydrogen và nitrogen thì ammonia hoá lỏng trước.
(5) Hỗn hợp khí X gồm N2 và H2 có tỉ khối hơi so với H2 bằng 4,25. Đun nóng X một thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối hơi so với H2 bằng 4,8. Hiệu suất phản ứng tổng hợp NH3 là 25% (kết quả làm tròn đến hàng đơn vị).
Số phát biểu đúng là
A. 2. B. 5. C. 3. D. 4.
(Xem giải) Câu 8. Sáp Carnauba là một loại sáp thực vật thu được từ lá cây cọ Carnauba của Brazil. Sáp Carnauba có thành phần chính là myricyl cerotate, một ester tạo bởi myricyl alcohol có công thức là CH3[CH2]29OH và cerotic acid là một acid béo có công thức C25H51COOH. Sáp Carnauba được sử dụng rộng rãi để đánh bóng sàn nhà, ô tô, đồ nội thất. Cho các phát biểu sau:
(1) Cerotic acid là một acid béo chưa bão hoà.
(2) Công thức phân tử của myricyl cerotate là C56H110O2.
(3) Sáp Carnauba có thành phần chính là chất béo.
(4) Thực vật ngăn ngừa mất nước bằng cách phủ sáp trên bề mặt lá của chúng.
(5) Thủy phân hoàn toàn 81,6 gam myricyl cerotate trong môi trường kiềm thu được 43,8 gam myricyl alcohol.
Số phát biểu đúng là
A. 2. B. 4. C. 3. D. 5.
(Xem giải) Câu 9. Khi cho propane tác dụng với chlorine ở điều kiện thích hợp thu được hỗn hợp hai sản phẩm thế monochloro là 1-chloropropane (43%) và 2-chloropropane (57%). Tỉ lệ khả năng phản ứng tương đối của nguyên tử hydrogen gắn với nguyên tử carbon bậc I so với nguyên tử hydrogen gắn với nguyên tử carbon bậc II trong phản ứng trên là
A. 43 : 171. B. 43 : 57. C. 1 : 1598. D. 3 : 1.
(Xem giải) Câu 10. Ở trạng thái cơ bản, nguyên tử nguyên tố X có tổng số electron trên phân lớp p là 11. Cho các kiểu xen phủ:
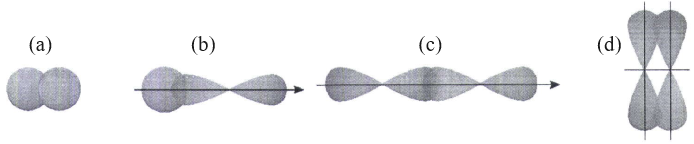
Hình ảnh nào ở trên thể hiện kiểu xen phủ giữa các orbital nguyên tử để tạo ra phân tử X2?
A. Hình ảnh (d). B. Hình ảnh (c). C. Hình ảnh (b). D. Hình ảnh (a).
(Xem giải) Câu 11. Cao su thiên nhiên là một loại polymer có chứa các mắt xích isoprene, các liên kết đôi trong mạch cao su đều ở dạng cis:
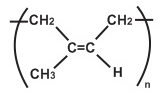
Cho các phát biểu sau:
(1) Cao su thiên nhiên được điều chế từ phản ứng trùng hợp isoprene.
(2) Cao su thiên nhiên tác dụng với lưu huỳnh thu được cao su Buna-S.
(3) Phản ứng lưu hóa cao su thuộc loại phản ứng tăng mạch polymer.
(4) Phản ứng cộng HCl vào cao su thiên nhiên thuộc loại phản ứng tăng mạch polymer.
(5) Cao su lưu hoá có tính chất lí hoá nổi trội hơn so với cao su ban đầu.
Số phát biểu đúng là
A. 4. B. 5. C. 2. D. 3.
(Xem giải) Câu 12. Phản ứng giữa ethylene với nước (xúc tác: dung dịch H2SO4 loãng, đun nóng), diễn ra theo cơ chế như sau:
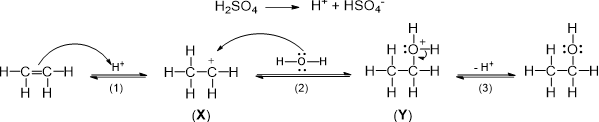
Biết số hiệu nguyên tử của các nguyên tố: H (Z = 1); C (Z = 6); O (Z = 8). Cho các phát biểu sau:
(1) Ở giai đoạn tạo thành X, liên kết π giữa hai nguyên tử carbon bị phân cắt.
(2) X là một carbocation có độ bền tương đối kém hơn +C(CH3)3.
(3) Trong Y, nguyên tử oxygen thỏa mãn quy tắc octet.
(4) Ion H+ đóng vai trò xúc tác cho phản ứng giữa ethylene và nước.
(5) Phản ứng giữa ethylene với nước được xúc tác bằng dung dịch H2SO4 loãng, đun nóng diễn ra theo cơ chế AN.
Số phát biểu đúng là
A. 2. B. 3. C. 5. D. 4.
(Xem giải) Câu 13. Một nonapeptide X được sản sinh từ huyết thanh trong máu, có thể bị thủy phân hoàn toàn trong môi trường acid để tạo ra 3 phân tử Pro, 2 phân tử Arg, 2 phân tử Phe, 1 phân tử Ser và 1 phân tử Gly. Thuỷ phân không hoàn toàn X thu được hỗn hợp sản phẩm trong đó có pentapeptide Pro-Pro-Gly-Phe-Ser, tripeptide Ser-Pro-Phe và Arg. Phân tích nhóm đầu và nhóm cuối của X cho thấy các amino acid đều giống nhau. Nếu đánh số 1 là amino acid đầu N thì số thứ tự của Ser trong X là số mấy?
A. 1. B. 6. C. 9. D. 4.
(Xem giải) Câu 14. Thêm hexane vào dung dịch iodine trong nước, lắc đều rồi để yên, sau đó thu lấy lớp hữu cơ, làm bay hơi dung môi để thu lấy iodine.
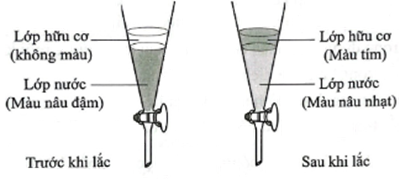
Cho các phát biểu sau:
(1) Sau khi lắc, lớp hữu cơ (màu tím) do iodine tan trong hexane.
(2) Dung môi hexane có nhiệt độ sôi thấp dễ bay hơi, nên sau khi chiết dễ thu hồi sản phẩm chiết.
(3) Lớp nước (màu nâu nhạt) được gọi là dịch chiết.
(4) Phương pháp thu lấy iodine từ dung dịch iodine trong nước theo quy trình được mô tả ở trên là chiết lỏng – lỏng.
(5) Có thể dùng hexane để tách β-carotene từ nước ép cà rốt bằng phương pháp trên.
Số phát biểu đúng là
A. 3. B. 4. C. 5. D. 2.
(Xem giải) Câu 15. Năng lượng hoạt hóa (kí hiệu Ea) là năng lượng tối thiểu mà các chất phản ứng cần phải có để phản ứng có thể xảy ra. Phương trình kinh nghiệm Arrhenius biểu diễn mối liên hệ giữa nhiệt độ, năng lượng hoạt hóa với hằng số tốc độ phản ứng: 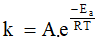 , trong đó:
, trong đó:
• k: hằng số tốc độ của phản ứng
• A: hằng số đặc trưng cho mỗi phản ứng
• e = 2,7183 (cơ số logarit tự nhiên)
• R: hằng số khí lí tưởng (R = 8,314 J/(mol.K))
• T: nhiệt độ theo thang Kelvin: T(K) = t(°C) + 273
• Ea: năng lượng hoạt hóa, đơn vị J/mol
Cho các phát biểu sau:
(1) Phản ứng có năng lượng hoạt hóa càng nhỏ thì tốc độ phản ứng càng lớn.
(2) Với đa số phản ứng, nhiệt độ càng cao, tốc độ phản ứng càng lớn.
(3) Chất xúc tác làm giảm năng lượng hoạt hóa từ đó làm tăng tốc độ phản ứng.
(4) Một phản ứng hoá học có hằng số tốc độ là 11 M-1.s-1 tại nhiệt độ 445K và hằng số đặc trưng A là 20 11 M-1.s-1 thì năng lượng hoạt hoá của phản ứng trên là 1418 J/mol (kết quả làm tròn đến hàng đơn vị).
(5) Một phản ứng hoá học có năng lượng hoạt hóa Ea = 100 kJ/mol, khi tăng nhiệt độ từ 298K lên 308K thì tốc độ phản ứng tăng lên 3,7 lần (kết quả làm tròn đến hàng phần mười).
Số phát biểu đúng là
A. 5. B. 3. C. 2. D. 4.
(Xem giải) Câu 16. Disaccharide X là thành phần chính của đường mạch nha. Trong dung dịch nước, X tồn tại chủ yếu ở hai dạng cấu tạo (I) và (II). Các dạng này tồn tại trong cân bằng sau:
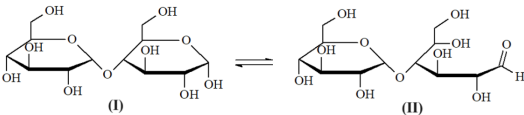
Cho các phát biểu sau:
(1) Dạng (I) nhiều hơn dạng (II) một liên kết sigma.
(2) Liên kết giữa hai đơn vị monosaccharide trong phân tử X là liên kết α-1,4-glucoside.
(3) X và saccharose đều phản ứng với Cu(OH)2 trong dung dịch NaOH ở điều kiện thường.
(4) Thuỷ phân X trong môi trường kiềm chỉ thu được glucose.
(5) X có thể thu được khi thuỷ phân cellulose bởi enzyme amylase.
Số phát biểu đúng là
A. 3. B. 2. C. 4. D. 5.
(Xem giải) Câu 17. Pin nhiên liệu methane – oxygen hoạt động ở 80°C, có cấu tạo và sơ đồ vận chuyển của nguyên liệu, sản phẩm như hình bên.
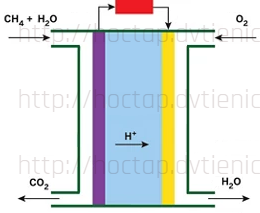
Chất điện li là acid và các quá trình xảy ra như sau:
(1) CH4(g) + 2H2O(g) → CO2(g) + 8H+(aq) + 8e
(2) O2(g) + 4H+(aq) + 4e → 2H2O(g)
Pin nhiên liệu hoạt động liên tục nên nguyên liệu liên tục được nạp vào và sản phẩm được chuyển ra khỏi hai điện cực. Cho các phát biểu sau:
(1) Quá trình (1) xảy ra tại anode và quá trình (2) xảy ra tại cathode.
(2) Trong cùng một khoảng thời gian, số mol khí đi vào anode lớn hơn số mol khí đi vào cathode.
(3) Trong cùng một khoảng thời gian, số mol chất đi ra khỏi anode lớn hơn số mol chất đi ra khỏi cathode.
(4) Trong quá trình pin hoạt động, ion H+ di chuyển từ anode đến cathode để trung hòa điện tích sinh ra do chuyển động electron và duy trì dòng điện ổn định trong mạch ngoài.
(5) Trong pin nhiên liệu methane – oxygen xảy ra quá trình oxi hoá trực tiếp methane.
Số phát biểu đúng là
A. 3. B. 5. C. 2. D. 4.
(Xem giải) Câu 18. Cho sơ đồ (1) biểu diễn quá trình điện phân dung dịch CuSO4 với điện cực trơ, sơ đồ (2) biểu diễn quá trình tinh luyện đồng bằng phương pháp điện phân. Trong sơ đồ (2), khối đồng không tinh khiết (các tạp chất không tham gia quá trình điện phân) được gắn với một điện cực của nguồn điện, thanh đồng tinh khiết được gắn với điện cực còn lại của nguồn điện, dung dịch điện phân là dung dịch CuSO4.
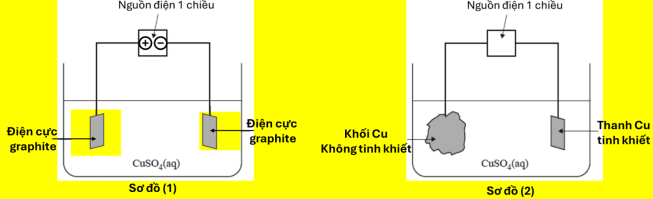
Phát biểu nào sau đây sai?
A. Muốn tinh luyện Cu như sơ đồ (2) thì khối đồng không tinh khiết phải được nối vào anode, còn thanh đồng tinh khiết được nối vào cathode.
B. Trong quá trình điện phân, ở anode của sơ đồ (1) và sơ đồ (2) đều xảy ra quá trình oxi hoá H2O.
C. Trong quá trình điện phân, ở cathode của sơ đồ (1) và sơ đồ (2) đều xảy ra quá trình khử Cu2+.
D. Khi điện phân xảy ra ở sơ đồ (2), nồng độ Cu2+ trong dung dịch không đổi theo thời gian (coi thể tích dung dịch không đổi).
(Xem giải) Câu 19. Độ dinh dưỡng của phân đạm được đánh giá theo tỉ lệ phần trăm về khối lượng của nitrogen. Một mẫu đạm urea X (gồm (NH2)2CO và tạp chất trơ không có nitrogen chiếm 4% về khối lượng). Trong quá trình bảo quản, X hút ẩm và chuyển hóa một phần thành (NH4)2CO3 theo phương nguyên tố trình hoá học sau: (NH2)2CO + 2H2O → (NH4)2CO3, thu được mẫu đạm Y (gồm (NH4)2CO3, (NH2)2CO và các tạp chất trơ ban đầu) có độ dinh dưỡng là 41,79%. Cho các phát biểu sau:
(1) Đối với loại đất chua nên trộn đạm urea với vôi sống để vừa bón phân, vừa khử chua.
(2) Trong công nghiệp, sản xuất đạm urea bằng cách cho khí ammonia tác dụng với khí carbon dioxide trong điều kiện sản xuất thích hợp.
(3) Đạm urea khô ở dạng hạt, màu trắng, dễ hút ẩm, tan tốt trong nước.
(4) Trong các loại phân đạm hiện nay, đạm urea là phân đạm có độ dinh dưỡng cao nhất.
(5) Phần trăm về khối lượng của (NH4)2CO3 trong Y là 19,71% (chỉ làm tròn ở phép tính cuối cùng, kết quả làm tròn đến hàng phần trăm).
Số phát biểu đúng là
A. 5. B. 3. C. 2. D. 4.
(Xem giải) Câu 20. Cho X, Y, Z, T là các chất khác nhau trong 4 chất: CH3COOH, C2H5OH, CH3CHO, HCOOH có nhiệt độ sôi được ghi trong bảng sau:
| Chất | X | Y | Z | T |
| Nhiệt độ sôi (°C) | 78,3 | 101 | 20 | 118 |
Cho các phát biểu sau:
(1) Ở cùng nồng độ mol/L, giá trị pH của dung dịch Y nhỏ hơn của dung dịch T.
(2) Có thể dùng dung dịch T để loại bỏ cặn (thành phần chính là CaCO3) bám ở đáy ấm đun nước.
(3) Nhiệt độ sôi của Y lớn hơn X vì liên kết hydrogen giữa các phân tử Y bền hơn liên kết hydrogen giữa các phân tử X.
(4) Từ X và Z đều có thể điều chế trực tiếp được T.
(5) Có thể sử dụng phổ hồng ngoại để phân biệt các chất X, Y, Z.
(6) Ở 25 °C các chất X, Y, Z, T đều là chất lỏng.
Số phát biểu đúng là
A. 2. B. 5. C. 4. D. 3.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 21 đến câu 26. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
(Xem giải) Câu 21. Một nhóm học sinh tiến hành thí nghiệm nghiên cứu tính tan và khả năng thủy phân của ester trong các điều kiện khác nhau.
Chuẩn bị: Isoamyl acetate (cho biết t°nc = -78°C; t°s = 142°C; D = 0,876 g/cm³), dung dịch H2SO4 20%, dung dịch NaOH 30%, nước cất, ống nghiệm và các dụng cụ cần thiết khác.
Các bước tiến hành:
• Bước 1: Cho 5 mL nước cất vào ống nghiệm (1); 5 mL dung dịch H2SO4 20% vào ống nghiệm (2); 5 mL dung dịch NaOH 30% vào ống nghiệm (3).
• Bước 2: Thêm vào mỗi ống nghiệm 2 mL isoamyl acetate, lắc đều chất lỏng trong các ống nghiệm.
• Bước 3: Đun cách thuỷ các ống nghiệm trong khoảng thời gian 20 phút.
• Bước 4: Lấy các ống nghiệm đó ra và quan sát hiện tượng (hình vẽ minh họa).

a) Ở bước 4, ống nghiệm (2) chỉ chứa các chất isoamyl alcohol, acetic acid, isoamyl acetate và nước.
b) Dựa vào kết quả thí nghiệm, có thể rút ra kết luận: tất cả các phản ứng thuỷ phân ester trong môi trường acid là phản ứng thuận nghịch; tất cả các phản ứng thuỷ phân ester trong môi trường kiềm là phản ứng một chiều.
c) Ở bước 4, chất lỏng phía trên trong ống nghiệm (1) là isoamyl acetate.
d) Phản ứng thủy phân isoamyl acetate trong ống nghiệm (3) biểu diễn được bởi phương trình sau:
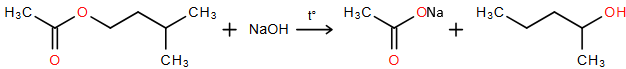
(Xem giải) Câu 22. Vôi sống có nhiều ứng dụng như: sản xuất vật liệu xây dựng, vật liệu chịu nhiệt, khử chua đất trồng, tẩy uế, sát trùng, xử lí nước thải,… Hiện nay, nhiều lò nung vôi thủ công hoạt động tự phát, gây ảnh hưởng xấu đến môi trường xung quanh. Ở các lò nung vôi công nghiệp, quá trình kiểm soát phát thải ô nhiễm được thực hiện chặt chẽ hơn. Xét một lò nung vôi công nghiệp sử dụng than đá làm nhiên liệu. Giả thiết:
– Đá vôi chỉ chứa CaCO3 và để phân hủy 1 kg đá vôi cần cung cấp một nhiệt lượng là 1800 kJ.
– Đốt cháy 1 kg than đá giải phóng ra một nhiệt lượng là 27000 kJ và có 50% lượng nhiệt này được hấp thụ ở quá trình phân hủy đá vôi.
– Than đá chứa 1% sulfur (ở dạng hợp chất như FeS2, CaSO4, CxHySH,…) về khối lượng, 80% lượng sulfur bị đốt cháy tạo thành SO2 và 1,6% lượng SO2 sinh ra phát thải vào khí quyển.
– Công suất của lò nung vôi là 350 tấn vôi sống/ngày.
a) Phản ứng nhiệt phân đá vôi là phản ứng thu nhiệt nên ![]() < 0.
< 0.
b) Khí CO2 khi phát thải gây hiện tượng phú dưỡng và hiệu ứng nhà kính.
c) Mỗi ngày, lò nung vôi trên đã sử dụng 83,3 tấn than đá (kết quả làm tròn đến hàng phần mười).
d) Giả thiết toàn bộ lượng SO2 thoát ra từ lò nung vôi trên trong 30 ngày chuyển hết thành sufuric acid trong nước mưa với nồng độ H2SO4 là 10^-5 M. Khi toàn bộ lượng nước mưa này rơi trên một vùng đất rộng 40 km² thì tạo ra một cơn mưa acid với lượng mưa trung bình là 12,5 mm (chỉ làm tròn ở phép tính cuối cùng và làm tròn đến hàng phần mười).
(Xem giải) Câu 23. Emmental là một loại phô mai làm từ sữa bò, có màu vàng nhạt và vị chua nhẹ (gần giống vị của trái cây). Một trong những đặc điểm hấp dẫn của Emmental là những lỗ khí tròn nhỏ rải đều bên trong, tạo nên vẻ ngoài đặc trưng. Những lỗ bong bóng này được hình thành do khí carbon dioxide sinh ra trong quá trình lên men vi sinh vật từ lactose, như sau:
• Giai đoạn 1: Vi khuẩn Lactobacillus lên men lactose:
C12H22O11 (lactose) + H2O → 4C3H6O3
• Giai đoạn 2: Vi khuẩn Propionibacterium freudenreichii tiếp tục chuyển hóa các sản phẩm trên, tạo ra CO2 – hình thành các bong bóng khí:
3C3H6O3 (Propionibacterium freudenreichii) → 2C3H6O2 + C2H4O2 + CO2 + H2O
Các hợp chất C3H6O3, C3H6O2, C2H4O2 góp phần gây ra vị chua của phô mai. Phổ hồng ngoại IR của ba chất C3H6O3, C3H6O2, C2H4O2 được biểu diễn như sau:
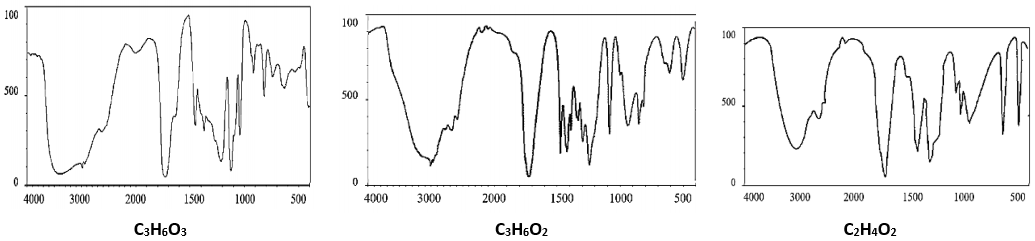
Biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng ngoại (IR):
| Liên kết | O-H (alcohol) | C=O (aldehyde) | C-H (aldehyde) | C=O (carboxylic acid) | O-H (carboxylic acid) |
| Số sóng (cm-1) | 3500 – 3200 | 1740 – 1685 | 2830 – 2695 | 1760 – 1690 | 3300 – 2500 |
a) C2H4O2, C3H6O2 là hợp chất hữu cơ đơn chức, còn C3H6O3 là hợp chất hữu cơ tạp chức.
b) Tên thay thế của C3H6O2 là propionic acid.
c) Nhiệt độ càng cao thì tốc độ phản ứng hoá học của giai đoạn 1 và giai đoạn 2 xảy ra càng nhanh.
d) Trong quá trình lên men, khí CO2 (ở giai đoạn 2) tạo bong bóng hình thành lỗ khí có dạng hình cầu trong miếng phô mai. Giả sử mỗi bong bóng khí có đường kính 0,5 cm chỉ chứa khí CO2 sinh ra từ quá trình lên men (giai đoạn 2). Khối lượng lactose (giai đoạn 1) đã bị vi khuẩn phân giải để tạo ra lượng CO2 có trong một bong bóng là xấp xỉ 0,75 miligam. Biết ở 25°C và 1 bar, 1 mol khí chiếm thể tích là 24,79 dm³; hiệu suất của cả quá trình là 90% và π = 3,14 (chỉ làm tròn ở phép tính cuối cùng, kết quả làm tròn đến hàng phần trăm).
(Xem giải) Câu 24. Một nhóm học sinh tiến hành đo pH các dung dịch có nồng độ 0,1M ở 25°C của các chất: NH3; CH3NH2; CH3CH2NH2; (CH3)2NH; CH3CH2CH2NH2. Kết quả thu được như sau:
| Chất | NH3 | CH3NH2 | C2H5NH2 | (CH3)2NH | CH3CH2CH2NH2 |
| pH | 11,1 | 11,3 | 11,4 | 11,7 | 11,5 |
a) Kb là hằng số cân bằng ở 25°C của quá trình: CH3NH2(aq) + H2O(l) ⇋ CH3NH3+(aq) + OH-(aq) có giá trị là a.10^-5. Giá trị của a là 4,06 (kết quả làm tròn đến hàng phần trăm).
b) Thêm từ từ đến dư dung dịch C2H5NH2 vào dung dịch FeCl3 thu được kết tủa màu nâu đỏ, sau đó tan dần.
c) Từ kết quả đo pH, nhóm học sinh kết luận khi số nguyên tử carbon trong phân tử amine tăng thì tính base của amine tăng.
d) NH3 có tính base yếu hơn các amine được khảo sát.
(Xem giải) Câu 25. Trong phòng thí nghiệm, nồng độ của dung dịch acetic acid được xác định bằng phương pháp chuẩn độ acid – base, biết hằng số phân li của CH3COOH (nhiệt độ 25°C) là Ka = 1,8.10^-5. Nhóm học sinh tiến hành thí nghiệm với các dụng cụ và hoá chất như sau:
– Dụng cụ: pipette, burette, bình tam giác.
– Hoá chất: Dung dịch chuẩn NaOH 0,10M, dung dịch CH3COOH, phenolphthalein.
Các bước tiến hành:
• Bước 1: Dùng pipette lấy 10,0 mL dung dịch CH3COOH cho vào bình tam giác, nhỏ thêm 2 đến 3 giọt phenolphthalein vào và lắc đều.
• Bước 2: Lấy dung dịch NaOH 0,10 M vào burette (loại 25 mL) và điều chỉnh dung dịch trong
burette ở mức 0.
• Bước 3: Mở khoá burette, nhỏ từ từ dung dịch NaOH vào bình tam giác đựng mẫu acid (lắc đều bình trong quá trình chuẩn độ), đến khi kết thúc chuẩn độ, ghi thể tích dung dịch NaOH 0,10M trong burette đã dùng.
Kết quả thu được sau 3 lần chuẩn độ như sau:
| Lần | Thể tích dung dịch CH3COOH (mL) | Thể tích NaOH (mL) |
| 1 | 10 | 15,0 |
| 2 | 10 | 15,1 |
| 3 | 10 | 15,2 |
a) Tại thời điểm hai chất phản ứng vừa đủ với nhau thì pH của dung dịch thu được lớn hơn 7.
b) Trước khi chuẩn độ, nếu không tráng burette bằng dung dịch NaOH mà chỉ rửa bằng nước cất, kết quả nồng độ acid tính được sẽ thấp hơn thực tế.
c) Nồng độ của dung dịch acetic acid là 0,151M.
d) Nếu lấy 50 mL dung dịch CH3COOH trên trộn với 50mL dung dịch CH3COONa 0,01 M thì thu được dung dịch có pH bằng 3,6 (coi thể tích dung dịch sau pha trộn là 100 mL, chỉ làm tròn ở phép tính cuối cùng, kết quả làm tròn đến hàng phần mười).
(Xem giải) Câu 26. Một nhóm học sinh tiến hành điện phân dung dịch sodium chloride có màng ngăn xốp với các dụng cụ và hoá chất như sau:
– Hoá chất: Dung dịch NaCl bão hòa.
– Dụng cụ: Cốc thuỷ tinh loại 100 mL, hai điện cực than chì, nguồn điện (pin 9V), dây dẫn điện, kẹp kim loại, màng ngăn xốp.
– Các bước tiến hành:
• Bước 1: Rót khoảng 60 mL dung dịch NaCl bão hòa vào cốc thuỷ tinh.
• Bước 2: Đặt màng ngăn xốp vào giữa cốc ngăn cách dung dịch thành hai phần bằng nhau.
• Bước 3: Nhúng hai điện cực vào hai phần khác nhau của dung dịch.
• Bước 4: Nối hai điện cực với hai cực của nguồn điện (như hình vẽ minh hoạ) và tiến hành điện phân trong khoảng 5 phút.
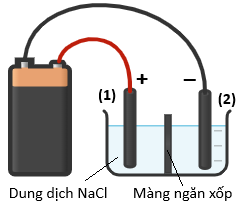
a) Ở anode xảy ra quá trình khử ion Cl-.
b) Màng ngăn xốp ngăn không cho Na+, OH- và Cl2 đi qua.
c) Thực hiện thí nghiệm tương tự như trên nhưng không có màng ngăn xốp, sau đó cho một mẫu cánh hoa hồng vào cốc chứa khoảng 5 mL dung dịch sau điện phân thì cánh hoa hồng mất màu.
d) Trong công nghiệp, xút (sodium hydroxide) được sản xuất bằng phương pháp điện phân dung dịch sodium chloride có màng ngăn xốp. Từ quá trình điện phận nêu trên, một lượng chlorine và hydrogen sinh ra dùng để sản xuất hydrochloric acid đặc thương phẩm (32%, D = 1,153 g/mL ở 30°C). Một nhà máy có quy mô sản xuất 200 tấn xút mỗi ngày thì đồng thời sản xuất được 237,4 m³ acid thương phẩm trên. Biết rằng, tại nhà máy này 60% khối lượng chlorine sinh ra được dùng để tổng hợp hydrochloric acid và hiệu suất của toàn bộ quá trình sản xuất hydrochloric acid đặc thương phẩm từ chlorine và hydrogen đạt 80%. (chỉ làm tròn ở phép tính cuối cùng, kết quả làm tròn đến hàng phần mười).
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 27 đến câu 32.
(Xem giải) Câu 27. Thuỷ phân hoàn toàn peptide X (Gly-Glu-Arg) thu được các amino acid sau:
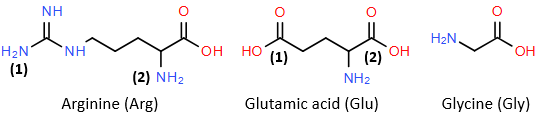
Cho biết: Điểm đẳng điện (kí hiệu pI) là giá trị pH của dung dịch mà tại đó amino acid tồn tại ở dạng ion lưỡng cực và tổng điện tích dương bằng tổng điện tích âm. Khi pH < pI thì amino acid đó tồn tại chủ yếu ở dạng cation, khi pH > pI thì amino acid đó tồn tại chủ yếu ở dạng anion. Giá trị pI tương ứng của glutamic acid, glycine, arginine là 3,08; 6,06; 10,76. Cho các phát biểu sau:
(1) X có amino acid đầu N là Arg, amino acid đầu C là Gly.
(2) Trong phân tử X, nhóm -COOH số (2) của Glu đã tham gia tạo liên kết peptide với nhóm -NH2 số (2) của Arg.
(3) Tại pH = 6,06 thì Glu tồn tại chủ yếu ở dạng cation.
(4) Tại pH = 12, khi đặt trong điện trường cả ba amino acid cùng di chuyển về cực dương.
(5) Cho glutamic acid tác dụng với NaOH trong dung dịch theo tỉ lệ mol 1 : 1 thu được chất hữu cơ Y, khi đặt trong điện trường chất Y sẽ di chuyển về phía cực dương.
Liệt kê các phát biểu đúng theo thứ tự tăng dần (ví dụ: 123, 124,…)
(Xem giải) Câu 28. Trong công nghiệp, để hạn chế chất thải ra môi trường và làm tăng hiệu quả của quá trình sản xuất PVC từ ethylene, người ta thực hiện quy trình sản xuất khép kín ứng với các phản ứng (1), (2), (3), (4) theo sơ đồ sau:
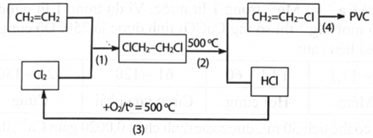
Cho các phát biểu sau:
(1) Phản ứng (1), (2), (3) và (4) đều là các phản ứng oxi hoá – khử.
(2) Phản ứng (3) giúp tăng hiệu quả của quá trình sản xuất PVC và hạn chế gây ô nhiễm môi trường.
(3) PVC là polymer nhiệt dẻo, bị phân hủy khi đun nóng.
(4) Có thể tái chế và tái sử dụng các sản phẩm làm từ nhựa PVC.
(5) Để sản xuất 2,0 tấn PVC theo sơ đồ trên với hiệu suất của phản ứng (1), (2), (4) lần lượt là 90%, 85%, 95% thì cần 618,44 kg ethylene (chỉ làm tròn ở phép tinh cuối cùng, kết quả làm tròn đến hàng phần trăm).
Số phát biểu đúng là bao nhiêu?
(Xem giải) Câu 29. Trong công nghiệp, nhôm được sản xuất từ quặng bauxite theo 2 giai đoạn chính:
• Giai đoạn 1: Tinh chế quặng bauxite.
• Giai đoạn 2: Điện phân Al2O3 nóng chảy (Al2O3 được trộn cùng với cryolite Na3AlF).
Sản phẩm điện phân ở cathode là nhôm (lỏng) và ở anode là hỗn hợp khí CO2, CO, O2. Cấu tạo bể điện phân như hình sau:
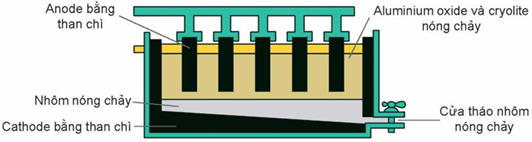
Sau một thời gian điện phân thu được m tấn Al và hỗn hợp khí X (gồm CO2, CO và O2 có tỉ lệ về thể tích là 7 : 2 : 1 trong cùng điều kiện). Giả thiết không có thêm sản phẩm nào được sinh ra trong quá trình điện phân. Biết rằng khối lượng carbon bị oxi hóa trên anode là 2,7 tấn. Giá trị của m là bao nhiêu?
(Xem giải) Câu 30. Methane hydrate (có công thức (CH4)x(H2O)23, trong đó hydrogen chiếm 12,971% về khối lượng) là hợp chất kết tinh, có khả năng cung cấp khí đốt. Nếu phá hủy hoàn toàn m tấn tinh thể methane hydrate, rồi đốt cháy hết lượng CH4 thu được (ở điều kiện chuẩn), thì năng lượng sinh ra tối đa là 4140 kWh.
Biết: 1 kWh = 3600 kJ; phản ứng đốt cháy: CH4(g) + 2O2(g) → CO2(g) + 2H2O(l), có:
| Chất | CH4(g) | O2(g) | CO2(g) | H2O(l) |
| -74,6 | -393,5 | -285,8 |
Giá trị của m là bao nhiêu? (chỉ làm tròn ở phép tính cuối cùng, kết quả làm tròn đến hàng đơn vị).
(Xem giải) Câu 31. Sulfuric acid là một trong những hóa chất quan trọng được sử dụng trong công nghiệp. Phương pháp sản xuất sulfuric acid phổ biến là phương pháp tiếp xúc, theo đó acid có thể được sản xuất từ quặng pyrite qua các giai đoạn theo sơ đồ sau:
• Giai đoạn 1: Sản xuất SO2
4FeS2(s) + 11O2(g) → 2Fe2O3(s) + 8SO2(g) (1)
• Giai đoạn 2: Sản xuất SO3
2SO2(g) + O2(g) ⇋ 2SO3(g)  = -196kJ (2)
= -196kJ (2)
• Giai đoạn 3: Sản xuất H2SO4
H2SO4(aq) + nSO3(g) → H2SO4.nSO3) (oleum) (3)
H2SO4.пSO3() + nH2O(1) → (n + 1)H2SO4(aq) (4)
Cho các phát biểu sau:
(1) Ở giai đoạn (1) có thể thay quặng pyrite bằng sulfur.
(2) Ở giai đoạn (2), khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều thuận, nhưng nhiệt độ thấp thì tốc độ phản ứng chậm; nhiệt độ phù hợp thực hiện phản ứng khoảng 450°C.
(3) Ở giai đoạn (3), oleum được tạo ra bằng cách phun dung dịch H2SO4 loãng từ trên xuống và bơm SO3 từ dưới lên.
(4) Từ 1,2 tấn quặng pyrite (chứa 80% FeS2, các tạp chất trong quặng không chứa sulfur) sản xuất được 870 lít dung dịch H2SO4 98% (D = 1,84 g/mL). Biết hiệu suất của cả quá trình là 90% (chỉ làm tròn ở phép tính cuối cùng, kết quả làm tròn đến hàng đơn vị).
(5) Pha loãng 3,38 gam oleum X vào nước thành 1,0 lít dung dịch sulfuric acid, sau đó tiến hành chuẩn độ 10,0 mL dung dịch acid này bằng dung dịch chuẩn NaOH 0,10 M. Thể tích NaOH trung bình cần sử dụng để chuẩn độ là 8,00 mL. Phần trăm khối lượng của sulfur trong X là 37,87% (kết quả làm tròn đến hàng phần trăm).
Số phát biểu đúng là bao nhiêu?
(Xem giải) Câu 32. Cho chuỗi chuyển hóa sau:
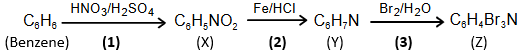
Cho các phát biểu sau:
(1) Phản ứng (1) và (3) đều là phản ứng thế electrophile.
(2) X, Y, Z đều là dẫn xuất hydrocarbon.
(3) Cho Y phản ứng với nitrous acid (HNO2) trong điều kiện nhiệt độ 0 – 5°C thu được phenol.
(4) Phản ứng (2) xảy ra sự oxi hoá chất X.
(5) Ở điều kiện thường, X và Y đều là các chất lỏng không màu.
Liệt kê các phát biểu đúng theo thứ tự tăng dần (ví dụ: 123, 124,…)


Bình luận