[2025 – 2026] Thi học sinh giỏi lớp 12 – Tỉnh Quảng Trị
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề 019-H12C năm 2025-2026
⇒ Thời gian làm bài: 150 phút
Câu 1. (2,0 điểm)
(Xem giải) 1.1. Viết phương trình hóa học xảy ra trong các trường hợp sau:
a) Cho dung dịch Na2CO3 đến dư vào dung dịch AlCl3.
b) Sục khí Cl2 đến dư vào dung dịch FeCl2.
c) Sục khí Cl2 vào dung dịch NaOH loãng ở nhiệt độ thường.
d) Cho dư dung dịch KI vào dung dịch FeCl3.
(Xem giải) 1.2. Khí A (không màu) tác dụng với khí B (màu vàng lục) hoặc khí C đều thu được chất rắn D màu vàng. Khi cho dư khí B tác dụng với dung dịch A hoặc dung dịch C đều thu được acid E (tạo kết tủa trắng với dung dịch BaCl2). Xác định A, B, C, D, E và viết phương trình hóa học các phản ứng xảy ra.
Câu 2. (2,0 điểm)
(Xem giải) 2.1. Viết phương trình hóa học các phản ứng xảy ra trong các trường hợp sau (các chất hữu cơ viết dưới dạng công thức cấu tạo):
a) Đun nóng ethyl acetate với dung dịch HCl.
b) Cho dung dịch glucose vào nước bromine.
c) Cho từ từ dung dịch methylamine đến dư vào dung dịch FeCl3.
d) Thủy phân dipeptide Gly-Ala trong dung dịch HCl dư.
(Xem giải) 2.2. Aniline là nguyên liệu quan trọng trong công nghiệp phẩm nhuộm, dược phẩm…
a) Viết phương trình hóa học của aniline (dưới dạng công thức cấu tạo) lần lượt với dung dịch chứa hỗn hợp NaNO2 và HCl ở nhiệt độ 0 đến 5°C; dung dịch bromine.
b) Ống nghiệm bị dính aniline sau khi làm thí nghiệm thường rất khó rửa sạch bằng nước. Hãy đề xuất một cách rửa sạch ống nghiệm trên bằng các hóa chất thông thường trong phòng thí nghiệm, giải thích vì sao chọn chất đó?
Câu 3. (2,0 điểm)
(Xem giải) 3.1. Trong phòng thí nghiệm, người ta điều chế khí Z từ chất rắn X và chất lỏng Y như hình vẽ bên.
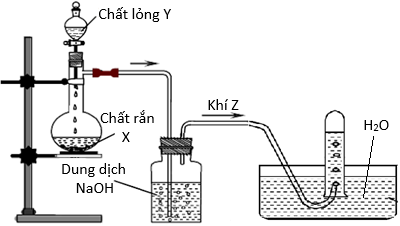
Hãy cho biết đặc điểm tính chất vật lý, hóa học của khí Z và đề nghị 2 chất hữu cơ Z có thể điều chế như hình vẽ, viết phương trình hóa học các phản ứng điều chế đó.
(Xem giải) 3.2. Các hợp chất hữu cơ A, B, C đều mạch hở, chứa tối đa 2 nhóm chức và có tổng số nguyên tử trong mỗi phân tử nhỏ hơn 16; tỉ lệ số nguyên tử C : H : O trong phân tử A, B, C đều bằng 1 : 2 : 1. Trong đó: Chỉ có A tác dụng được với dung dịch NaOH; khi cho A tác dụng với Na (dư) thì số mol H2 sinh ra bằng số mol A phản ứng. A, B bị oxi hóa bởi CuO khi đun nóng tạo sản phẩm A1, B1. Chất A1, B1, C bị oxi hóa bởi thuốc thử Tollens (dư). Viết phương trình hóa học các phản ứng xảy ra.
Câu 4. (2,0 điểm)
(Xem giải) 4.1. Tiến hành thí nghiệm phân huỷ NO2 ở 300°C theo phương trình: 2NO2(g) → 2NO(g) + O2(g). Kết quả thí nghiệm được biểu diễn ở bảng sau:
| Thời gian (s) | 150 | 200 | 250 | |
| Nồng độ (mol/L) NO2 | 0,0120 | 0,0056 | 0,0049 | 0,0045 |
a) Tính tốc độ trung bình của phản ứng trên trong 150 giây đầu tiên.
b) Tốc độ trung bình của phản ứng trên thay đổi như thế nào theo thời gian.
(Xem giải) 4.2. Một nhóm học sinh làm thí nghiệm khảo sát ảnh hưởng của nhiệt độ và áp suất đến cân bằng 2NO2(g) ⇋ N2O4(g) thông qua việc quan sát sự đổi màu của hỗn hợp khí NO2 và N2O4. Ở trạng thái cân bằng đựng trong các xi-lanh trong suốt đã bịt kín như sau:
• Thí nghiệm 1: Ngâm một xi-lanh vào cốc nước nóng thì thấy màu khi trong xi-lanh đậm hơn.
• Thí nghiệm 2: Nén pít-tông của một xi-lanh để làm giảm thể tích và tăng áp suất trong ống. Lúc này, mẫu của khí trong xi-lanh đậm hơn. Sau một thời gian, khí trong ống lại nhạt màu hơn. Biết khí NO2 có màu nâu đỏ, khí N2O4 không màu.
a) Dựa vào hiện tượng ở thí nghiệm 1, hãy cho biết phản ứng 2NO2(g) ⇋ N2O4(g) là phản ứng tỏa nhiệt hay thu nhiệt, giải thích.
b) Hãy giải thích hiện tượng quan sát được ở thí nghiệm 2 giúp nhóm học sinh trên.
(Xem giải) Câu 5. (1,5 điểm)
A, R, M, D, E theo thứ tự là 5 nguyên tố liên tiếp trong bảng tuần hoàn các nguyên tố hóa học và có điện tích hạt nhân tăng dần. Tổng số đơn vị điện tích hạt nhân của A, R, M, D, E là 90.
a) Xác định các nguyên tố A, R, M, D, E.
b) Sắp xếp theo chiều tăng dần bản kinh các nguyên tử và ion: A, R, D, D+, E2+, giải thích?
c) Viết dạng công thức theo mô hình VSEPR và dự đoán dạng hình học của các phân tử và ion: H2A; AO3; AO42-.
Câu 6. (3,0 điểm)
(Xem giải) 6.1. Hợp chất hữu cơ đơn chức X có công thức phân tử là C3H6O2. Khi X tác dụng với dung dịch KOH (dư), thu được chất hữu cơ Y có MY > 97. Phổ IR của hợp chất X và số sóng hấp thụ của một số loại liên kết được biểu diễn như hình sau:
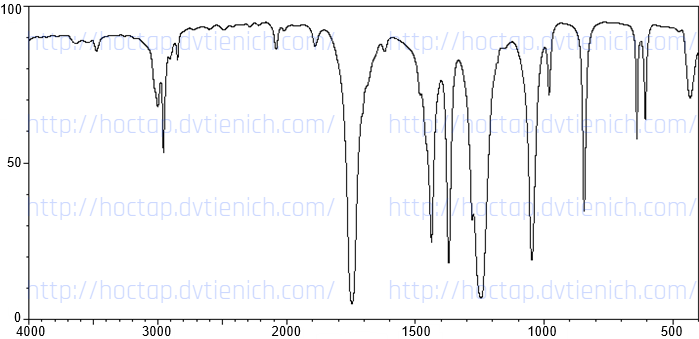
| Liên kết | O-H (alcohol) | O-H (acid) | C-H | C=O | C-O |
| Số sóng (cm-1) | 3500 – 3200 | 3300 – 2500 | 3000 – 2800 | 1800 – 1650 | 1300 – 1000 |
Xác định công thức cấu tạo của X (giải thích), gọi tên hợp chất X theo danh pháp thay thế. Biết tín hiệu hồng ngoại của liên kết O-H có đặc điểm là chân rộng và đỉnh tù.
(Xem giải) 6.2. Methyl butanoate có mùi thơm của trái cây nên thường được sử dụng trong công nghiệp sản xuất bánh kẹo, nước giải khát… Trong phòng thí nghiệm, methyl butanoate được tổng hợp bằng cách đun nóng hỗn hợp gồm methanol, butanoic acid và sulfuric acid đặc trong bình cầu chịu nhiệt ở điều kiện thích hợp. Sau một thời gian thu được hỗn hợp E gồm alcohol, acid, ester và nước. Biết một số tính chất vật lí của các chất trong hỗn hợp E như sau:
| Chất | Khối lượng riêng ở 25°C (g/mL) | Độ tan ở 25°C (g/100g nước) | Nhiệt độ sôi (°C) |
| H2O | 1,00 | 100 | |
| CH3OH | 0,79 | tan vô hạn | 64,7 |
| CH3CH2CH2COOH | 0,96 | tan vô hạn | 163,5 |
| CH3CH2CH2COOCH3 | 0,89 | 1,4 | 102 |
a) Viết phương trình hóa học điều chế methyl butanoate.
b) Để yên bình cầu một thời gian, hỗn hợp bị phân thành 2 lớp. Hãy cho biết thành phần chính ở lớp chất lỏng nổi phía trên.
c) Để tách methyl butanoate ra khỏi hỗn hợp E, người ta thường thêm dung dịch NaCl bão hòa vào E. Cho biết vai trò của NaCl? Để tách methyl butanoate ra khỏi hỗn hợp E, nên chọn phương pháp chưng cất hay phương pháp chiết?
(Xem giải) 6.3. Hợp chất hữu cơ A (tồn tại ở dạng trans) có công thức phân tử C9H8O, có trong thành phần của tinh dầu quế. Chất A có phản ứng với thuốc thử Tollens, làm nhạt màu dung dịch Br2 trong CCl4. Oxi hóa A bằng dung dịch KMnO4 (trong sulfuric acid loãng) đun nóng, thu được benzoic acid. Xác định A và viết phương trình hóa học các phản ứng xảy ra.
(Xem giải) Câu 7. (2,0 điểm) Cho các phản ứng đốt cháy sau:
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(g)  = -2004 kJ
= -2004 kJ
C4H10(g) + 6,5O2(g) → 4CO2(g) + 5H2O(g)  = -2607 kJ
= -2607 kJ
Biết năng lượng liên kết trong các hợp chất cho trong bảng sau:
| Liên kết | O=O | H-O | C=O | C=C |
| Năng lượng liên kết (kJ/mol) | 498 | 467 | 799 | 612 |
a) Tính năng lượng liên kết Eb(C-C) và Eb(C-H)
b) Người ta dùng 1 loại gas chỉ gồm C4H10 và C3H8 để dun sôi 2 L nước từ 25°C cần dùng 24 gam gas. Biết nhiệt dung của nước là 4,2 J/g.K, khối lượng riêng của nước là 1 g/mL nước sôi ở 100°C; giả sử lượng nhiệt hao hụt là 41,81%. Tính phần trăm thể tích các chất trong gas.
Câu 8. (2,0 điểm)
(Xem giải) 8.1. Trong công nghiệp, glycerol được điều chế từ propene theo sơ đồ sau:
![]()
Hãy viết phương trình hóa học của các phản ứng xảy ra.
(Xem giải) 8.2. Viết phương trình hóa học và trình bày cơ chế tạo sản phẩm chính các phản ứng sau:
a) Propene + HBr →
b) Nitrobenzene + HNO3 (bốc khói) (1 : 1, H2SO4 đặc nóng) →
Câu 9. (2,0 điểm)
(Xem giải) 9.1. Một pin điện hóa đơn giản có thể được lắp ráp bằng cách cắm hai thanh kim loại (Zn và Cu) vào một quả chanh tươi và không để chúng chạm vào nhau, nối hai thanh kim loại với bóng đèn (như hình vẽ) thì bóng đèn phát sáng.

Khi pin hoạt động, thanh kim loại nào đóng vai trò là anode, thanh kim loại nào đóng vai trò là cathode? Viết các quá trình oxi hóa khử xảy ra trên bề mặt các kim loại và phương trình hóa học của phản ứng xảy ra trong pin?
(Xem giải) 9.2. Để mạ lên một vật kim loại hình trụ, có bán kính 2,5 cm, cao 20 cm, một lớp nickel dày 0,4 mm bằng phương pháp mạ điện, người ta sử dụng phương pháp điện phân với anode là một thanh kim loại nickel, cathode là vật cần mạ ngâm trong bể mạ chứa dung dịch NiSO4.
a) Viết các quá trình oxi hóa khử xảy ra trên bề mặt các điện cực.
b) Tính thời gian mạ điện nếu sử dụng dòng điện có cường độ 9A. Biết khối lượng riêng của Ni là 8,9 g/cm³, giả thiết toàn bộ nickel tạo ra bám đều lên vật cần mạ.
Câu 10 (1,5 điểm)
(Xem giải) 10.1. Kết quả phân tích 10 mL một loại rượu vang 9,2°, có chứa 180 mg glucose. Giả thiết rượu được lên men trực tiếp từ dung dịch đường nho, các chất khác không tham gia phản ứng trong quá trình lên men. Tính hiệu suất của quá trình lên men để tạo loại rượu trên. Biết khối lượng riêng của C2H5OH là 0,8 gam/mL.
(Xem giải) 10.2. Ion Ca2+ cần thiết cho máu của người bình thường. Nồng độ ion Ca2+ không bình thường là dấu hiệu của bệnh. Để xác định nồng độ ion calcium, người ta lấy 5 mL máu cho phản ứng với 10 mL dung dịch potassium oxalate 2.10^-3 M. Sau khi phản ứng xảy ra hoàn toàn, lọc lấy kết tủa calcium oxalate rồi chuẩn độ dung dịch thu được bằng dung dịch potassium permanganate 10^-3 M trong môi trường acid. Thể tích dung dịch potassium permanganate cần dùng là 4,6 mL. Giả thiết các chất còn lại trong máu không tham gia phản ứng. Xác định nồng độ ion calcium trong mẫu người đó theo đơn vị mg Ca2+/100 mL mẫu.


Bình luận