[2025] Khảo sát đầu năm trường Tiên Du 1 – Bắc Ninh
⇒ File word đề thi, đáp án và giải chi tiết
⇒ Mã đề: 004
⇒ Nội dung đề thi và giải chi tiết (xem đáp án ở cuối đề):
PHẦN I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
(Xem giải) Câu 1. Chất lỏng X không làm nhạt màu dung dịch KMnO4 ở điều kiện thường nhưng làm mất màu dung dịch KMnO4 khi đun nóng. X là chất nào trong các chất sau đây?
A. Vinylbenzene. B. 1,2-Dimethylbenzene.
C. Naphtalene. D. Benzene.
(Xem giải) Câu 2. Chất nào sau đây thuộc loại chất điện li yếu?
A. HCl. B. CH3COOH. C. NaCl. D. C2H5OH.
(Xem giải) Câu 3. Chất nào sau đây thuộc loại hợp chất ion?
A. CH4. B. CH3NH2. C. NaCl. D. H2O.
(Xem giải) Câu 4. Dung dịch acetic acid phản ứng được với tất cả các chất trong dãy nào sau đây?
A. Zn, CuO, NaCl. B. Cu, NaOH, NaCl.
C. Zn, NaOH, CaCO3. D. Cu, CuO, HCl.
(Xem giải) Câu 5. Trong công nghiệp hóa dầu, các alkane thường được loại bỏ hydrogen trong các phản ứng dehydrogen hóa để tạo ra các hydrocacbon không no có nhiều ứng dụng hơn như phản ứng sau:
CH3-CH2-CH2-CH3 (t°) → CH2=CH-CH=CH2 + 2H2
Cho các liên kết và giá trị năng lượng liên kết của một số liên kết cộng hóa trị như sau:
| Liên kết | H-H | C-H | C-C | C=C |
| Eb (kJ/mol) | 436 | 414 | 347 | 611 |
Biến thiên anthalpy chuẩn của phản ứng ở trên là
A. +1056 kJ. B. -166 kJ. C. -432 kJ. D. +256 kJ.
(Xem giải) Câu 6. Hợp chất E được điều chế từ alcohol X và acid Y (biết Y là hợp chất tạp chức chứa vòng benzene). E có trong thành phần của một số thuốc giảm đau, xoa bóp, cao dán,… dùng để điều trị đau lưng, căng cơ, bong gân,.. Thành phần về khối lượng các nguyên tố trong E như sau: 63,16%C, 5,26%H và 31,58%O. Phố IR của E ngoài vùng hấp thụ với peak đặc trưng của liên kết C=O (số sóng 1750-1735 cm-1), liên kết C-O (số sóng 1300-1000 cm-1) còn có peak đặc trưng của liên kết O-H (số sóng 3650 – 3200 cm-1). Từ phổ MS, xác định được E có phân tử khối là 152. Cho các phát biểu sau:
(1) X là methyl alcohol.
(2) Tổng số nguyên tử trong phân tử E là 20.
(3) Y có nhóm -OH và -COOH.
(4) 1 mol Y tác dụng vừa đủ với 2 mol NaOH.
Số phát biểu đúng là
A. 2. B. 1. C. 4. D. 3.
(Xem giải) Câu 7. Chất nào sau đây có thể hòa tan được Cu(OH)2/NaOH ở nhiệt độ thường tạo ra dung dịch màu xanh lam?
A. Acetone. B. Acetaldehyde. C. Glycerol. D. Propyl alcohol.
(Xem giải) Câu 8. Hợp chất CH2=CH2 có tên gọi là
A. propene. B. ethane. C. methane. D. ethene.
(Xem giải) Câu 9. Chất nào sau đây tác dụng được với NaOH theo tỉ lệ số mol 1 : 1?
A. 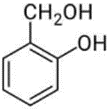 B.
B. 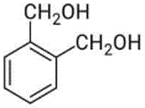 C.
C. 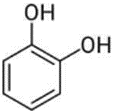 D.
D. 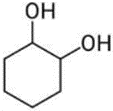
(Xem giải) Câu 10. Cho phản ứng sau: 2NO(g) + O2(g) ⇋ 2NO2(g) ![]() = -115 kJ
= -115 kJ
Nhận xét nào sau đây sai?
A. Nếu tăng áp suất thì cân bằng trên chuyển dịch theo chiều thuận.
B. Nếu tăng nhiệt độ thì cân bằng trên chuyển dịch theo chiều thuận.
C. Phản ứng thuận là phản ứng tỏa nhiệt.
D. Hẳng số cân bẳng của phản ứng trên phụ thuộc vào nhiệt độ.
(Xem giải) Câu 11. Đun nóng hỗn hợp gồm CH3CH2CH2Cl và dung dịch NaOH, sau đó gạn lấy lớp dung dịch và acid hóa bằng dung dịch HNO3, nhỏ tiếp vào đó dung dịch AgNO3. Hiện tượng quan sát được là
A. có kết tủa màu trắng. B. có kết tủa trắng, lắc nhẹ thì thấy tan dần.
C. có khí không màu, không mùi. D. có khí màu nâu đỏ.
(Xem giải) Câu 12. Cho phản ứng sau: Propene + H2O (xt, t°) → X. Công thức hóa học của sản phẩm chính là
A. CH3COCH3. B. CH3CH2COOH.
C. CH3CHOHCH3. D. CH3CH2CH2OH.
(Xem giải) Câu 13. Nhỏ nước bromine vào dung dịch nào sau đây thì xuất hiện kết tủa trắng?
A. Ethylene glycol. B. Methylic alcohol.
C. Phenol. D. Allyl alcohol.
(Xem giải) Câu 14. Để loại bỏ lớp cặn màu trắng (thành phần chính là CaCO3 và MgCO3) trong ấm đun nước, vòi nước, thiết bị vệ sinh,… trong gia đình, ta có thể dùng dung dịch nào sau đây?
A. Muối ăn. B. Dầu ăn. C. Rượu uống. D. Giấm ăn.
(Xem giải) Câu 15. Cho X và Y là hai hợp chất hữu cơ có cùng công thức đơn giản nhất. Phân tích định lượng các nguyên tố trong Y thì có phần trăm khối lượng các nguyên tố là: 85,71%C; 14,29%H. Phổ MS của hai hợp chất này được cho trong hình sau:
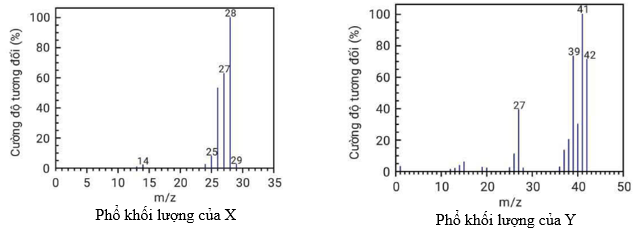
Biết mảnh [M+] của chất X có cường độ tương đối lớn nhất, mảnh [M+] của chất Y có giá trị m/z lớn nhất. Công thức phân tử của X và Y lần lượt là
A. C2H4 và C3H8. B. C2H4 và C3H6.
C. C3H6 và C2H4. D. C2H2 và C6H6.
(Xem giải) Câu 16. Bảng dưới đây cho biết nhiệt lượng toả ra khi đốt cháy hoàn toàn 1 mol alkane.
| Alkane | CTPT | Phân tử khối | Nhiệt lượng (kJ/mol) |
| Methane | CH4 | 16 | 891 |
| Ethane | C2H6 | 30 | 1561 |
| Propane | C3H8 | 44 | 2220 |
| Butane | C4H10 | 58 | 2878 |
Đốt cháy 100 gam alkane nào trong số các alkane ở trên toả ra nhiều nhiệt lượng nhất?
A. Propane. B. Butane. C. Ethane. D. Methane.
(Xem giải) Câu 17. Trong các chất sau, chất nào có nhiệt độ sôi thấp nhất?
A. C3H8. B. C2H5OH. C. CH3CHO. D. CH3COOH.
(Xem giải) Câu 18. Nhận xét nào sau đây đúng?
A. Acetaldehyde đóng vai trò chất oxi hóa khi tác dụng với nước bromine.
B. Benzaldehyde bị khử bởi NaBH4, tạo ra benzyl alcohol.
C. Formaldehyde phản ứng với I2 trong môi trường kiềm, tạo ra iodoform.
D. Acetone bị oxi hóa bởi thuốc thử Tollens, tạo ra Ag.
PHẦN II: Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chỉ chọn đúng hoặc sai.
(Xem giải) Câu 19. Khí sulfur dioxide (SO2) do các nhà máy thải ra là nguyên nhân chính trong việc gây ô nhiễm môi trường. Theo quy chuẩn kỹ thuật quốc gia về chất lượng không khí (QCVN 05:2013/ BTNMT) nếu nồng độ SO2 vượt quá 350 μg/m³ không khí (được đo trong 1 giờ) ở thành phố thì không khí bị ô nhiễm.
a. Số oxi hóa của sulfur trong SO2 là +6.
b. Khi SO2 tác dụng với NO2 (ở điều kiện thích hợp) thì SO2 đóng vai trò chất khử.
c. Lấy 50 L không khí trong 1 giờ ở một thành phố và phân tích thấy có 0,012 mg SO2 thì có thể kết luận không khí ở đó bị ô nhiễm.
d. Sulfur dioxide là nguyên nhân chính gây ra hiện tượng mưa acid.
(Xem giải) Câu 20. Đun nóng hỗn hợp gồm ethyl alcohol, acetic acid và sulfuric acid đặc ở điều kiện thích hợp để tổng hợp ra ester E. Sau một thời gian phản ứng thì thu được hỗn hợp X. Tiến hành tách được chất E từ X. Cho các thông số tính chất vật lý sau:
| Chất | Khối lượng riêng (g.mL-1) | Độ tan trong 100 g nước(g) | Nhiệt độ sôi (oC) |
| H2O | 1,00 | 100 | |
| C2H5OH | 0,79 | ∞ | 78 |
| CH3COOH | 1,05 | ∞ | 118 |
| CH3COOC2H5 | 0,90 | 2 | 77 |
a. Phản ứng ester hóa giữa ethyl alcohol và acetic acid là phản ứng một chiều.
b. Để tách E ra khỏi X, sử dụng phương pháp chưng cất sẽ phù hợp hơn phương pháp chiết.
c. Phổ IR của E có peak hấp thụ đặc trưng của liên kết C=O và C-O.
d. Ở phản ứng trên có sự tách OH từ phân tử acetic acid và H từ phân tử ethyl alcohol.
(Xem giải) Câu 21. Dẫn xuất monohalogen X có phần trăm khối lượng của C và H lần lượt là 35,05% và 6,75%, còn lại là bromine. Trong phân tử X, nguyên tử bromine liên kết với nguyên tử carbon bậc II.
a. Tổng số nguyên tử trong phân tử X là 14.
b. Đun nóng X với NaOH trong ethanol, thu được tối đa 3 alkene.
c. Trong phân tử X có 1 liên kết đôi C=C.
d. Chất X có mạch carbon không phân nhánh.
(Xem giải) Câu 22. Hằng số phân li acid Ka (trong H2O ở 25°C) của một số hợp chất được thể hiện trong bảng dưới đây. Giá trị của Ka càng lớn, tính acid càng mạnh.
| Hợp chất | Phenol | Picric acid | Acetic acid | Carbonic acid |
| Ka | 10^-10 | 0,4 | 1,8.10^-5 | 5.10^-7 (nấc 1); 5.10^-11 (nấc 2) |
a. Khi cho vào nước, acetic acid và phenol đều ít tan trong nước.
b. Nếu cho quỳ tím vào dung dịch picric acid, quỳ tím không chuyển màu.
c. Nếu cho picric acid vào dung dịch muối sodium carbonate, có bọt khí thoát ra từ dung dịch.
d. Nếu sục khí CO2 vào dung dịch muối sodium phenolate trong suốt, dung dịch bị đục trở lại.
PHẦN III: Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
(Xem giải) Câu 23. Tiến hành chuẩn độ dung dịch NaOH chưa biết nồng độ bằng dung dịch chuẩn HCl 0,10M với chất chỉ thị phenolphtalein như sau:
Bước 1: Dùng pipette lấy 10 mL dung dịch HCl 0,10M vào bình tam giác, thêm 1-2 giọt chất chỉ thị phenolphtalein.
Bước 2: Cho dung dịch NaOH vào burette, điều chỉnh dung dịch trong burette về mức 0.
Bước 3: Mở khóa burette, nhỏ từng giọt dung dịch NaOH xuống bình tam giác (lắc đều trong quá trình chuẩn độ) cho đến khi dung dịch xuất hiện màu hồng nhạt (bền trong khoảng 10 giây) thì dừng chuẩn độ.
Bước 4: Ghi lại thể tích dung dịch NaOH đã dùng.
Nếu thể tích dung dịch NaOH đã dùng là 12 mL thì nồng độ mol/L của dung dịch NaOH ban đầu là bao nhiêu?
(Làm tròn kết quả đến hàng phần trăm)
(Xem giải) Câu 24. Aspirin là một chất được sử dụng làm giảm đau, hạ sốt được điều chế theo phản ứng sau: o-HO-C6H4-COOH + (CH3CO)2O → o-CH3COO-C6H4-COOH + CH3COOH. Để sản xuất một lô thuốc aspirin gồm 2,7 triệu viên nén (mỗi viên chứa 500 mg aspirin) cần tối thiểu m kg salicylic acid, biết hiệu suất phản ứng là 90% tính theo salicylic acid. Tính giá trị của m. (Làm tròn kết quả đến hàng đơn vị)
(Xem giải) Câu 25. Cho sơ đồ chuyến hoá sau:
![]()
Các chất X, Y, Z đều là chất hữu cơ và đều là sản phẩm chính của các phản ứng.
(1) Công thức cấu tạo của X là CH3CHBrCH3.
(2) Tên gọi của Y là propan-1-ol.
(3) Độ tan trong nước của X lớn hơn Y.
(4) Chất Z tham gia phản ứng tráng bạc.
(5) Khi cho hơi Y đi qua bột Al2O3 đun nóng, thu được propene.
(6) Chất Z phản ứng với I2 trong môi trường kiềm, tạo ra iodoform.
Hãy liệt kê các phát biểu đúng. (Theo số thứ tự tăng dần)
(Xem giải) Câu 26. Bromine có thể được tạo thành từ phản ứng sau: BrO3-(aq) + 5Br-(aq) + 6H+(aq) → 3Br2(aq) + 3H2O(l)
Tốc độ của phản ứng có dạng v = k[BrO3-][Br-][H+]². Giữ nguyên nhiệt độ, để tăng tốc độ sinh ra Br2 người ta tăng nồng độ H+ lên gấp đôi và nồng độ Br- lên gấp ba (giữ nguyên nồng độ BrO3-). Cho biết tốc độ phản ứng điều chế Br2 tăng lên bao nhiêu lần?
(Xem giải) Câu 27. Ethanol có thể được sản xuất từ cellulose hoặc tinh bột, loại ethanol này được dùng trong xăng E5 (xăng chứa 5% ethanol về thể tích). Lượng ethanol thu được từ 1,62 tấn mùn cưa (chứa 50% cellulose, còn lại là chất trơ) được dùng để pha chế V m³ xăng E5. Biết hiệu suất quá trình sản xuất ethanol từ cellulose là 60%, ethanol có khối lượng riêng là 0,8 g/mL. Tính giá trị của V. (Làm tròn kết quả đến hàng phần mười)
(Xem giải) Câu 28. Cho dãy các chất sau: (1) but-2-yne, (2) propanal, (3) benzaldehyde, (4) acetone, (5) propene, (6) acetylene. Hãy liệt kê các chất tạo được kết tủa khi tác dụng với dung dịch thuốc thử Tollens. (Theo số thứ tự tăng dần)
BẢNG ĐÁP ÁN
| Phần I | ||||||||
| 1B | 2B | 3C | 4C | 5D | 6D | 7C | 8D | 9A |
| 10B | 11A | 12C | 13C | 14D | 15B | 16D | 17A | 18B |
| Phần II | |||||
| Câu | Lệnh hỏi | Đáp án | Câu | Lệnh hỏi | Đáp án |
| 19 | a | S | 21 | a | Đ |
| b | Đ | b | Đ | ||
| c | S | c | S | ||
| d | Đ | d | Đ | ||
| 20 | a | S | 22 | a | S |
| b | S | b | S | ||
| c | Đ | c | Đ | ||
| d | Đ | d | Đ | ||
| Phần III | |||
| Câu | Đáp án | Câu | Đáp án |
| 23 | 0,08 | 26 | 12 |
| 24 | 1150 | 27 | 6900,0 |
| 25 | 1,5,6 | 28 | 2,3,6 |


Bình luận